黑果腺肋花楸组织培养与快速繁殖
张成霞, 吴 红, 刘 行, 居 涛, 李波广, 王 瑞, 仲启明, 汤庚国, 张衡锋
(1.江苏农牧科技职业学院园林园艺学院,江苏泰州 225300; 2.南京林业大学森林资源与环境学院,江苏南京 210037)
黑果腺肋花楸(Aroniamelanocarpa)是引自美国东部的一种蔷薇科腺肋花楸属的落叶灌木,其是集药用、食用及城市绿化于一体的优良树种,耐贫瘠、挂果早、经济效益高,有很大的市场前景[1]。1990年以后陆续被引入我国东北,并定植于辽西地区[2]。由于其树形优美、观赏期长,是春观叶、夏观花、秋观果的优质绿化树种[3],可孤植也可在公园、路旁等城市绿地中大量种植[4]。黑果腺肋花楸鲜果中黄酮类物质较高,果实富含花青素、多酚、胡萝卜素等[5],对心血管疾病具有特殊疗效,且具有抗衰老功能,广泛应用于医药和功能食品工业[6];同时,黑果腺肋花楸抗旱、抗寒能力强,且生长所需水分很少,故在降水较少的干旱地区也完全可以存活,极限低温-40 ℃以上的气候也能正常生长发育[3,7]。黑果腺肋花楸根系为浅根性,水平根发达,枝条萌蘖能力强,对30~40 cm 土层的固定力强,病虫害极少,对风害、冰雹等自然灾害抗性强,保持水土效果较好,生态能力强[8]。当前黑果腺肋花楸种苗的市场需求量大,由于传统播种繁殖和扦插育苗速度缓慢且实施困难,采用组织培养方法加可快其繁殖速度,能在短时间内获取大量组培苗,满足市场对其种苗的需求。国内有关黑果腺肋花楸组培快繁的研究报道仅局限于原生质体、胚乳愈伤组织、组培苗瓶外生根、不定芽的诱导与增殖等方面[8-12],对不同外植体诱导的筛选、增殖、组培苗生根和驯化移栽等研究尚未见报道,故本研究以黑果腺肋花楸为材料,选择不同种类的外植体进行组织培养快繁体系研究,拟筛选出适宜黑果腺肋花楸快繁的生长调节剂浓度组合,为进行工厂化育苗的快速繁殖提供理论依据,同时为大面积开发黑果腺肋花楸优良种苗奠定基础。
1 材料与方法
1.1 试验材料
试验所用材料于2015年10月从辽宁引种栽培在江苏农牧科技职业学院园林园艺学院实训种植基地。2016年4月,在已经萌芽的黑果腺肋花楸植株上选取生长健壮、无病虫害的枝条供试验用。试验在江苏农牧科技职业学院园林园艺学院组培室进行。
1.2 试验方法
1.2.1 无菌材料的获得与消毒 从黑果腺肋花楸所采的枝条上分别取材腋芽、茎段和叶片,切成小段,放入适量水中,然后用自来水冲洗30 min。将腋芽、叶片、茎段先用75%乙醇漂洗15~30 s,然后用氯化汞溶液对腋芽、叶片、茎段分别消毒30、15、60~120 s,后用无菌水冲4~5次,用无菌滤纸吸干外植体表面水分供试用。本试验培养基pH值均调至 5.8~6.0,高压灭菌(1 100 Pa,121 ℃)15 min。培养室温度为(23±2) ℃,光照度为1 500~2 000 lx,光照时间为 16 h/d。
1.2.2 外植体的诱导 将已消毒的腋芽、茎段(切除两端,留长度约为1.5 cm)、叶片(大小切成为0.5~0.8 cm)分别接种到添加不同浓度(1.0、2.0、3.0 mg/L)的6-BA和NAA(0.1、0.2和0.3 mg/L)的MS基本培养基上(表1),每个处理接种30个外植体,重复3次。每7 d观察1次,30 d后分别统计腋芽、叶片、茎段的诱导率和生长情况。
诱导率=出愈外植体个数/接种外植体个数×100%[13]。

表1 外植体诱导的因素水平
1.2.3 初代愈伤组织的增殖培养 选择无污染、长势好的初代愈伤组织,分别接种到添加不同浓度的6-BA(1.0、2.0、3.0 mg/L)和NAA(0.2、0.4、0.6、0.8、1.0 mg/L)的MS基本培养基中(表2),每个处理接种30个愈伤组织,重复3次。每4 d观察1次,30 d后统计结果,计算愈伤组织分化率,并记录生长状况。
愈伤组织分化率=形成不定芽的愈伤组织数/总愈伤组织数×100%[13]
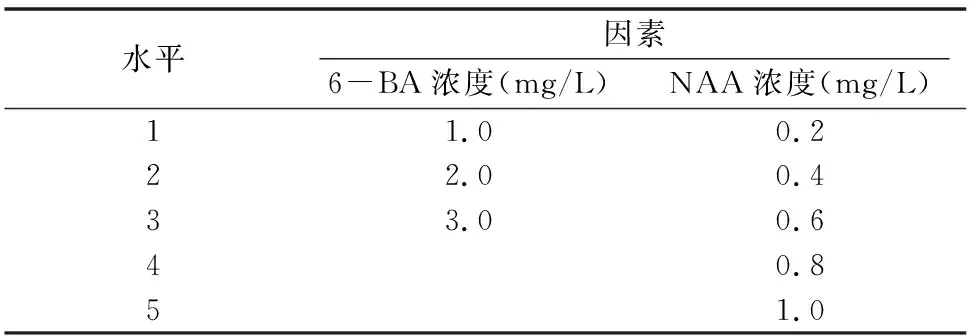
表2 增殖培养的因素水平
1.2.4 组培苗的生根诱导 将长度约2 cm的植株转接至含有不同浓度的NAA(0.1、0.3、0.5、0.7、0.9 mg/L)和IBA(0.1、0.3、0.5、0.7和0.9 mg/L)的1/2 MS培养基上(表3)进行生根培养。30 d后对生根率、根数、根长和苗生长情况分别进行统计。
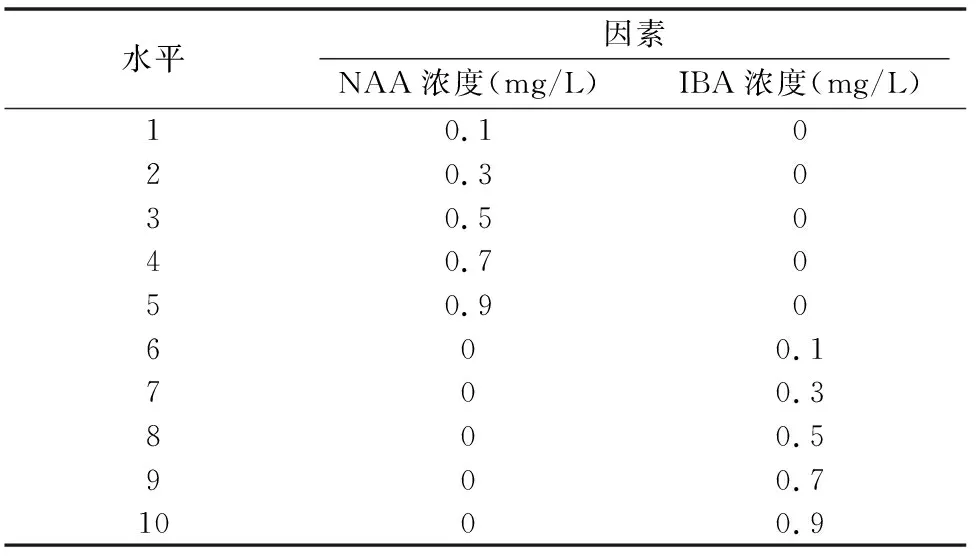
表3 生根诱导的因素水平
1.2.5 组培苗驯化与移栽 生根培养到19 d时,选取根系健壮的黑果腺肋花楸无菌苗进行驯化和移栽。首先,将无菌苗从培养室移至常温室内,去掉封口膜放置3 d,然后取出苗用自来水冲洗根部附着的培养基,最后将苗移栽到事先准备好的草炭土和珍珠岩的混合基质(V草炭土∶V珍珠岩=1 ∶1)中,浸透水后放置在通风良好、湿度较高、光照充足的环境条件下培养,观察记录幼苗生长情况,30 d后统计移栽成活率。
1.3 数据分析
试验数据先用Excel进行初步处理后,用DPS(15.10)高级版软件对数据进行方差分析,试验数据以“平均数±标准差”表示,P<0.05为差异显著性判断标准。
2 结果与分析
2.1 不同浓度生长调节剂组合对不同外植体诱导的影响
从表4可以看出,将黑果腺肋花楸的腋芽、茎段和叶片分别接种到添加不同浓度的6-BA和NAA组合的基本培养基中,4 d腋芽左右开始萌动,茎段和叶片6 d左右开始萌动。腋芽在A6组合(6-BA 2.0 mg/L+NAA 0.3 mg/L)的诱导率最高,达86.67%,显著高于其他组合处理;其次是A3组合(6-BA 1.0 mg/L+NAA 0.3 mg/L),诱导率为71.11%,其显著高于A8(6-BA 3.0 mg/L+NAA 0.2 mg/L)、A1(6-BA 1.0 mg/L+NAA 0.1 mg/L)和A9组合(6-BA 3.0 mg/L+NAA 0.3 mg/L),且A1和A9组合的诱导率最低,为53.33%。茎段诱导率在A5组合(6-BA 2.0 mg/L+NAA 0.2 mg/L)中诱导率最高,为67.78%,在A6(6-BA 2.0 mg/L+NAA 0.3 mg/L)和A9组合(6-BA 3.0 mg/L+NAA 0.3 mg/L)中诱导率最低,为36.67%。叶片的诱导率在A5(6-BA 2.0 mg/L+NAA 0.2 mg/L)和A6(6-BA 2.0 mg/L+NAA 0.3 mg/L)组合中较高,达60.00%以上,显著高于A1、A3、A4和A9组合的诱导率,最高幅达66.65%。
在同一生长调节剂组合下,腋芽、叶片和茎段的诱导率基本表现为腋芽最高,其次是叶片,茎段的诱导率最低(表4)。除A1、A2和A5组合外,其他组合均表现出腋芽的诱导率显著高于叶片或茎段,增幅范围在11.62%~136.35%之间。
综上所述,A5(6-BA 2.0 mg/L+NAA 0.2 mg/L)和A6组合(6-BA 2.0 mg/L+NAA 0.3 mg/L)最适于外植体不定芽的诱导;腋芽、叶片和茎段作为外植体诱导时,腋芽的诱导率最高达86.67%,是最理想的材料。
2.2 不同浓度生长调节剂组合对愈伤组织分化培养的影响
将获得长势好的初代愈伤组织分别接种到添加不同浓度的6-BA和NAA组合的MS基本培养基中观察其增殖生长情况,结果表明,不同浓度的生长调节剂组合对初代愈伤组织增殖分化有一定的促进作用。在B7(6-BA 2.0 mg/L+NAA 0.4 mg/L)、B5(6-BA 1.0 mg/L+NAA 1.0 mg/L)和B8组合(6-BA 2.0 mg/L+NAA 0.6 mg/L)培养基上接种后,4 d就可看到伸长,并长出小的叶片,10 d后茎段已长到1.0 cm,基部产生绿色或淡绿色愈伤组织,并出现许多芽苞,20 d后分化大量小芽,芽深绿色(图1);而B14(6-BA 3.0 mg/L+NAA 0.8 mg/L)和B15组合(6-BA 3.0 mg/L+NAA 1.0 mg/L)在接种后7 d才看到伸长,15 d后基部产生淡绿色的愈伤组织,分化极少小芽,芽浅绿色,少量的根。本试验结果说明愈伤组织的分化主要受细胞分裂素6-BA与生长素NAA二者相对浓度的影响,6-BA和NAA相对浓度增大时均有利于愈伤组织的分化和增殖。
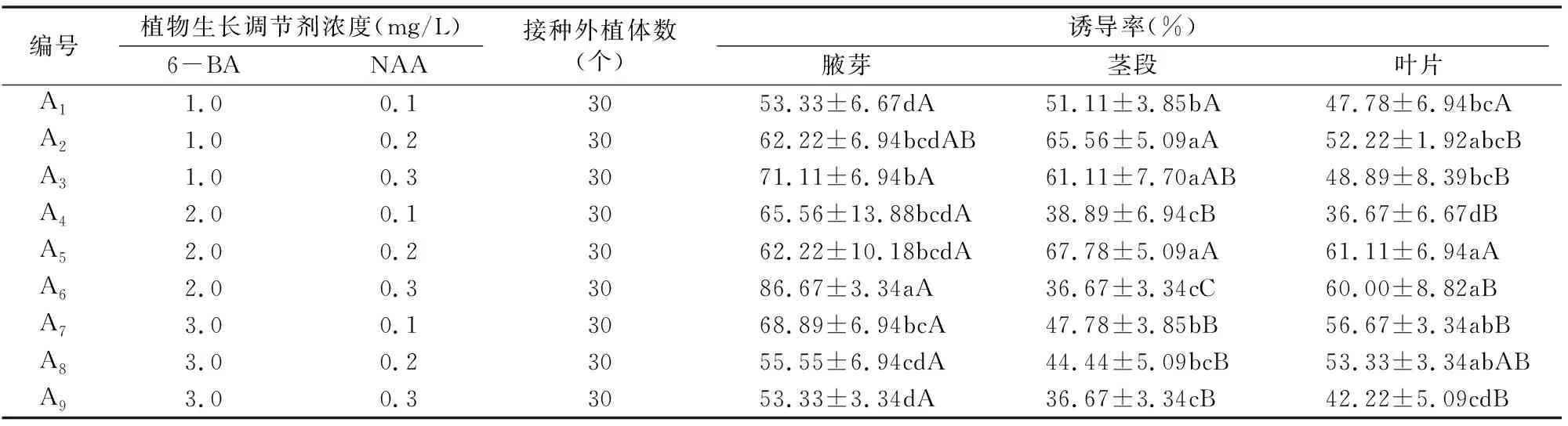
表4 不同浓度生长调节剂组合对不同外植体诱导的影响
注:表中数据是3个重复的平均值,同列中不同小写字母表示差异显著(P<0.05),同行中不同大写字母表示差异极显著(P<0.01)。
黑果腺肋花楸的初代愈伤组织分化率存在显著差异,由表5可看出,B7(6-BA 2.0 mg/L+NAA 0.4 mg/L)的愈伤组织分化率最高,达83.33%,其次是B5(6-BA 1.0 mg/L+NAA 1.0 mg/L)、B8(6-BA 2.0 mg/L+NAA 0.6 mg/L)和B6

组合(6-BA 2.0 mg/L+NAA 0.2 mg/L),分化率分别为85.56%、83.33%和78.89%,分化率最低的是B15组合(6-BA 3.0 mg/L+NAA 1.0 mg/L),为40.00%。除B5和B8组合外,B7组合的愈伤组织分化率显著高于其他各处理组合,最高幅达116.68%。
综上所述,B7(6-BA 2.0 mg/L+NAA 0.4 mg/L)、B5(6-BA 1.0 mg/L+NAA 1.0 mg/L)和B8(6-BA 2.0 mg/L+NAA 0.6 mg/L)组合较适宜黑果腺肋花楸愈伤组织增殖分化,其生长状况也较好。
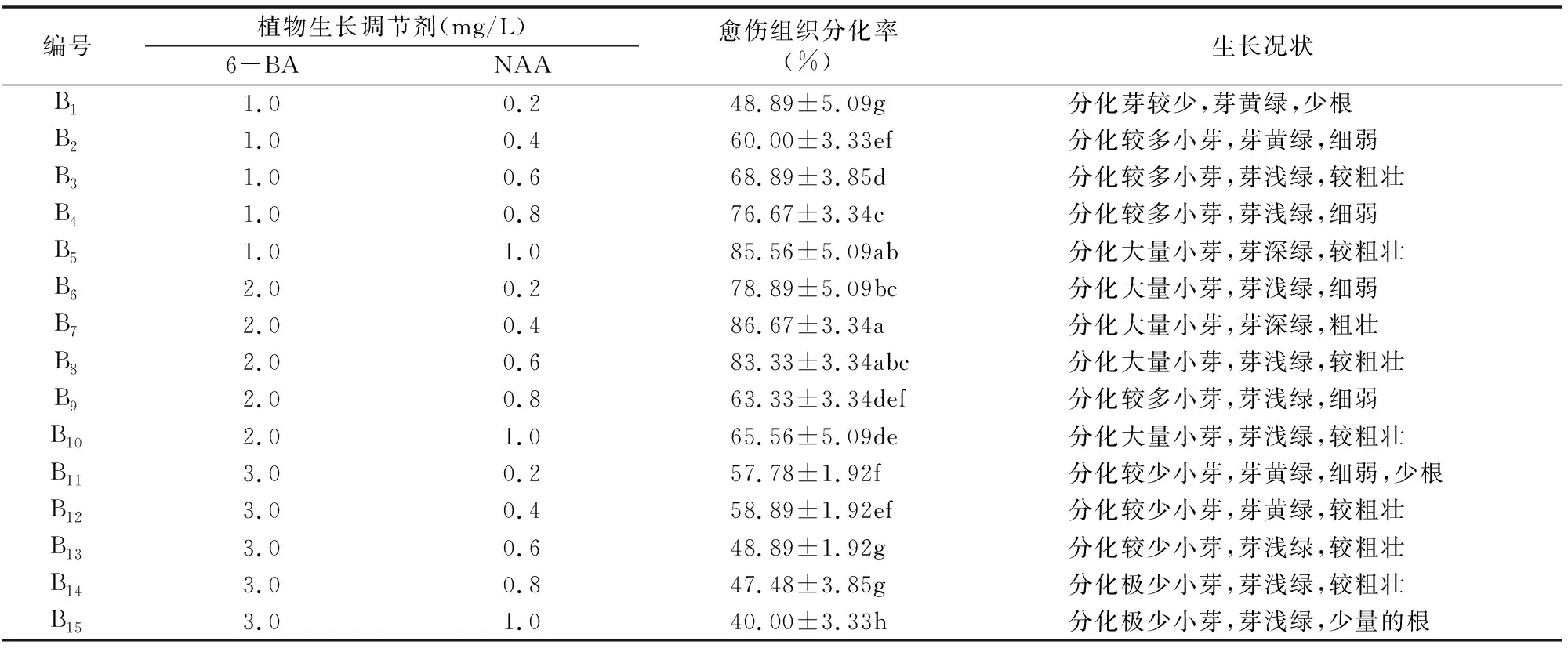
表5 不同浓度生长调节剂组合对愈伤组织增殖分化的影响
注:表中数据是3个重复的平均值,同列中不同小写字母表示差异显著(P<0.05)。下表同。
2.3 不同生长调节剂浓度对组培苗生根诱导的影响
将经分化培养长到2 cm左右的黑果腺肋花楸组培苗转接至1/2 MS培养基上,并添加入不同浓度的NAA和IBA进行生根诱导,试验过程中发现黑果腺肋花楸无菌苗较易生根,接种后4 d左右开始小苗基部出现根原基突起,逐渐长出白色新根,30 d后统计结果(表6)大部分苗生根。生根率在C4培养基(1/2MS+NAA 0.7 mg/L)中最高,达95.33%,显著高于其他处理,生根率大于80.00%的从高到低排序为C8>C3>C7>C2=C9,其对应数值分别为91.67%、88.00%、83.00%、82.33%、82.33%,而C10培养基(1/2MS+IBA 0.9 mg/L)的生根率最低,为69.00%,除C2、C7和C9间差异不显著外,其他各处理间差异显著。根数在C4、C8培养基中较多,平均为5.67、5.37条,显著高于其他各处理培养基,最高幅达220.34%;C3培养基中的根数次之,为4.57条,与其他处理间差异显著;C10培养基中的根数最少,为1.77条。根长变化表现出与根数一样的趋势,在C4、C8培养基中较长,为3.32、3.13 cm,显著高于其他各处理培养基,其次是C7>C9>C3;最短根长在C10培养基中,仅为1.17 cm,显著低于其他9个处理。组培苗在不同培养基上的生长状况与生根率、根数和根长表现一样,即C4和C8培养基中生长较佳,在C10培养基中生长一般。
由试验结果可知,C4(1/2MS+NAA 0.7 mg/L)、C8(1/2MS+IBA 0.5 mg/L)和C3(1/2MS+NAA 0.5 mg/L)组合的培养基较适宜黑材料果腺肋花楸组培苗的生根诱导和生长(图2)。
2.4 组培苗的驯化与移栽
将黑果腺肋花楸生根苗移栽到草炭土 ∶珍珠岩为1 ∶1的基质中,30 d后统计移栽成活率,试验结果表明,移栽成活率高达94.78%,且苗的长势较好(图3)。
3 讨论与结论
植物组培快繁是当前大面积种苗繁育的主要方法之一,其具有节药材料、缩短苗木生产时间等优点。通过组培快繁可提高黑果腺肋花楸种苗的繁殖系数,弥补种子繁殖、扦插等传统育苗方法的不足。已有研究报道证明,黑果腺肋花楸的离体培养、植株再生是切实可行的[7]。目前已发现有利用原生质体、胚乳、组培苗瓶外生根以及不定芽诱导与增殖的研究报道[8-10,12]。本试验选用黑果腺肋花楸的不同外植体为材料,进行诱导筛选、增殖、生根、组培苗驯化移栽等一系列再生体系研究,在此过程中发现不同浓度生长调节剂组合在组织培养过程中起重要作用,可见培养基中添加外源激素直接影响体细胞愈伤组织的诱导及分化[14]。

表6 不同生长调节剂对组培苗生根及生长状况的影响
注:*的数目表示组培苗生长情况:*表示生长一般,**表示生长良好,***表示生长很好,****表示生长最佳。

本研究选取黑果腺肋花楸的腋芽、茎段和叶片不同外植体用不同浓度组合的生长调节剂进行诱导,发现MS+6-BA 2.0 mg/L+NAA 0.2 mg/L培养基组合最适于茎段和叶片的诱导,而MS+6-BA 2.0 mg/L+NAA 0.3 mg/L培养基最适于腋芽的诱导,这与李冬杰等研究报道结果[11]相似。3种外植体中以腋芽的诱导率最高,其次是叶片,茎段的诱导率最低,说明本试验中腋芽是最理想的外植体诱导材料。选配适宜的外植体是植物组培快繁的第1步,因为不同外植体所处的生理状态、分化程度不同,加之外源激素的加入从而表现出不同的再生能力。本试验中低浓度和高浓度的6-BA和NAA均不利于腋芽、茎段和叶片外植体的诱导,可能是过低浓度的生长调节剂组合没有达到外植体诱导的剂量,而高浓度的生长调节剂组合抑制了黑果腺肋花楸外植体的诱导。

试管苗能否不断增殖并进行继代培养,是植物组织培养能否成功的关键。植物生长调节剂是组织培养中必不可少的物质,不同激素组合对于腋芽增殖的效果各不相同[15-16]。本试验对获得的黑果腺肋花楸初代愈伤组织的增殖分化试验中,最适合组织分化的培养基为MS+6-BA 2.0 mg/L+NAA 0.4 mg/L,分化率达86.67%,且分化大量小芽,芽深绿色,粗壮。说明较高浓度(1.0~2.0 mg/L)6-BA与较低浓度(0.4~1.0 mg/L)的NAA组合使用时效果最佳,这与赵健竹等对黑果腺肋花楸不定芽诱导与增殖的研究结果[8]、张春雨等对黑果腺肋花楸离体叶片愈伤组织诱导及再分化的研究结果[17]一致。
生根培养是植物组培快繁的第3个阶段,关系到组培苗能否健壮生长及后期移栽的成活率。本试验用不同浓度的IBA和NAA对黑果腺肋花楸组培苗的生根率、根数、根长及生长状况等指标进行测定观察,IBA的浓度在0.3~0.5 mg/L、NAA的浓度在0.5~0.7 mg/L时生根率、根数、根长结果表现最优,组培苗长势最佳,这与李冬杰等的研究结果[11]一致。将生长健壮的组培苗练苗后移栽到草炭土和珍珠岩配比为1 ∶1的基质中,成活率高达94.78%,与高方可等的研究结果[12,18]一致。
本试验以黑果腺肋花楸的腋芽、茎段和叶片为外植体进行诱导,然后对获得的初代愈伤组织进行增殖培养、组培苗进行生根诱导及驯化移栽,成功建立黑果腺肋花楸组织培养快繁再生体系,为其种苗大面积组培快繁、栽培及工厂化育苗提供了一定的理论基础与科学依据,同时为黑果腺肋花楸的可持续发展利用奠定了基础。

