水合碱中钙、镁含量的快速分析法
,
(连云港碱业有限公司,江苏连云港 222042)
水合碱在重质纯碱生产工艺中,作为进入煅烧炉的进料,其中Ca、Mg含量的偏高会影响产品质量,尤其是Mg含量的偏高会造成出大碱球,影响正常生产。因此,有效控制水合碱中钙镁含量将对重质纯碱的生产非常重要,而纯碱分析中又没有相应的检验方法,为此针对我厂具体情况,对水合碱中钙、镁含量的分析方法进行了探讨。
采用EDTA滴定法,由于有Fe3+的干扰,要首先加入三乙醇胺掩蔽再滴定Ca、Mg,但实验发现该滴定终点不明显,结果不准确,重现性也不好。为此,先把溶液中的Fe3+沉淀,过滤分离后再用EDTA滴定,就可得到较为满意的结果。
1 测定原理
对Ca2+、Mg2+离子的测定采用络合滴定法。
在pH=12时, Mg2+以Mg(OH)2沉淀形式掩蔽,加入钙指示剂,Ca2+离子与EDTA形成更稳定的络合物,终点时完全释放出钙指示剂,呈现纯蓝色为终点,测得Ca2+的含量。由于钙试剂在水溶液中易氧化失效,故一般用固体试剂,可用固体干燥的分析纯NaCl与钙羧酸指示剂 100∶1 配成混合物使
用,通常每次加入量为0.1 g。
钙试剂的颜色变化与pH的关系:
H2In HIn In
pH<7.4 pH=8~13 pH>13.5
酒红色 蓝色 酒红色
其水溶液在pH<8、pH>13时为酒红色,pH为8~13时为纯蓝色,而在pH为12~13间与Ca2+离子形成酒红色络合物,指示剂自身呈纯蓝色,颜色变化敏锐,终点容易观察。
在pH=10时,以铬黑T为指示剂,与Ca2+、Mg2+离子形成红色络合物,随着EDTA试剂的加入,Ca2+、Mg2+离子与EDTA形成更稳定的络合物,终点时完全释放出指示剂,溶液呈现纯蓝色,测得Ca2+、Mg2+离子的总量。进而求出Mg2+的含量。铬黑T是一个三元弱酸,以H2In-表示,在不同的pH值时,其颜色变化为:
H2In-HIn2-In3-
pH<6.3 pH=8~11 pH>11.5
酒红色 蓝色 橙黄色
铬黑T的水溶液不稳定,易发生聚合变质,通常称0.2 g铬黑T溶于15 mL三乙醇胺溶液中,加入5 mL无水乙醇配成液体指示剂使用。
2 试剂
1)盐酸:1+1
2)硝酸:1+1
3)氨水:1+1
4)三乙醇胺:1+1
5)氨-氯化铵缓冲溶液:pH=10
6)氢氧化钠:200 g/L
7)c(EDTA):0.025 mol/L
8)铬黑T指示剂
9)钙指示剂
10)Ca2+、Mg2+混合溶液:内含Ca2+1.00 mg/mL、Mg2+1.00 mg/mL
3 操作步骤
3.1 样品准备
在煅烧水合机采样口采集水合碱,经充分混匀后,装入带磨口塞的玻璃瓶中。
3.2 分析步骤
称取20.00 g试样(称准至0.01 g),加入50 mL H2O,再加70 mL盐酸溶液(1+1),同时加入1 mL硝酸溶液(1+1),加热煮沸2~3 min,加2滴甲基红指示剂,用氨水(1+1)中和至黄色,再过量l mL,加热至微沸,趁热用快速定量滤纸过滤,滤液收集于250 mL容量瓶中,将沉淀用蒸馏水洗涤2~3次,滤液一起转入容量瓶中,稀至刻度,摇匀。
吸取上述滤液50.00 mL,调为酸性,加5 mL三乙醇胺,后加入15 mL氨-氯化铵缓冲溶液,加4滴铬黑T指示剂,用EDTA标准溶液滴至纯蓝色为终点,消耗体积V1。另取上述滤液50.00 mL,调为酸性,加5 mL三乙醇胺,后加入15 mL氢氧化钠溶液及少许钙指示剂,用EDTA标准溶液滴至纯蓝色为终点,消耗体积V2。
3.3 操作注意事项
3.3.1 滴定终点的控制
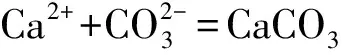
2)由于络合反应速度比较缓慢,用EDTA标液进行滴定时速度不能太快,要均匀逐滴进行滴定,尤其在接近终点时更应缓慢滴定,并且充分摇动。滴定最好在30~40 ℃进行,室温太低,则反应速度太慢,应将溶液略加热。温度太高,用以稳定pH的氨缓溶液易挥发,使pH达不到10,影响镁含量测定准确度。
3.3.2 消除干扰
铁等金属离子对指示剂有封闭作用,必须加入三乙醇胺掩蔽,三乙醇胺不能掩蔽大量的铁,当水合碱铁含量较高在处理样品溶液时先加入盐酸使溶液呈酸性,然后再加入HNO3溶液使溶液中的Fe2+离子转变为Fe3+离子,再用氨水调至弱碱性,最终Fe3+以Fe(OH)3沉淀形式析出,然后再进行过滤分离。
4 结果计算
以质量百分数(%)表示的钙含量的X1按下式计算:
X1=c×V2×M1/1 00020×50/250×100=c·V2
以质量百分数(%)表示的镁含量X2按下式计算:
X2=c×(V1-V2)×M2×1 00020×50/250×100=0.0608c·(V1-V2)
式中:c——EDTA标准滴定溶液的浓度的准确数值,单位为mol/L;
V1——滴定Ca2+、Mg2+总量所消耗的EDTA标准滴定溶液的体积的数值,单位为mL;
V2——滴定Ca2+所消耗的EDTA标准滴定溶液的体积的数值,单位为mL;
M1——钙离子的摩尔质量的数值,单位为g/mol(M1=40.08);
M2——镁离子的摩尔质量的数值,单位为g/mol(M2=24.31)。
5 结果与讨论
5.1 三乙醇胺的加入顺序
先期溶液中大量铁离子用沉淀分离过滤,滤液中仍有少量铁离子,因此需加入三乙醇胺用于掩蔽Fe3+以消除干扰,而在使用三乙醇胺时,应在酸性溶液中加入,然后再调节至碱性,如果原溶液是碱性,应先酸化后再加入,否则已水解的金属离子不易被它掩蔽,从而使分析结果出现偏差。
取水合碱样品一个,在未进行酸化的滤液中加入三乙醇胺,测定结果见表1。

表1 未进行酸化的滤液中加入三乙醇胺测定结果
取上述水合碱样品,在酸化的滤液中加入三乙醇胺,测定结果见表2。
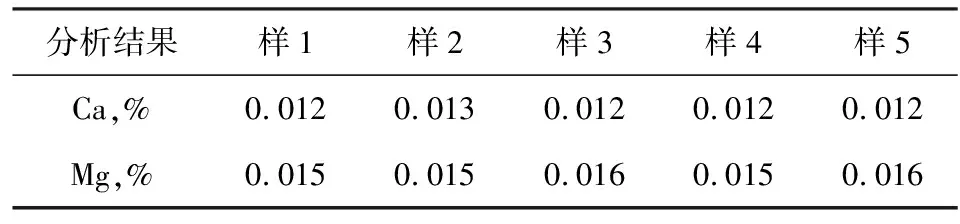
表2 酸化的滤液中加入三乙醇胺测定结果
5.2 精密度的试验
取上述水合碱样品,按上述操作步骤平行测定5次,测定结果见表3。
5.3 准确度试验
取上述水合碱样品,在吸取的滤液中分别加入1.00 mL、2.00 mL、3.00 mL、4.00 mL Ca2+、Mg2+混合溶液,按操作步骤测定结果如表4。

表3 精密度测定结果
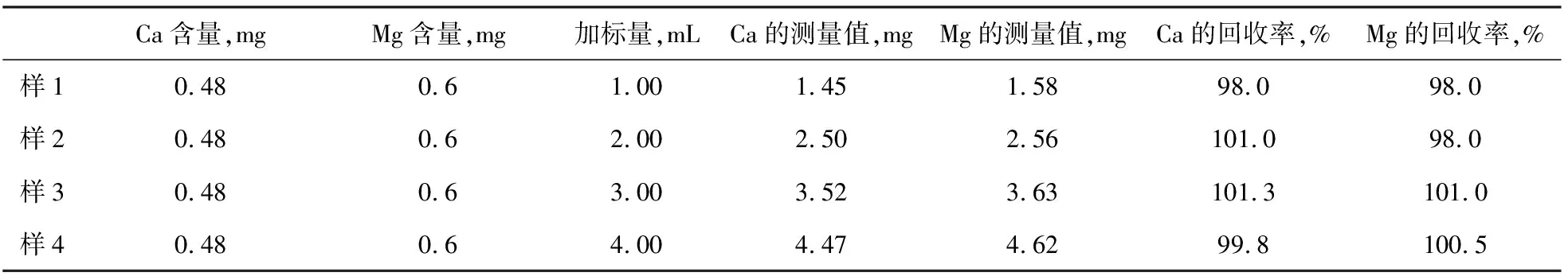
表4 准确度试验结果
从以上两表可以看出,此方法的准确度和精密度均较高,数据准确、可靠,解决了生产中的难题,能够满足重质纯碱生产中对水合碱中钙、镁含量的控制要求,起到指导生产的作用。

