水热法合成微纳米氧化铜的结构及形貌研究*
康 浩
(荔浦师范学校 广西 桂林 546600)
前言
笔者旨在制备氧化铜纳米材料,这是因为它有着广泛的用途。首先,氧化铜纳米材料应用于催化剂。纳米氧化铜对CO、乙醇等的完全氧化都具有较高的催化活性,对高氯酸铵的分解也具有很好的催化作用[1~3]。在所使用氧化铜纳米材料作为高氯酸铵催化剂时,可以降低催化分解温度、加快分解速率,但对转化率没有太大的影响[4~6]。其次,氧化铜纳米微粒对光、温度、湿度等具有很高的灵敏性,将氧化铜纳米材料制成薄膜包覆在传感器的表面,从而可以提高传感器的灵敏性和选择性[7~8]。再次,氧化铜纳米材料应用于太阳能电池材料。这是由它的光导性和光化学性所决定的。纳米氧化铜做电极材料时可以显著改善普通电极材料使用时所带来的不足,包括电池材料的光电转换率、对环境的危害性以及材料性能的稳定性[9]。此外,氧化铜纳米材料还可以用作场发射器件。氧化铜是一种宽禁带半导体材料,它具有很好的稳定性、很高的熔点和热导率、较小的介电常数、很高的击穿电压和载流子迁移率。与碳纳米管、某些纳米线作为场发射材料相比,它可以克服材料本身带来的问题。最后,由于氧化铜本身具有的特殊结构以及材料颗粒纳米化后性能的提高,氧化铜纳米材料还可以用作高温超导材料、磁场设备、光敏材料等。
总之,氧化铜纳米材料是一种非常实用、非常重要且用途广泛的材料。
1 实验部分
1.1 实验试剂
实验所用试剂如表1所示。

表1 实验试剂
1.2 实验仪器
实验所用仪器如表2所示。
表2 实验仪器
1.3 实验步骤
1.3.1 棱柱状CuO纳米材料的制备
取1个150 mL烧杯,向烧杯中加入60 mL去离子水。称取1 g CuSO4·5H2O放入烧杯中,采用磁力搅拌使其溶解,得蓝色澄清液。后向烧杯中加入6 g PVP,磁力搅拌约10 min,PVP便可溶解,得到蓝绿色澄清液,此时的混合液非常粘稠。PVP溶解完毕后,向混合液中加入6 g尿素,搅拌使其溶解,最后向烧杯中加入2 mL H2O2,继续搅拌一小会。将烧杯中液体转入以聚四氟乙烯为内衬的150 mL高压反应釜中,后放入120 ℃烘箱中,水热反应4 h。反应结束后,将反应釜从烘箱中取出,使其自然冷却。当反应釜温度降至室温时,打开反应釜,将反应釜内反应所得液体倒入烧杯中,得到墨绿色溶液,静置一定时间后倒掉一部分上清液。采用高速离心机离心得到绿色固体。然后,对反应所得产物进行洗涤,水洗3次,乙醇洗3次,再将洗涤的产物放入烘箱中60 ℃干燥3 h。
将上述实验制得的前驱体进行煅烧,600 ℃煅烧2 h,最后得到黑色的固体颗粒。
1.3.2 棒状CuO纳米材料的制备
取2个烧杯,编号1、2,分别向2个烧杯中加入20 mL水,称取1 g乙酸铜,加入1号烧杯中;称取1 g SDBS,加入2号烧杯中。将1、2号烧杯放到磁力搅拌器上磁力搅拌,直至烧杯中溶质完全溶解,约30 min后,将,2个烧杯中溶液混合,得到蓝乳白色透明液体,稍加搅拌后,将混合液体转入以聚四氟乙烯为内衬的100 mL高压反应釜中,放入180 ℃烘箱中,恒温8 h,反应结束后,将反应釜从烘箱中取出使其自然冷却。当反应釜温度冷却至室温后,打开反应釜,倒出反应所得液体,采用高速离心机离心得到黑色固体颗粒。随后,用水洗涤固体颗粒3次,乙醇洗涤3次。最后,用乙醇将固体颗粒洗出后放入60 ℃烘箱中干燥3 h。
1.3.3 花状CuO纳米材料的制备
取2个烧杯,编号1、2,分别向2个烧杯中加入20 mL乙醇。称取1 g硝酸铜,加入1号烧杯中;称取2 g PVP,加入2号烧杯中。将1、2号烧杯放到磁力搅拌器上磁力搅拌,直至烧杯中溶质完全溶解,约15 min后,将,2个烧杯中溶液混合,得到蓝绿色透明液体,稍加搅拌后,将混合液体转入以聚四氟乙烯为内衬的100 mL高压反应釜,放入180 ℃烘箱中,恒温12 h。反应结束后,将反应釜从烘箱中取出使其自然冷却。当反应釜温度冷却至室温后,打开反应釜,倒出反应所得液体,采用高速离心机离心得到黑色固体颗粒。随后,用水洗涤固体颗粒3次,乙醇洗涤3次。最后,用乙醇将固体颗粒洗出后放入60 ℃烘箱中干燥3 h。
1.3.4 球形CuO纳米材料的制备
取2个烧杯,编号1、2,分别向2个烧杯中加入20 mL水。称取1 g硝酸铜,加入1号烧杯中;称取1 g SDBS,加入2号烧杯中。将1、2号烧杯放到磁力搅拌器上磁力搅拌,直至烧杯中溶质完全溶解,约30 min后,将,2个烧杯中溶液混合,得到蓝绿色透明液体,稍加搅拌后,将混合液体转入以聚四氟乙烯为内衬的100 mL高压反应釜,放入180 ℃烘箱中,恒温16 h。反应结束后,将反应釜从烘箱中取出使其自然冷却。当反应釜温度冷却至室温后,打开反应釜,倒出反应所得液体,采用高速离心机离心得到黑色固体颗粒。随后,用水洗涤固体颗粒3次,乙醇洗涤3次。最后,用乙醇将固体颗粒洗出后放入60 ℃烘箱中干燥3 h。
1.4 测试与表征
实验制备的药品分别采用X射线衍射仪、扫描电子显微镜、透射电子显微镜来表征。通过对样品进行X射线衍射分析,分析它的衍射图谱可以确定物质的成分以及内部分子、原子的结构或形态;通过扫描电子显微镜可以观察样品的形貌、纳米粒子分布状况及粒径大小;通过透射电子显微镜可以进一步观察纳米微粒的结构。
2 实验结果与讨论
2.1 棱柱状纳米氧化铜
2.1.1 XRD
图1是以CuSO4·5H2O、尿素等为原料制得的CuO纳米颗粒以及前驱体Cu2(OH)2CO3的XRD衍射图。其中,图1(a)为煅烧前的Cu2(OH)2CO3,图1(b)为煅烧2 h后的CuO。图1(a)显示样品在衍射角为24°、27.5°、31°、35.5°、42.5°处有明显的特征衍射峰,分别对应于(220)、(001)、(201)、(240)、(250)晶面,除此之外没有其他的特征衍射峰,与标准卡(卡号 41-1390)一致,这表明所合成的前驱体是纯的Cu2(OH)2CO3,没有引入其他杂质。衍射峰比较尖锐,说明合成的Cu2(OH)2CO3结晶性较好。

图1 棱柱状纳米氧化铜XRD衍射图
此外,从图1(b)可以看出,该样品在 2θ为32.7°、35.7°、38.8°、48.8°、53.6°、58.4°、61.6°、65.8°、66.3°及68.2°处有较为明显的特征衍射峰,分别对应于CuO的(110)、(002)、(111)、(202)、(020)、(202)、(113)、(022)、(220)、(311)、(220) 晶面,除此之外没有其他的特征衍射峰。衍射峰位置与JCPDS 05-0661相符,这表明所制得的氧化铜纳米微粒纯度较高,没有引入其他的杂质,如Cu2O、Cu(OH)2、Cu2(OH)2CO3等。此外,样品衍射峰较为尖锐,这表明合成的氧化铜结晶性较好,晶体结构比较完整。
2.1.2 SEM
图2为反应制得氧化铜样品的SEM图。测试结果表明,实验制得的CuO铜微粒大都是棱柱状的,长度基本分布在5~15 μm之间,高度分布在3~5 μm之间。尽管如此,实验中合成的CuO分布不均匀、形貌不均一。图2中有一些小的结构聚集在一起,表明在实验中形貌的控制不太理想。之所以会产生这种现象,可能是由纳米颗粒所具有的小尺寸效应、表面效应造成的,这些效应使得小颗粒有倾向性的聚集在一起。

图2 棱柱状纳米氧化铜SEM图
此外,图2中还有很多碎片结构,且大小形状均不均匀,造成这种现象的具体原因单从图中无从得知,我们猜测这些碎片是在超声分散、研磨的过程中造成的;此外,这些碎片也有可能是实验中自行生成的,由于各方面的原因还没有形成棱柱状的结构。
2.1.3 TEM

图3 棱柱状纳米氧化铜TEM图
图3是棱柱状氧化铜结构的TEM图。从图3中可以看出,该结构的长度约为6 μm,宽度约为3 μm,这与图2的SEM图结果相符。图中棱线清晰,整体颜色基本均一,这表明合成的氧化铜结构是实心的而非空心。
2.1.4 实验条件对产物的影响
为了研究PVP的作用,我们改变了PVP的添加量。实验结果表明,在不加PVP的情况下合成的氧化铜没有特殊的结构,而PVP加倍后,形貌没有发生很大的变化。图4为PVP的添加量翻倍后的TEM图。将其与图5比较,结构没有发生很大变化。这表明PVP在实验的过程中起着控制晶体形貌、分散的作用,而添加量过大则没有实际意义。

图4 棱柱状纳米氧化铜TEM图(PVP的量加倍)

图5 不规则片状氧化铜SEM图(t=2 h)
为了研究实验中反应时间对实验结果的影响,在原始实验的基础上延长或缩短反应时间。将反应时间延长至8 h时,没有得到任何产物;将反应时间缩短至2 h,得到一些不规则片状结构,SEM图如图5所示。
为了研究实验中反应温度对实验结果的影响,将反应温度降低至80 ℃,水热反应4 h后,将反应液从反应釜中倒出,溶液仍澄清,颜色仅由蓝色变成了草绿色,没有任何产物生成。这表明棱柱状Cu2(OH)2CO3的生成需要一定的温度基础,温度太低则不会发生反应。
为了研究实验中H2O2的作用,在实验中改变了H2O2的添加量。将H2O2的添加量加倍后,没有得到任何产物。这可能是因为H2O2的添加量过大,使得尿素水解速率过快,生成铜铵络合离子,不利于反应进行。鉴于此猜测H2O2在实验中具有催化尿素分解的作用。
2.1.5 反应机理
本实验中CuSO4·5H2O在水中溶解,电离成Cu2+和SO42-,以此来提供铜源。尿素作为沉淀剂,在水热环境下不断提供CO32-和OH-,尿素提供的这些离子与Cu2+发生反应,生成Cu2(OH)2CO3。除此之外,PVP用来控制晶体的形貌,H2O2可以促进尿素水解。水热生成的Cu2(OH)2CO3放入坩埚煅烧炉中,600 ℃煅烧2 h,得到棱柱状氧化铜纳米颗粒。主要反应方程式如下:





晶体的形状主要取决于晶核的形成以及在不同方向上的生长速率。通过分析实验结果,推测该晶体生长过程是按以下机理进行的,机理示意图如图6所示。
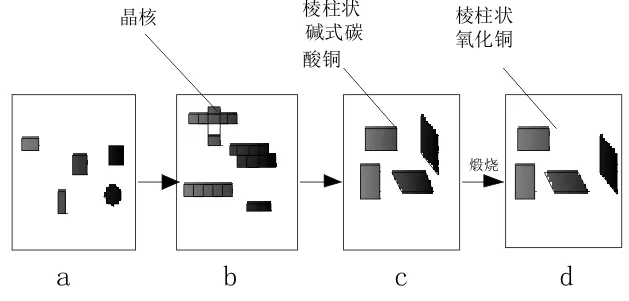
图6 棱柱状氧化铜生长机理示意图
在反应初期,CuSO4·5H2O、尿素反应得到Cu2(OH)2CO3,Cu2(OH)2CO3纳米晶聚集在一起提供了成核中心。随着反应的进行,因纳米粒子存在着表面效应和小尺寸效应等,成核中心周围的纳米晶不断被提供给成核中心使其继续生长。另一方面,PVP是一种表面活性剂,它与各个表面间作用力不同,使得各个晶面的生长速率不同。在这种内外作用力下,最终形成棱柱状Cu2(OH)2CO3,在600 ℃环境下煅烧2 h,其形貌未发生改变。
2.2 棒状纳米氧化铜
实验制得的样品采用X射线衍射表征,表征结果表明,所制得的样品是纯净的氧化铜。
2.2.1 SEM
图7是制得的棒状氧化铜纳米结构的SEM图。从图7中可以看出,所制得的氧化铜大多数是棒状的,长度为1~3 μm,直径为500 nm左右。从图7中还可以看出,纳米氧化铜的密度非常大,对应于水热法制得样品数量非常大的特点。尽管制得的样品中大多数是由棒状结构组成的,但纵观整个SEM图,棒的尺寸分布不均匀,且团聚现象比较严重。造成这种现象的原因可能是表面活性剂的添加量不足,分散效果不好。

图7 棒状纳米氧化铜SEM图
2.2.2 TEM
图8是制得氧化铜样品的透射电子显微镜图片,此图为一个断裂了的氧化铜纳米棒的TEM图片,a图为棒的头部,b图为棒的尾部。
从图8两张图中可以看出,纳米棒的头部直径约为800 nm,尾部直径约为400 nm,长度约为1.5 μm。此结果与图7中SEM图吻合性较好。其图中轮廓线明显,内外颜色均一,表明合成出的棒状纳米氧化铜是实心的而并非中空结构。

图8 棒状纳米氧化铜TEM图
2.2.3 实验条件对反应结果的影响
为了研究铜源对反应结果的影响,将铜源换成CuSO4·5H2O而保持其他条件不变,反应结束后得到白色固体,离心后向固体中加入少量乙醇,白色固体完全溶解且溶液澄清。这表明白色固体为SDBS,没有发生任何反应,同时说明铜源的选择在反应的过程中起着重要的作用。
为了研究反应时间对产物的影响,将时间缩短至2 h,无任何产物生成。
2.2.4 反应机理
Cu(Ac)2·H2O在水热环境下发生水解反应,产生蓝色Cu(OH)2。据资料显示,Cu(OH)2的分解温度为170 ℃,本实验所提供的温度为180 ℃,Cu(OH)2可以完成分解反应,反应8 h后,生成黑色的氧化铜纳米颗粒。
本实验涉及的反应有:



在实验过程中,CuO本身是一种单斜晶体,有利于异向生长。加入SDBS之后,SDBS作为一种表面活性剂,降低了某两个晶面之间的表面能,晶体沿表面能低的方向生长,最终生成棒状结构。
2.3 花状纳米氧化铜
2.3.1 表征结果
图9为反应制得氧化铜样品的SEM图。从图9中可以看出,反应生成了很多花状氧化铜结构。特别是在图片的中间,有几朵分散均匀的花状结构,形貌较为规整,非常漂亮。从这些花状结构可以看出,这些花状结构的直径为10 μm左右。此外,还可以看出这些花状结构是由厚度几乎均匀的纳米片组成的,每个纳米片的厚度约为800 nm。

图9 花状纳米氧化铜SEM图
纵观整个SEM图,图中除了含有花状氧化铜结构之外,还有其它杂乱的结构,这表明在反应的时候,反应条件不太合适,形貌没有控制好。除此之外,在图片中还含有尺寸较小(约有6 μm),近似球形但已经有花状结构轮廓的结构。这些结构应该是还没有生长好的花状结构,就像一个个小的“花蕾”。
2.3.2 实验条件对反应结果的影响

图10 花状纳米氧化铜SEM图(反应时间t=8 h)
为了研究反应时间对实验结果的影响,通过改变时间做了对比实验。图10为反应时间缩短至8 h所得样品的SEM图片。从图10中可以看出,尽管生成的氧化铜结构比较乱,但可以看见图中已经有近似花状的结构生成。
2.3.3 反应机理
在本实验中,硝酸铜直接发生水解反应。
Cu(NO3)2·3H2O在170 ℃下就可以发生分解作用,产生CuO。本实验提供的溶剂热温度为180 ℃,目的就是为了让Cu(NO3)2完全分解,实验中加入表面活性剂控制形貌。
本实验涉及的反应方程式为:

对于以上形貌的产生,对它的生长机理做以下推测:
首先,在反应的初始阶段,硝酸铜在溶剂热环境下发生分解产生氧化铜纳米晶体。这些纳米晶体聚集在一起,提供成核中心。其次,氧化铜本身是单斜晶型的,它具有的这种特性有利于异向生长,所以在图9、图10中会看见近似球状未生长好的氧化铜结构。再次,反应过程中添加了大量的PVP,PVP作为一种表面活性剂与氧化铜各个晶面间的作用力不同,从而导致各个晶面的生长速率不同。在内外因的综合作用下,最终生成花状氧化铜结构。
花状氧化铜结构的生长过程可以简单地用图11示意图描述。
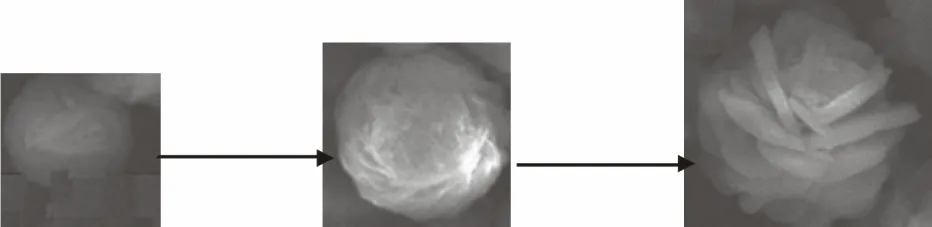
图11 花状纳米氧化铜生长过程
2.4 球形纳米氧化铜
2.4.1 表征结果
图12为反应制得的样品的SEM图。从图12中可以看出,合成的氧化铜基本上是毛茸茸状球形的,但粒径分布范围较大,在1~5 μm之间。此外,图片中的形貌不一,且有一些杂乱的片状或絮状物。就某一个成型的氧化铜球而言,可以看出它是由许许多多很薄的片状结构组成的,这些纳米片的长度约有几个微米,厚度仅有几十个纳米。

图12 球状纳米氧化铜SEM图
2.4.2 实验条件对反应结果的影响
为了研究反应时间对实验结果的影响,改变反应时间作了对比实验。首先缩短反应时间至8 h,反应结束后得到的固体粉末为蓝色,这表明此时生成的产物为Cu(OH)2而不是CuO。造成这种现象的原因可能是反应时间不够,水解产生的Cu(OH)2还没有分解。
鉴于此,又作了另外一个对比实验。认为延长反应时间有利于氧化铜纳米结构的生成,于是将反应时间延长至48 h。事实上,最终得到的样品并不佳,样品中产生了少量的红色颗粒。这些红色的颗粒应该是Cu2O,这表明产生的CuO发生了还原作用,使得产物已经不再纯净,而造成这种结果的原因就是反应时间过长。

图13 球状纳米氧化铜图(反应时间t=48 h)
图13即为反应时间延长至48 h获得产物的SEM图。
为了研究溶剂对实验结果的影响,将溶剂换成乙醇,反应制得样品SEM图如图14所示。

图14球状纳米氧化铜SEM图(以乙醇为溶剂,反应时间t=48 h)
从图14中可以看出,合成的氧化铜仍为球形,球的直径约为2 μm,但是氧化铜微纳米球团聚现象较为严重,且有很多破球。为了研究这种球形氧化铜结构的生长过程,将反应时间缩短至8 h,反应制得样品SEM图如图15所示。

图15球状纳米氧化铜SEM图(以乙醇为溶剂,反应时间t=8 h)
从图15中可以看出,球形结构还没有生长完全,图中有很多琐碎的结构,但已经有了球形结构的轮廓。
2.4.3 反应机理
Cu(NO3)2·3H2O在水热环境下发生水解反应,产生蓝色Cu(OH)2。180 ℃水热环境下反应16 h,得到黑色氧化铜纳米颗粒。
本实验涉及的反应有:



生长机理如图16所示。
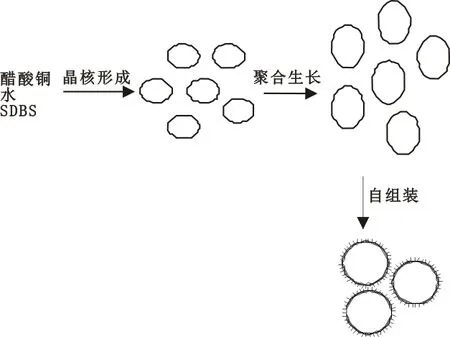
图16 氧化铜微球自组装过程
根据图12所示的SEM图,猜测实验制得的氧化铜微球是通过很薄的纳米片自组装而形成的。实验中铜源首先发生水解作用,继而分解生成氧化铜纳米晶,纳米晶聚集在一起形成成核中心,在表面活性剂SDBS的作用下长成片状结构,当纳米片生长到一定程度后,在SDBS的作用下发生自组装,生成氧化铜微球。将溶剂换成乙醇后,溶剂的极性减小,纳米片在溶剂中的分散程度减小,所以生成的球形结构更加光滑、纳米片之间的组装更加紧凑。
4 结论
笔者基于水热法,通过不同的途径制备出了微纳米氧化铜,采用XRD、SEM、TEM进行表征。研究结果表明:制备出的氧化铜纯度较高,不同途径制备出的产物具有各不相同的形貌。笔者还对各种形貌氧化铜微粒产生的机理进行了研究,并提出了可能的反应机理和晶体生长机理。
1)以CuSO4·5H2O、尿素为主要原料,以PVP、H2O2辅助反应,通过水热法合成了棱柱状的Cu2(OH)2CO3,煅烧制得棱柱状CuO。笔者研究了PVP、H2O2作用,并推测了棱柱状CuO结构形成的机理。实验表明,PVP控制晶体形貌的生长,H2O2可以促进尿素的水解。
2)以Cu(Ac)2·H2O、水为主要原料,以SDBS作为表面活性剂,通过水热法制备了棒状氧化铜纳米结构。实验研究了铜源对实验结果的影响,实验结果表明,CuSO4·5H2O作为铜源不能生成氧化铜,这可能是因为乙酸铜在水热环境下较硫酸铜更容易发生水解反应。
3)以Cu(NO3)2·3H2O为主要原料,以PVP作为表面活性剂,通过溶剂热法制备了花状氧化铜微纳米结构。实验中通过改变反应的时间,推测出了花状氧化铜微粒的生长机理。
4)以Cu(NO3)2·3H2O、水为主要原料,以SDBS作为表面活性剂,通过水热法制备了自组装的氧化铜球形结构。实验中改变反应时间研究了时间对结果的影响,同时还研究了溶剂的影响。测试结果表明,反应时间过长或过短都不能得到理想的结果,溶剂的极性影响产物的形貌。

