高产脂思茅松牻牛儿基牻牛儿基焦磷酸合成酶基因的克隆及表达
王 毅, 原晓龙, 陈 伟, 李 江
(云南省林业科学院云南省森林植物培育与开发利用重点实验室/国家林业局云南珍稀濒特森林植物保护和繁育重点实验室,云南 昆明 650201)
松脂是一类复杂的萜类混合物,包括易挥发的松节油类,主要是单萜和倍半萜类以及不易挥发的松香类,主要属于二萜类物质.目前,从松脂中分离鉴定的化合物已超过4万种[1].松脂被广泛应用于医药、化妆品、杀虫剂、化工及食品等行业中.思茅松(Pinuskesiyavar.langbianensis)是云南重要的松脂资源树种[2],其松香年产量超过25万t,松节油产量超过6万t.但云南的松脂原料林绝大部分属于天然次生林,松脂产量低下,平均单株松脂产量仅为2~3 kg·年-1.因此,培育高产脂思茅松种苗成为提高松脂产量的重要手段.目前,对高产脂思茅松的研究主要集中在优树选育[3]、半同胞家系选育[4].虽然科研工作者已对高产脂思茅松优树产脂量的相关因子进行过分析,并探讨了树脂道与高产脂之间的相关关系[5-6],但对于思茅松高产脂分子机理的研究却未见报道.
植物萜类物质的合成是由甲羟戊酸途径(MVA)和2C-甲基4-磷酸-4D-赤藓糖醇途径(MEP)两个途径完成,其中,单萜和二萜主要由MEP途径合成,倍半萜类主要由MVA途径合成[7].无论是MVA途径还是MEP途径,都会合成异戊烯焦磷酸及其异构物二甲丙烯焦磷酸,然后由于其在植物细胞中的不同位置,最终形成不同的代谢终产物[8].牻牛儿基牻牛儿基焦磷酸合成酶(geranylgeranyl diphosphate synthase, GGPS)主要利用来源于MEP途径合成的异戊烯焦磷酸及其异构物二甲丙烯焦磷酸、牻牛儿基焦磷酸等底物聚合形成合成二萜、四萜及多萜化合物的前体——牻牛儿基牻牛儿基焦磷酸(GGPP)[9].Ignea et al[10]研究表明,在酵母中,超表达GGPS基因能够有效提高菌株二萜的产量;国内研究人员也发现,GGPS与马尾松的产脂力密切相关[11].因此,GGPS是植物二萜类化合物生物合成的关键酶之一.而松脂中不挥发的主要成分——松香类物质主要属于二萜类物质.目前,虽然已从多种植物中克隆获得GGPS基因,如曼地亚红豆杉[12]、雷公藤[13]、巴夫杜氏藻[14]、马尾松[15]、茶树[16]等,但尚未见思茅松GGPS基因的相关报道.本试验利用转录组测序技术获得思茅松GGPS基因序列,并采用RT-PCR技术克隆获得该基因,同时对GGPS基因在不同思茅松个体及组织中的表达情况进行分析.这些研究将有助于揭示思茅松高产脂的分子机理.
1 材料与方法
1.1 材料
供试高产脂思茅松种植在云南景洪普文镇普文试验林场.选择年产脂量高于30 kg的高产脂思茅松优树用于转录组测序,同时选择产脂量低于0.5 kg的植株作为低产脂个体,与高产脂思茅松个体用于基因表达量的分析.采集高、低产脂思茅松的不同组织样品并放入液氮中保存.
1.2 转录组分析
将高、低产脂思茅松的树皮组织送到深圳华大基因科技有限公司进行转录组测序,对序列进行组织拼接后,通过以马尾松GGPS蛋白序列对转录组Unigene进行本地Blast,寻找高产脂思茅松树皮转录组中的GGPS基因;同时,将转录组数据中的Unigene分别注释到NR、NT、Swiss-Prot、KEGG、COG、GO数据库中,并对注释结果中的GGPS基因进行分析.
1.3 RNA的提取
分别提取高、低产脂思茅松个体的松针以及小枝的RNA,并且以割脂后0、6、12 h为时间梯度采集割脂处的树皮等组织,提取RNA.具体提取方法如下:在液氮环境中,将样品用组织研磨仪打成粉末后,采用CTAB裂解,使用LiCl沉淀法、膜上消化的方式去除样品中的DNA[17],分别提取每个样品的RNA后,用1%琼脂胶检测RNA的完整性,并用分光光度计测量各样品RNA在260、280、320、230 nm波长处的光密度(D),确定其纯度.分别取1 μg RNA用于反转录得到cDNA.将样品cDNA保存在冰箱(-20 ℃)中备用.
1.4 GGPS基因的克隆
通过对高产脂思茅松树皮转录组数据进行分析,获得表达量高的GGPS基因序列.以获得的GGPS基因序列,设计含有起始密码子的特异引物(PkGGPSF:5′-ATGGCTTACAGTGCCATGGC-3′)和含有终止密码子的特异引物(PkGGPSR: 5′-TCAGTTTTGTCTTTGTG-3′).以高产脂思茅松树皮的cDNA为模板,用LA-Taq高保真聚合酶进行PCR扩增,电泳检测后将目的片段连接到pClone007载体上,并转入到DH5α感受态细胞中,通过菌落PCR筛选出阳性克隆,送上海生工测序公司测序,最终通过序列比对确定获得GGPS基因全长片段,并永久保存在冰箱(-80 ℃)中.
1.5 GGPS基因克隆及蛋白生物信息学分析
采用美国国家生物技术信息中心(NCBI)的在线软件ORFFinder对思茅松GGPS基因进行蛋白翻译后,用在线软件ProtParam对GGPS蛋白的理化性质进行分析,GGPS保守结构域分析由在线蛋白功能结构域分析软件完成,其氨基酸同源序列比对则用DNAMAN 软件完成,最终确定GGPS的保守结构域.将思茅松GGPS蛋白与NCBI已知其他植物的GGPS蛋白进行多重比对后,用MEGA7软件中的邻位相连法程序进行进化树分析.
1.6 GGPS基因不同组织的表达分析
分别取2 μg高、低产脂思茅松个体的不同组织RNA,按照RevertAidTMFirst Strand cDNA Synthesis Kit试剂盒说明书合成cDNA第一条链.以不同组织的cDNA为模板,用特异引物TPkGGPSF(5′-CACTTGCTCAGACATCTT-3′)和TPkGGPSR(5′-CTATCCTCAACCGTTCAG-3′)进行荧光定量PCR分析,并以阿尔法延长因子基因作为内参基因.具体反应体系如下:分别向PCR管中加入12.5 μL 2×SYBR Green master mix(含ROX)、引物TPkGGPSF和TPkGGPSR各0.5 μL、1 μL cDNA,最后用超纯水补足至25 μL.PCR反应条件为:95 ℃预变性10 min,95 ℃变性15 s;60 ℃退火、延伸30 s,共40个循环.反应结束后,收集信息做循环数阈值(cycle threshold, Ct)分析.
2 结果与分析
2.1 转录组分析
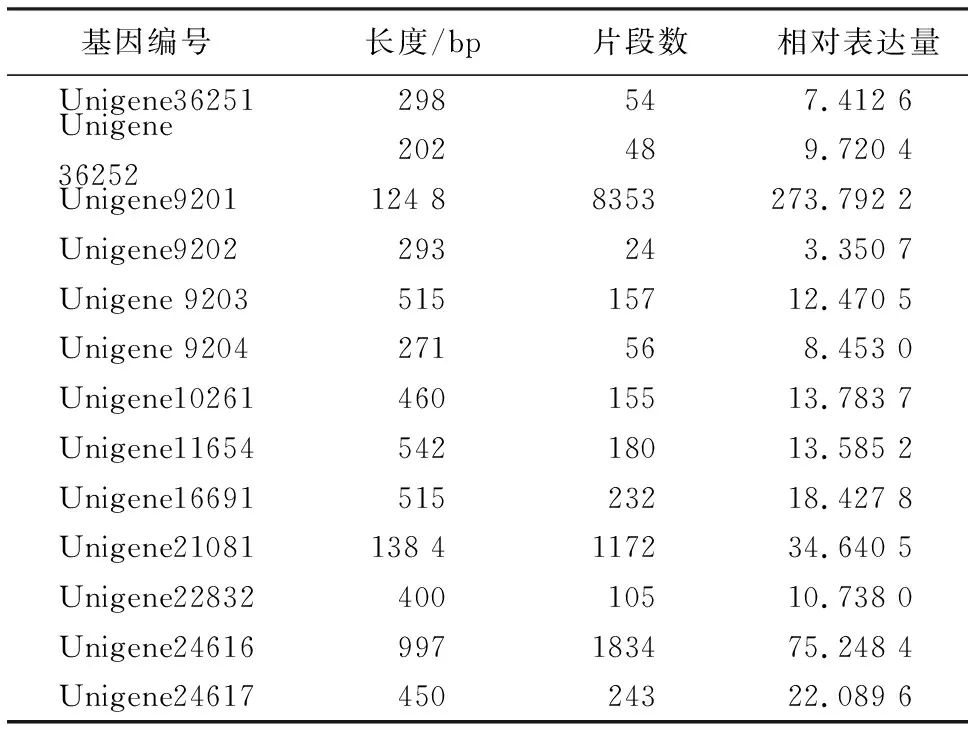
表1 转录组分析得到的GGPS信息Table 1 Information of GGPS by transcriptome analysis
采用Illumina Hiseq 2000平台对高、低产脂思茅松割脂后伤口附近的树皮进行转录组测序,总计产出5 828 966 460 nt数据,组装结果得到59 636个Unigene.对所获得的Unigene进行本地Blast,并在NR、NT、Swiss-Prot、KEGG、COG、GO等数据库中进行比对分析,最终获得13个可能的GGPS基因片段(表1).根据已知其他植物GGPS基因的大小在1 000 bp以上,从转录组数据中最终得到大于1 000 bp的GGPS基因片段有2个.通过蛋白序列分析以及表达量分析最后确定Unigene9201(表1)作为后续克隆分析的对象.
2.2 RNA提取与基因克隆
高、低产脂思茅松个体的不同组织样品经过液氮磨碎后,采用优化后的CTAB法提取各样品的RNA,电泳检测显示所提取的RNA完整性较好(图1).各样品的D260 nm/D280 nm均为1.8~2.1,说明RNA纯度较高,适合于后续反转录试验.
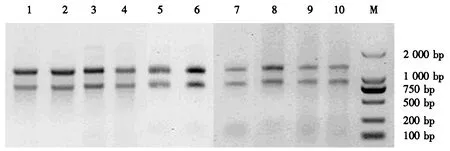
1~5:高产脂思茅松(1:树皮;2:割脂6 h后的树皮;3:割脂12 h后的树皮;4:小枝;5:松针);6~10:低产脂思茅松(6:树皮;7:割脂6 h后的树皮;8:割脂12 h后的树皮;9:小枝;10:松针);M:Trans2K DNA ladder.图1 RNA电泳检测图Fig.1 Electrophoretogram of RNA
基于转录组数据中获得的GGPS基因片段序列的特异引物(PkGGPSF、PkGGPSR),以PkGGPSF、PkGGPSR为引物,高产脂思茅松树皮cDNA为模板,进行高保真PCR扩增,将扩增出来的目的片段连接到克隆载体中,并进行测序比对验证,最终获得1 152 bpGGPS基因编码区全长cDNA.
2.3 GGPS蛋白序列分析
将获得的思茅松GGPS基因序列采用在线ORF以及ProtParam软件进行蛋白序列分析,结果显示,思茅松GGPS基因共编码383个氨基酸,其分子质量为41.66 ku,等电点为7.58.利用NCBI上的在线结构域分析软件(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)以及DNAman软件对与思茅松GGPS亲缘关系近的其他植物GGPS蛋白进行序列比对(图2),确定思茅松GGPS拥有GGPS所特有的两个功能区域FARM(DDLPSMDND)、SARM (DDILD)[18].思茅松GGPS与马尾松GGPS的蛋白序列同源性为78.07%,与挪威云杉GGPS的同源性为70.62%,与巨冷杉GGPS的同源性为68.56%.

Pk:思茅松GGPS;Pm:马尾松GGPS(登录号:AGU43761.1);Pa:挪威云杉GGPS(登录号:ACA21458.2);Ag:巨冷杉GGPS(登录号:AAN01134.1).黄色部分为FARM功能区,绿色部分为SARM功能区.图2 GGPS蛋白序列比对Fig.2 Alignment of GGPS protein sequence
2.4 系统进化树分析
将推导出来的思茅松GGPS蛋白序列在NCBI上进行比对,获得其他植物GGPS蛋白序列.采用MEGA7软件中自带的ClusterW程序进行蛋白序列多重比对后,用邻位相连法(各分支置信度由自检举分析1 000次)绘制出思茅松GGPS与其他植物GGPS蛋白的进化树(图3).从图3可以看出,GGPS在裸子植物和被子植物中明显分为两支.在裸子植物中,思茅松的GGPS与冷杉、云杉以及松科植物聚为亚枝,其中,思茅松GGPS与马尾松GGPS的亲缘关系最近.
2.5 GGPS基因在不同组织中的表达
为了解GGPS基因在思茅松不同组织以及不同个体之间的表达差异,以特异引物TPkGGPSF、TPkGGPSR,采用荧光定量PCR检测GGPS基因在不同样品中的表达情况.结果(图4)显示:GGPS基因在高产脂思茅松个体(产脂量>30 kg·年-1)的不同组织中,小枝中的表达量最高,松针中的表达量次之,割脂后树皮中的表达量呈先增加后降低的趋势;GGPS基因在低产脂思茅松个体(产脂量<0.5 kg·年-1)的不同组织中,松针中的表达量比小枝中的表达量高,割脂后树皮中的表达量随着时间变化而逐渐升高,割脂12 h后达到最高值.

图3 思茅松GGPS与其他植物GGPS的系统进化树Fig.3 Phylogenetic tree analysis of GGPS from P.kesiya and other species

HB0:高产脂思茅松树皮;HB6:高产脂思茅松割脂6 h后的树皮;HB12:高产脂思茅松割脂12 h后的树皮;HS:高产脂思茅松小枝;HN:高产脂思茅松松针;LB0:低产脂思茅松树皮;LB6:低产脂思茅松割脂6 h后的树皮;LB12:低产脂思茅松割脂12 h后的树皮;LS:低产脂思茅松小枝;LN:低产脂思茅松松针.图4 思茅松GGPS基因的表达量Fig.4 Gene expression profile of GGPS from P.kesiya
3 讨论
松香是松脂中不易挥发的部分,主要属于二萜类物质,约占松脂总量的四分之三[19-20].思茅松是云南重要的松脂资源树种,目前已有研究人员开展高松香思茅松无性系的选育[21],但传统的选育方法对于生长周期漫长的思茅松面临着选育周期长的问题.随着分子辅助育种的发展,目前已研发出多种松科植物的分子标记,但尚未见与性状有效关联的分子标记的报道.从报道的其他植物与数量性状遗传相关的分子标记可以发现,许多研发出来的分子标记往往位于与相关性状代谢途径相关的基因座区域内[22-24].这或许为研发高产脂思茅松分子标记提供了新思路:从性状相关代谢途径的基因入手,通过单核苷酸多态性寻找与性状相关的分子标记或许是一种比传统分子标记更有效的方法.
GGPS是植物中二萜、四萜以及多萜类化合物合成的关键酶,松脂中的主要成分——松香类化合物就属于二萜类化合物.本试验通过对高产脂思茅松割脂后树皮的转录组进行测序,获得GGPS基因序列,然后利用RT-PCR技术克隆获得GGPS基因.思茅松GGPS基因开放阅读框全长1 152 bp,编码383个氨基酸.系统进化树分析显示,思茅松GGPS与马尾松GGPS聚为一支,但思茅松GGPS与马尾松GGPS的同源性只有78.07%,远远低于思茅松松脂代谢途径中其他酶与松科植物相关酶的同源性,如思茅松HDR、DXS蛋白与赤松(Pinusdensiflora) HDR、DXS蛋白的同源性高达99%[17,25],这说明GGPS相比松脂代谢途径中的其他酶具有更大的变异性.系统进化树分析还显示:松属植物GGPS与冷杉属、云杉属植物GGPS的亲缘关系近,而与红豆杉属、三尖杉属植物的亲缘关系远.从系统进化树也可以看出,被子植物与裸子植物在GGPS系统进化树上明显分为两枝.
荧光定量PCR分析显示,思茅松GGPS基因在树皮中的表达量明显受到割脂物理伤害的刺激,表明思茅松GGPS基因与松脂合成相关,但不同个体受物理伤害刺激的程度和时间不一样.低产生思茅松受到割脂刺激后,GGPS基因高表达的时间点(刺激后12 h)明显比高产脂思茅松个体的高表达量时间点(刺激后6 h)晚.高、低产脂思茅松个体GGPS基因表达量差异最大的是在幼枝中,GGPS基因在高产脂思茅松幼枝中的表达量比在低产脂的高约40倍.在不同组织的比较中,思茅松GGPS基因的表达量也是在高产脂幼枝中最高.这说明思茅松割脂获得的松脂可能主要来源于原生树脂道,而原生树脂道的松脂主要是在幼枝中合成,然后进行从上而下的运输,从而有效地防御虫害以及物理伤害.基因表达分析结果可以明确,GGPS基因的表达量与思茅松产脂量呈正相关.若最终能够找到DNA水平上的差异与GGPS基因表达量的差异呈正相关,那么就有可能开发出与高产脂思茅松产脂紧密连锁的分子标记.

