黑木耳复合多糖口服制剂对小鼠免疫功能的效应
张介驰 陈 鹤 孔祥辉, 陈静宇
(1. 黑龙江省科学院微生物研究所,黑龙江 哈尔滨 150010;2. 黑龙江省科学院高技术研究院,黑龙江 哈尔滨 150001)
黑木耳(Auricularia auricular-judae)是一种既可食用又可入药的胶质大型真菌,中医认为,黑木耳性平、味甘,入胃、大肠经;具有滋补、润燥、养血益胃、活血止血、润肺、润肠等作用。近年来,有关黑木耳的研究大都集中在多糖类。作为生物反应调节剂,黑木耳多糖增强免疫力及抑制肿瘤等功能已被大量研究证实[1-2]。本文以黑木耳多糖为主,辅以猴头菇、姬松茸、香菇、灰树花等多糖制成的复合多糖口服制剂[3],研究其对小鼠细胞免疫及体液免疫功能的效应,进一步探明食药用真菌多糖的药用价值及其保健作用,为食药用真菌多糖作为保健食品的开发应用提供理论依据。
1 材料与方法
1.1 材料
黑木耳多糖复合口服制剂由本实验室自制;RPMI1640,Gibco公司;ConA,Sigma公司;MTT,Amresco公司;异丙醇,山东旭晨化工有限公司。
1.2 供试动物
选用上海西普尔-必凯实验动物有限公司繁殖的 SPF级 CI/F1代健康磁性小鼠 200只,体重为19.0~21.9 g,实验动物生产许可证号为SCXK(沪)2013-0016,合格证号:2008001672571。
1.3 主要仪器
T1000型电子天平,深圳市深合科技有限公司;SG-603生物安全柜,北京仪诺科兴科技发展有限公司;多功能酶标仪,美国伯腾仪器有限公司;二氧化碳培养箱,山东博科生物产业有限公司。
1.4 试验方法
(1)黑木耳复合多糖口服制剂制备方法。将黑木耳、猴头菇、姬松茸、香菇、灰树花清洗除杂,粉碎,按照配方量混合后,加入一定量的纯化水加热至沸腾,热水浸提2次,每次2 h,合并滤液,用旋转蒸发仪浓缩滤液,浓缩到一定程度加入调味剂进行调配,灌装,灭菌,即得黑木耳多糖复合口服制剂。
(2)ConA诱导小鼠脾淋巴细胞转化试验(MTT法)[4]。小鼠40只,随机分成4组,即空白对照组及黑木耳复合多糖口服制剂高、中、低 3个剂量组。3个口服剂量分别为0.25 mL/(kg·bw·d)、0.50 mL/(kg·bw·d)、1.50 mL/(kg·bw·d)。经口每日一次给予小鼠相应剂量的受试物,空白对照组以无菌水代替,小鼠灌胃量为0.1 mL/10 g·bw,连续灌胃一月后,颈椎脱臼法处死小鼠,无菌取脾,置于盛有适量无菌Hank’s液的小平皿中,研磨脾脏,制成单个细胞悬液,经 200目筛网过滤,用 Hank’s液洗2次,每次离心10 min(1 000 r/min),然后将细胞悬浮于1 mLRPMI1640完全培养液中,台酚兰染色计数活细胞(均在 95%以上),用 RPMI1640完全培养液调整细胞浓度为 3×106个/mL。将细胞分两孔加入24孔培养板中,每孔1 mL,一孔加75 μLConA 液(100 μg/mL),另一孔作为对照,置37 ℃、5%CO2培养箱中培养72 h,培养结束前4 h,每孔轻轻吸去上清液0.7 mL,加入0.7 mL不含小牛血清的 RPMI1640培养液,同时加入 MTT(5 mg/mL)50 μL/孔,继续培养4 h,培养结束后,每孔加入1 mL酸性异丙醇,吹打混匀,使紫色结晶完全溶解。将溶解液移入96孔培养板中,每孔做3个平行孔,用酶标仪在波长570 nm下测定各孔吸光度值。
淋巴细胞增殖能力=加ConA的光密度值-不加ConA的光密度值
(3)DNFB诱导小鼠迟发型变态反应(DTH)(耳肿胀法)[5]。小鼠40只,分组、剂量及给药方法同1.4(2)实验。连续灌胃一个月后,每只小鼠用剃毛机将腹部毛剃去,范围约3×3(cm),用10 mg/mL DNFB溶液50 μL均匀涂抹致敏。5天后用10 mg/mL DNFB溶液10 μL均匀涂抹于小鼠右耳(两面)进行攻击,攻击后24 h颈椎脱臼处死小鼠,剪下左右耳壳,用打孔器取下直径8 mm耳片,称重。耳重差(mg)=右耳重-左耳重
(4)抗体生成细胞检测(Jerne改良玻片法)[6]。小鼠 40只,分组、剂量及给药方法同 1.4(2)实验。连续灌胃一个月后,每只小鼠腹腔注射2%(v/v)的SRBC悬液0.2 mL进行免疫,4天后小鼠颈椎脱臼处死,取出脾脏,放在盛有适量无菌Hank’s液的小平皿中,研磨脾脏,制成单个细胞悬液,经 200目筛网过滤,用Hank’s液洗2次,每次离心10 min(1 000 r/min),最后将细胞悬浮于8 mLHank’s液中。将表层培养基加热溶解后,放45 ℃水浴保温,与等量pH 7.2~7.4两倍浓度的Hank’s液混合,分装小试管,每管0.5 mL,再向管内加10%SRBC(v/v,用SA缓冲液配制)50 μL,25 μL脾细胞悬液,迅速混匀,倾倒于已刷琼脂糖薄层的玻片上,做2个平行片,待琼脂凝固后,将玻片水平扣放在片架上,放入37 ℃、5%CO2培养箱中孵育1.5 h,然后将制备好的补体 1∶8稀释后加入到玻片架凹槽内,继续孵育1.5 h后,计数溶血空斑数。
溶血空斑数=溶血空斑计数×320
(5)血清溶血素测定(半数溶血值,HC50)[7]。小鼠 40只,分组、剂量及给药方法同 1.4(2)实验。连续灌胃一个月后,制备 2%(v/v)的 SRBC悬液,每只鼠腹腔注射0.2 mL进行免疫,4天后从小鼠眼底静脉丛取血,于离心管内放置1 h,2 000 r/min离心10 min,分离并收集血清,血清200倍稀释后,按检验方法测定样品管及SRBC半数溶血时的光密度值。溶血素的量以半数溶血值(HC50)表示。

1.5 实验数据统计
用SPSS软件对各试验原始数据进行方差齐性检验,满足方差齐要求的数据资料,用单因素方差分析方法中的多个试验组与一个对照组间均数的两两比较方法进行统计处理[8];对非正态分布或方差不齐的数据资料用秩和检验进行统计处理[9]。
2 结果与分析
2.1 黑木耳复合多糖口服制剂对ConA诱导的小鼠脾淋巴细胞转化的效应
经口给予小鼠不同剂量的黑木耳复合多糖口服制剂一个月后,用MTT法进行ConA诱导的小鼠脾淋巴细胞转化实验,计算加 ConA孔与不加ConA孔吸光度值的差值,并对其进行方差齐性检验,满足方差齐性要求,用单因素方差分析方法中的多个试验组与一个对照组间均数的两两比较方法进行统计处理。由表 1结果可见,0.25 mL/(kg·bw·d)、0.50 mL/(kg·bw·d)、1.50 mL/(kg·bw·d)组小鼠脾淋巴细胞中加ConA孔与不加ConA孔吸光度的差值高于0 mL/(kg·bw·d)组,差异有统计学意义(P<0.05或P<0.01)。
表1 黑木耳复合多糖口服制剂对小鼠脾淋巴细胞转化的影响( ±s)

表1 黑木耳复合多糖口服制剂对小鼠脾淋巴细胞转化的影响( ±s)
注:同一列中试验组与对照组相比,*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。
[mL/(kg·bw·d)] 动物数/只 加ConA孔与不加ConA孔吸光度的差值剂量/0(对照) 10 0.136±0.082 0.25 10 0.326±0.021**0.50 10 0.261±0.092*1.50 10 0.348±0.067**
2.2 黑木耳复合多糖口服制剂对DNFB诱导小鼠DTH的影响
经口给予小鼠不同剂量的黑木耳复合多糖口服制剂一个月后,用耳肿胀法进行DNFB诱导小鼠DTH实验,计算耳壳增重,并对其进行方差齐性检验,满足方差齐性要求,用单因素方差分析方法中多个试验组与一个对照组间均数的两两比较方法进行统计处理。由表 2结果可见,0.50 mL/(kg·bw·d)、1.50 mL/(kg·bw·d)组耳壳增重高于 0 mL/(kg·bw·d)组,差异有统计学意义(P<0.05)。
2.3 黑木耳复合多糖口服制剂对小鼠溶血空斑数的效应
经口给予小鼠不同剂量的黑木耳复合多糖口服制剂一个月后,用Jerne改良玻片法进行小鼠抗体生成细胞试验,计算溶血空斑数,并对其进行方差齐性检验,不满足方差齐性要求,用秩和检验进行统计处理。由表3结果可见,1.50 mL/(kg·bw·d)组小鼠溶血空斑数高于0 mL/(kg·bw·d)组,差异有统计学意义(P<0.05)。
表2 黑木耳复合多糖口服制剂对DNFB诱导小鼠DTH的影响( ±s)
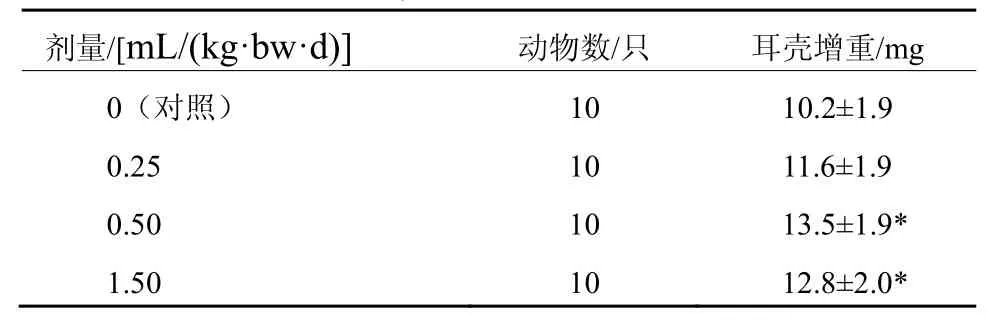
表2 黑木耳复合多糖口服制剂对DNFB诱导小鼠DTH的影响( ±s)
注:同一列中试验组与对照组相比,*表示差异显著(P<0.05)。
剂量/[mL/(kg·bw·d)] 动物数/只 耳壳增重/mg 0(对照) 10 10.2±1.9 0.25 10 11.6±1.9 0.50 10 13.5±1.9*1.50 10 12.8±2.0*
表3 黑木耳复合多糖口服制剂对小鼠溶血空斑数的影响( ±s)
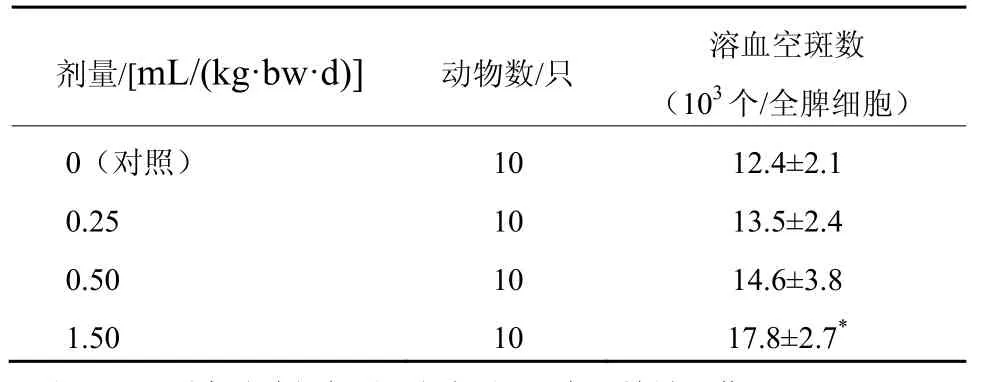
表3 黑木耳复合多糖口服制剂对小鼠溶血空斑数的影响( ±s)
注:同一列中试验组与对照组相比,*表示差异显著(P<0.05)。
剂量/[mL/(kg·bw·d)] 动物数/只 溶血空斑数(103个/全脾细胞)0(对照) 10 12.4±2.1 0.25 10 13.5±2.4 0.50 10 14.6±3.8 1.50 10 17.8±2.7*
2.4 黑木耳复合多糖口服制剂对小鼠血清半数溶血值(HC50)的效应
经口给予小鼠不同剂量的黑木耳复合多糖口服制剂一个月后,用半数溶血值法测定小鼠的血清半数溶血值(HC50),并对其进行方差齐性检验,满足方差齐性要求,用单因素方差分析方法中多个试验组与一个对照组间均数的两两比较方法进行统计处理。由表4结果可见,0.25 mL/(kg·bw·d)、0.50 mL/(kg·bw·d)、1.50 mL/(kg·bw·d)组小鼠血清半数溶血值(HC50)高于 0 mL/(kg·bw·d)组,差异有统计学意义(P<0.01)。
3 结 论
3.1 细胞免疫功能
ConA诱导的小鼠脾淋巴细胞转化试验中,0.25 mL/(kg·bw·d)、0.50 mL/(kg·bw·d)、1.50 mL/(kg·bw·d)组小鼠脾淋巴细胞中加ConA孔与不加ConA孔吸光度的差值显著或极显著高于0 mL/(kg·bw·d)组;DNFB 诱导小鼠 DDTH 试验中,0.50 mL/(kg·bw·d)、1.50 mL/(kg·bw·d)组 耳 壳 增 重 显 著 高 于 0 mL/(kg·bw·d)组。
表4 黑木耳复合多糖口服制剂对小鼠HC50的影响( ±s)

表4 黑木耳复合多糖口服制剂对小鼠HC50的影响( ±s)
注:同一列中试验组与对照组相比,**表示差异极显著(P<0.01)。
剂量/[mL/(kg·bw·d)] 动物数/只 HC50 0(对照) 10 135±3 0.25 10 143±4**0.50 10 142±4**1.50 10 147±7**
3.2 体液免疫功能
抗体生成细胞检测试验中,1.50 mL/(kg·bw·d)组小鼠溶血空斑数显著高于0 mL/(kg·bw·d)组;小鼠血清半数溶血值试验中,0.25 mL/(kg·bw·d)、0.50 mL/(kg·bw·d)、1.50 mL/(kg·bw·d)组小鼠血清半数溶血值(HC50)极显著高于0 mL/(kg·bw·d)组。
综上结果,黑木耳复合多糖口服制剂在提高细胞免疫和体液免疫方面都具有积极作用(正效应),差异有统计学意义。表明黑木耳复合多糖口服制剂具增强免疫力的保健功能,有药用价值。

