不同退化阶段松嫩草地土壤对羊草种子萌发和幼苗生长的影响
,,, ,,景玉
(1.中国科学院 东北地理与农业生态研究所,吉林 长春 130102; 2.中国科学院大学,北京 100049; 3.白城市畜牧科学研究院,吉林 白城 137000)
0 引 言
由于人类活动和全球环境变化的双重影响,世界土壤盐碱化面积不断增加,盐碱化程度不断加重[1-4]。目前,全球约有10亿hm2的土地受到盐渍化的胁迫,且仍以10%的速率增加[5]。松嫩草地位于我国东北部欧亚草原区的最东端,面积辽阔,作为东北地区西部重要的绿色生态屏障,曾经是生产力较高的重要牧业区,对当地生态环境和区域经济发展有着重要意义[6-7],但是近年来该区土壤盐碱化问题加重,其盐碱土类型属于以Na2CO3和NaHCO3为主要盐碱成分的内陆苏打盐碱土,pH值高,碱化度高,土壤理化性状不良,致使松嫩草地生态系统发生了明显的退化现象[8-10]。
草地生态系统退化的主要表现是植被逆向演替、土壤性质恶化以及生态功能衰减等,其中最核心问题体现在土壤性质退化上[11]。松嫩草地植被逆向演替进程和土壤盐碱化过程相互联系,且土壤盐碱化程度越重,植被退化演替所受到的驱动力越大[12]。已有研究表明,松嫩草地逆向演替过程中,植被群落退化演替规律表现为:羊草(Leymuschinensis)群落→碱茅(Puccinelliadistans)群落→虎尾草(Chlorisvirgata)群落→碱蓬(Suaedaglauca)群落直至退化为光碱斑[13-15]。由于植被与土壤的相互作用以及人类的不合理放牧等行为使得松嫩草地羊草群落发生退化演替,反过来又导致该区域土壤盐碱化情况加重[16-17],该现状严重威胁到松嫩草地的环境安全和生态效益。因此植被恢复对于提高松嫩草地的生态功能和经济效益具有重要意义。
羊草是松嫩草地的原始优势植被,具有耐盐碱、耐干旱及耐冷等优良的特性,生态幅宽,无性繁殖能力强,营养价值高,是盐碱地植被恢复的理想物种[18-19]。种子萌发和幼苗生长是植物种群能否在盐碱环境下成功建植的关键生育期[20-23],育苗土壤的不同特性对种子萌发成苗具有重要的影响[24]。目前虽然对羊草种子的耐盐碱特性有较多的研究,但多数采用室内模拟研究,通过不同浓度的NaCl[25]、Na2CO3[26]、不同盐分混合[27-29]模拟盐碱程度,而盐碱土本身存在着很大的差异,不仅仅反映在某一个特定盐分的含量上面,而是多种盐分互作,另外土壤的物理性质也会影响种子萌发和幼苗生长,而这些在水培试验中无法模拟,不能反映土壤中种子萌发和幼苗生长的实际情况[30],因此,本研究按照典型草原的演替序列,选择了羊草群落→碱茅群落→虎尾草群落→碱蓬群落为单一优势物种的植物群落,探讨了松嫩草地不同退化土壤对羊草种子萌发、幼苗生长的影响,旨在对优质牧草合理种植提供科学依据,为草地生态系统的恢复和重建提供理论依据。
1 材料和方法
1.1 研究区概况
研究区位于松嫩平原西部的中国大安碱地生态试验站(45°35′58″~45°36′28″N,123°50′27″~123°51′31″E)。该区地处中温带大陆性季风区,亦属于半湿润向半干旱气候过渡地带,年平均气温3℃,年均降水量413.7 mm,年均蒸发量1 756.9 mm。研究区域的土壤主要为淡黑钙土、碱化草甸土、风沙土和盐碱土。植被以羊草和杂类草为主,属于松嫩平原草甸草原类型。由于自然因素和人为干预,该区域的羊草群落发生了明显的退化,呈现出向碱茅群落、虎尾草群落和碱蓬群落的阶段性演替趋势[13-14]。
1.2 试验材料
供试的羊草种子是2015年采自中国大安碱地生态试验站。采集后的种子在室温下晾干后装入透气的布袋中,放在4℃冰箱内保存备用。在实验开始之前,先用0.1%的HgCl2溶液对羊草种子进行杀菌处理,时间为10 min,然后再用蒸馏水将种子冲洗若干遍。
1.3 实验设计
1.3.1 土样采集与处理。2016年7月份在中国大安碱地生态试验站进行野外调查与取样。选择羊草群落、虎尾草群落、碱茅群落以及碱蓬群落4个区域,按网格法采集土壤样品,即在每个区域随机确定取样点3个,分别以每个取样点为中心,在半径3 m的范围内,用内径4 cm的土钻按0~20 cm土层各随机取10钻土样,以每10钻土样组成1个混合土样。实验样品带回实验室,将大块土壤敲碎,将植物根系等杂物挑出,室内晾干后,过2 mm土壤筛,备用。
1.3.2 土壤盐分和养分的测定指标。将采集的不同群落的土壤在室温下晾干,根据李彬等[29]方法测定土壤性质,包括土壤盐分的指标:土壤电导率(EC)、pH值、Ca2+、CO32-、HCO32-以及交换性钠离子、阳离子交换量;养分指标:速效氮(AN)和速效磷(AP)的含量。
1.3.3 不同退化阶段土壤的种子萌发实验。将上述土壤装入直径9 cm的培养皿内,每个培养皿内装70 g土壤。分别选择均匀、饱满的羊草种子,每皿播25粒,埋深为2~5 mm,播种后加入适量的蒸馏水。每个处理4个重复,及时补充水分。在HPG-28Ⅱ人工气候箱(哈尔滨市东联电子科技开发有限公司)内进行萌发实验,发芽条件为16/28℃变温,夜晚温度为16 ℃(18:00-次日6:00),白天温度为28 ℃(6:00-18:00),12 h黑暗/12 h光照,光照强度为54 μmol·m-2·s-1。种子发芽期间,每24小时记录种子发芽数,根据国际种子检验规程,有明显的胚根“露白”即认定为发芽[31]。当种子发芽数没有明显变化时,说明发芽结束。种子发芽结束后,将培养皿中所有发芽的种子取出,用刻度尺测量其幼苗的根长及苗长。
1.3.4 数据处理。

其中:n-萌发的种子粒数;N-供试种子数。
利用SPSS20.0软件对数据进行统计分析,采用Duncan方法进行多重比较,在P<0.05水平,确定各个平均值之间的差异显著性。利用Origin8.5软件绘图,图中数据表示均值±标准误差。
2 结 果
2.1 土壤理化特征
松嫩草地不同退化土壤之间的土壤pH值和电导率不同,见图1。伴随着植被群落从羊草群落到碱蓬群落的逆向演替进行,土壤pH值和电导率逐渐升高然后趋于稳定趋势。所有土样的pH值均在8.0以上,其中虎尾草群落土壤pH值最高,达到了9.82,其次是碱茅群落土壤pH值为9.59;虎尾草群落土壤pH值比羊草群落高17.4%。方差分析表明,碱茅群落、虎尾草群落和碱蓬群落三者之间土壤pH值无显著差异,但这3个群落与羊草群落土壤pH值差异显著(P<0.05)。虎尾草群落土壤电导率最高,达到了579 μS·cm-1,与羊草群落相比升高了72.7%。其次是碱蓬群落土壤电导率为473 μS·cm-1,高于羊草群落41.1%。方差分析表明,碱茅群落、虎尾草群落和碱蓬群落三者之间土壤电导率无显著差异,但羊草群落与其他3种群落土壤电导率差异显著(P<0.05)。
松嫩草地的植被群落由羊草群落到碱蓬群落的退化演替过程中,土壤中的Na+进入土壤复合胶体表面的机率增多[32],使得土壤碱化程度加重,主要表现为土壤碱化度逐渐增加,见图2。碱蓬群落土壤碱化度最大,高达40.5%,其次为虎尾草群落为20.1%,分别高于羊草群落15.1倍与7.8倍,由方差分析表明,碱茅群落与羊草群落的土壤碱化度处于同一显著水平,但与虎尾草群落、碱蓬群落差异显著(P<0.05)。


注:LC、PD、CV和SG分别代表不同退化阶段的羊草群落、碱茅群落、虎尾草群落和碱蓬群落。下同。Note:LC,PD,CV and SG represent the communities of Leymus chinensis,Puccinellia distans,Chloris virgata and Suaeda glauca,respectively.The same is as below.图1 不同退化阶段土壤pH和土壤电导率Fig.1 Soil pH and soil electric conductivity from different degradation stages


注:不同小写字母表示在0.05水平上差异显著,下同。
土壤养分含量是植物生长状况与产量构成的重要影响因素[33],土壤所供应养分的状况,主要体现在速效养分含量上。不同退化阶段草地0~20 cm土层中速效氮和速效磷含量的变化具有很大差异,羊草群落土壤速效氮含量最高为92.4 mg·kg-1,其次为碱茅群落为81.2 mg·kg-1,碱蓬群落土壤速效氮含量最低为40.6 mg·kg-1,方差分析结果表明,羊草群落与碱茅群落的土壤速效氮含量处于同一显著水平,且与碱蓬群落之间差异显著(P<0.05);不同退化阶段土壤速效磷含量不同,由方差分析表明,不同退化阶段土壤间速效磷含量差异不显著,见图4。

图4 不同退化阶段土壤养分含量比较Fig.4 Comparison of soil nutrient from different degradation stages
2.2 不同退化阶段草地土壤条件下羊草种子的萌发特性
羊草种子在不同退化程度土壤中的出苗率随播种天数的增加而增加,见图5。在整个萌发过程中,羊草群落土壤条件下种子出苗率一直显著高于其他3种群落,而在碱茅群落、虎尾草群落和碱蓬群落土壤条件下种子出苗率没有显著差异。在播种33 d之前,虎尾草群落土壤中羊草种子的出苗率最低,播种33 d之后,碱蓬群落土壤中羊草种子出苗率最低。羊草群落土壤条件下羊草种子出苗率最高为39%,其次是碱茅群落为17%,分别高于碱蓬群落5.5倍和1.8倍,方差分析结果显示,虎尾草群落和碱蓬群落土壤中羊草种子出苗率处于同一显著水平,且与羊草群落、碱茅群落差异显著(P<0.05),见图6。

图5 不同退化阶段土壤中羊草种子发芽动态Fig.5 Germination dynamics of Leymus chinensis in soil from different degradation stages

图6 不同退化阶段土壤羊草出苗率Fig.6 Emergence rate of Leymus chinensis in soil from different degradation stages
2.3 不同退化阶段土壤条件下羊草幼苗的生长情况
不同退化阶段土壤条件下羊草幼苗的生长状况不同。羊草群落中羊草苗长最高为5.92 cm,比碱蓬群落苗长显著增加了58.7%,且与碱茅群落和虎尾草群落苗长无显著差异;羊草群落土壤条件下羊草幼苗根长最高为5.17 cm,碱蓬群落土壤中羊草幼苗根长最低为0.40 cm,且羊草群落、虎尾草群落和碱蓬群落土壤间羊草幼苗根长长势差异显著(P<0.05),见图7。
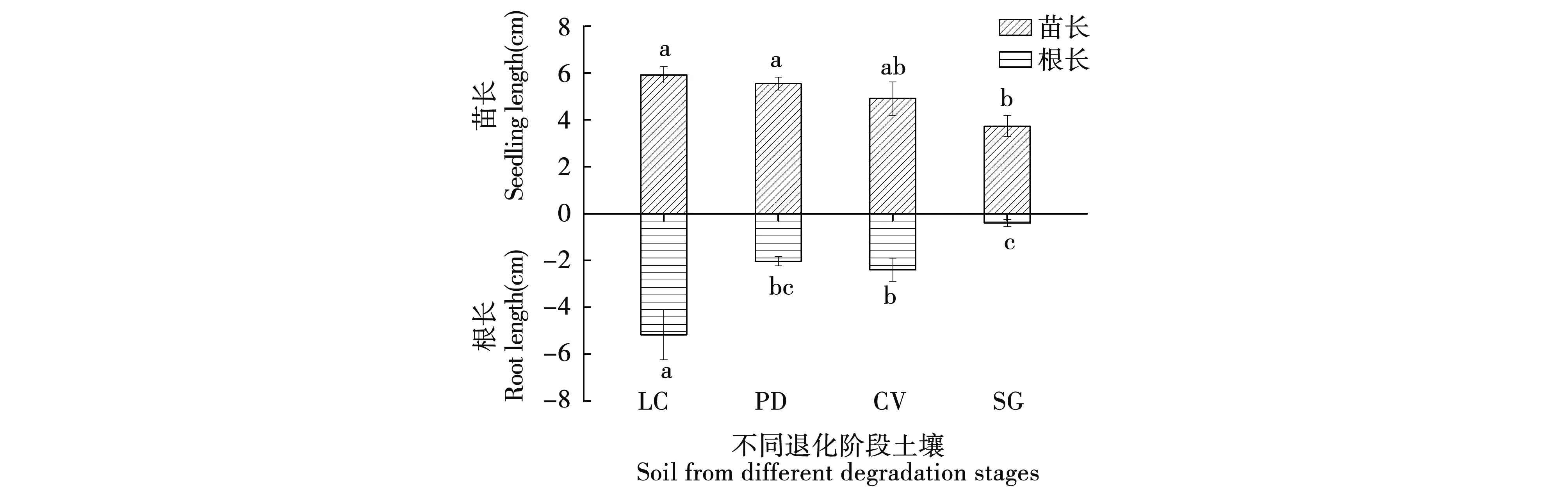
注:纵坐标负数代表羊草地下部。Note:Negative ordinates represent the underground part of Leymus chinensis.图7 不同退化阶段土壤对羊草幼苗生长的影响Fig.7 Seedling growth of Leymus chinensis in soil among different degradation stages
3 讨 论
大量研究表明,松嫩草地退化主要表现为土壤盐渍化程度加重[34-36]。种子萌发对盐碱胁迫的敏感性是众多物种的共性[37-38]。本研究结果表明,羊草种子在羊草群落土壤中的萌发状况最好,在轻度退化的碱茅群落土壤中萌发受到一定的延缓作用,但是差异不显著,而在重度退化的碱蓬群落中,由于高浓度的盐碱条件其萌发受到显著抑制,这与易津等[39]、郎志红[40]研究结果一致,可能是因为松嫩草地退化土壤盐碱化程度重,对植物造成混合盐碱胁迫现象,而混合盐碱胁迫不只是盐胁迫和碱胁迫的简单叠加,而是具有一定的协同效应,并且该协同效应元比单纯盐胁迫或碱胁迫强烈,其对植物种子及幼苗的伤害包括离子毒害、渗透胁迫以及高pH值,具体表现为交换性离子使种子内部生理失衡,高pH值对种子内部某些酶产生毒害作用[41],种子细胞膜的结构与功能容易受到破坏[42-45]。部分研究表明,低盐、低碱的环境在一定程度上促进植物种子萌发,重度盐碱土抑制种子萌发[46-48],这可能与所研究植物耐盐碱性不同,或者是因为植物受到的胁迫盐分种类、浓度界限等存在差异而导致研究结果出现差异。

4 结 论
本文以松嫩草地不同退化阶段土壤为研究对象,探讨了羊草种子萌发和幼苗生长对不同退化阶段土壤条件的响应。初步得到如下结论:
(1)随着地上植被从羊草、碱茅、虎尾草、碱蓬群落的演替,土壤退化程度呈加剧趋势,土壤pH值和EC逐渐升高,虎尾草和碱蓬群落土壤pH为10左右;土壤碱化度呈显著上升趋势。随着地上植被退化演替,土壤中速效氮显著下降,而速效磷没有显著差异。
(2)随着植被退化演替的加剧和土壤理化性质的恶化,土壤对羊草种子的出苗率和幼苗生长的抑制作用增强;且对羊草幼苗根长的生长抑制要比对幼苗苗长生长的抑制更严重。因此,在虎尾草、碱蓬甚至退化更为严重的盐碱光斑地,通过羊草直播技术进行植被恢复可行性差。可通过施加客土或对土壤进行调酸处理[53]等方法,并配合适当的水肥调控措施,保证羊草幼苗能够成功定植。

