罗非鱼源无乳链球菌对氨基糖苷类耐药性及耐药基因检测
杨明伟,韦慕兰,罗福广,黎姗梅,黄立春,李 明,吕小丽,王 强,米 强,梁静真,黄 钧
(1.广西水生动物病害诊断实验室/广西大学动物科学技术学院,广西南宁 530005;2.广西水产畜牧学校,广西 南宁 530021;3.都安瑶族自治县水产技术推广站,广西都安 530700;4.柳州市渔业技术推广站,广西 柳州 545006;5.广西水产技术推广总站,广西南宁 530022;6.南宁市水产畜牧兽医技术推广站,广西 南宁 530001;7.玉林市玉州区水产技术推广站,广西 玉林537000;8.陆川县水产养殖技术推广站,广西陆川 537700;9.博白县水产技术推广站,广西博白 537600)
【研究意义】罗非鱼(Oreochromis spp.)养殖业是广西水产养殖的重要支柱产业之一。但随着罗非鱼养殖规模的不断扩大,各种病害频发,尤其是链球菌病等细菌性疾病常呈暴发性流行态势。已知链球菌(Streptococcus spp.)是一类分布广泛的溶血性革兰氏阳性菌,可引起人类和猪、牛等多种脊椎动物感染发病[1]。近年来,因链球菌病引起的罗非鱼死亡率可达90%,经济损失高达20多亿元/年[2],对我国罗非鱼的健康养殖和罗非鱼产业的可持续发展已构成严重威胁。氨基糖苷类抗生素包括链霉素、庆大霉素、新霉素等,具有水溶性好、性质稳定、价格低廉等优点,广泛应用于动物细菌病的治疗,但因该类抗生素的不科学、不合理使用造成的细菌耐药问题日趋严重[3]。研究罗非鱼源无乳链球菌对氨基糖苷类抗生素的耐药性和了解其相关耐药基因的携带情况,对罗非鱼无乳链球菌病防控的临床科学合理用药和对该菌耐药机制的进一步研究具有重要的理论和实践意义。【前人研究进展】已知细菌对氨基糖苷类药物产生耐药与其分泌氨基糖苷类修饰酶有关,其主要机制为氨基糖苷类修饰酶对抗生素的羟基或氨基进行修饰从而干扰抗生素作用于细菌核糖体[4-5]。这些修饰酶包括乙酰转移酶(AAC)、磷酸转移酶(APH)和核苷转移酶(ANT)3 大类[6-7]。这些氨基糖苷类修饰酶编码基因能随着可移动遗传组件(如整合子、转座子和质粒)在菌株间进行水平传播,导致不同种类的细菌产生耐药[8]。目前,有关氨基糖苷类耐药基因的检测多见于鲍曼不动杆菌(Acinetobacter baumannii)[9-10]、肺炎克雷伯菌(Klebsiella pneumoniae)[7,11]、大 肠 杆 菌 (Escherichia coli)[3]和肠球菌(Enterococcus spp.)[4,12]等。【本研究切入点】关于无乳链球菌对氨基糖苷类耐药表型和耐药机制的研究至今仍较少见。【拟解决的关键问题】以K-B纸片扩散法对32株罗非鱼源无乳链球菌菌株进行氨基糖苷类药物敏感性试验,采用PCR方法检测无乳链球菌4种氨基糖苷类耐药基因(aph(3')-Ia、ant(3')-I、aac(3')-Ib、aac(6')-Ib)的携带情况,为罗非鱼细菌病的病害防控提供参考,也为链球菌对氨基糖苷类药物的耐药分子机制的进一步研究提供理论依据。
1 材料与方法
1.1 试验材料
供试菌株为从广西南宁市、玉林市和柳州市养殖患病罗非鱼中分离鉴定的32株无乳链球菌,菌株的分离时间及来源地等信息见表1。其中,南宁市8株,玉林市11株,柳州市13株。3种氨基糖苷类药物链霉素、庆大霉素和新霉素的药敏片购自杭州天和微生物试剂有限公司。
PCR扩增引物由上海生工生物工程技术服务有限公司合成。PCR缓冲液、dNTPs、Taq聚合酶、MgCl2、ddH2O等实验试剂均购于宝生物工程(大连)有限公司。琼脂糖为美国Invitrogen公司生产。细菌DNA提取试剂盒和琼脂糖DNA回收试剂盒均购自北京天根生化科技有限公司。脑心浸液琼脂培养基(BHIA)为英国OXOID公司生产。
1.2 药敏试验
采用K-B纸片扩散法,用无菌接种环接种纯化培养的菌种,然后致密划线于BHIA培养基表面,使菌种均匀布满在平板上,用无菌镊子将3种药敏纸片均匀贴于含菌琼脂平板上。最后置于30℃恒温培养箱内,18~24 h培养后测量并记录抑菌圈直径数据。抑菌圈直径数据结果判定参照杭州天和微生物试剂有限公司提供的药敏纸片判读说明书。
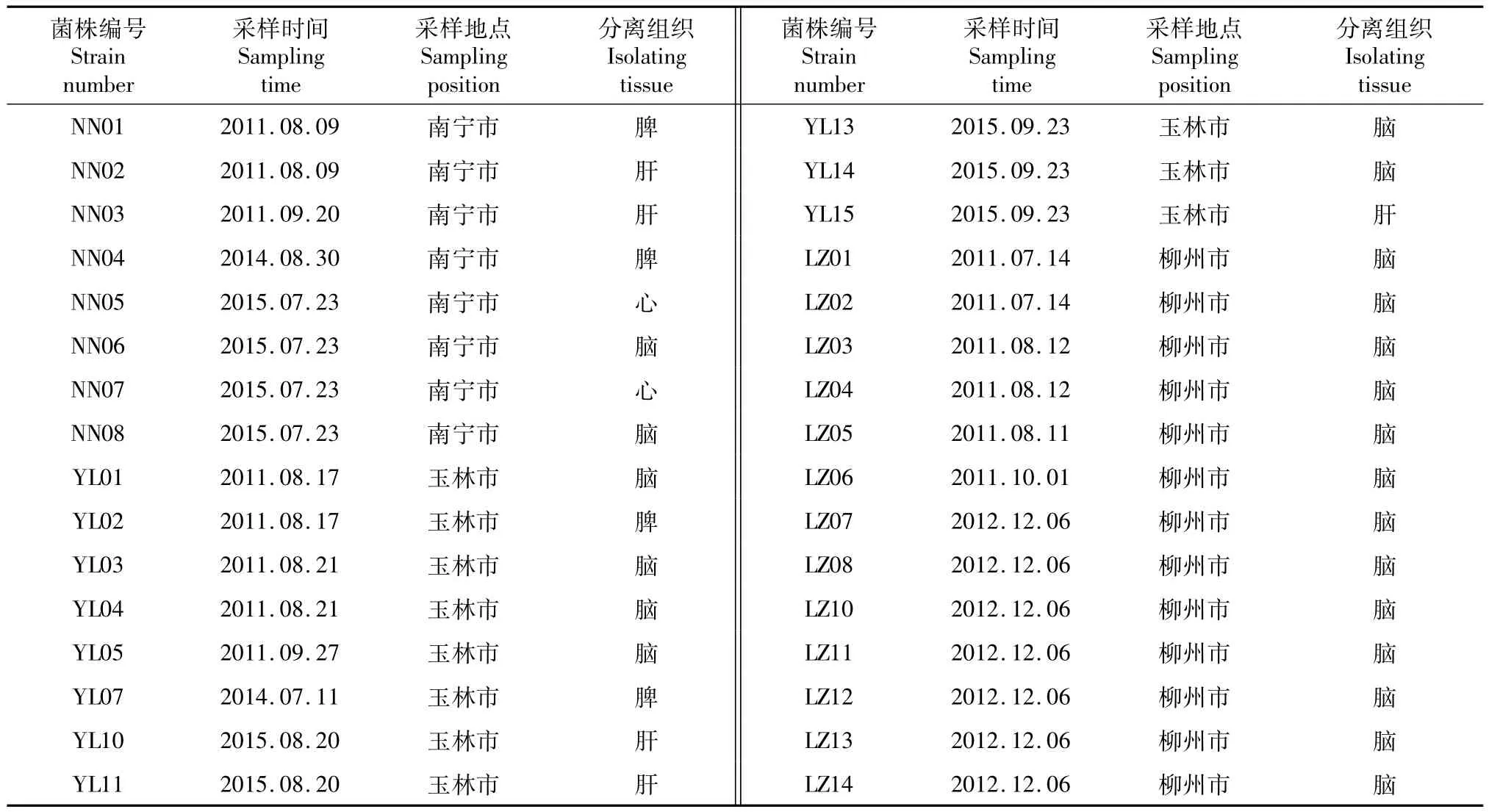
表1 菌株来源Table 1 Source of strains
1.3 耐药基因检测
按产品说明书的方法收集菌体并提取其基因组DNA后于-20℃保存备用。耐药基因PCR扩增引物、退火温度、目的片段长度及修饰底物见表2。PCR反应体系参照文娟等[13]的方法,94℃预变性5 min,进入PCR 循环,94 ℃变性30 s,退火30 s,72 ℃延伸1 min,共进行30个循环;最后72℃延伸10 min。PCR反应结束后以1.0%琼脂糖凝胶电泳进行检测,用北京六一凝胶成像分析系统(WD-9413B)对结果进行观察和分析。PCR产物送华大生物技术有限公司测序。采用ClustalX、DNAstar、MEGA等软件进行核苷酸序列一致性分析以及系统发育树构建。
1.4 统计分析
抗生素耐药性和耐药基因检出率在3个市之间的差异性采用SPSS 18.0统计软件中的χ2检验进行分析,P<0.05时表示差异显著。耐药表型与耐药基因符合率(%)为携带耐药基因并具有相应耐药表型的菌株数与具有相应耐药表型的菌株数的百分比。

2 结果与分析
2.1 药敏试验结果
对罗非鱼源无乳链球菌进行氨基糖苷类抗生素的药敏试验结果表明,32株无乳链球菌对链霉素和庆大霉素的耐药率最高,均为100.0%(32/32),对新霉素耐药率最低,为78.1%(25/32)(表3)。
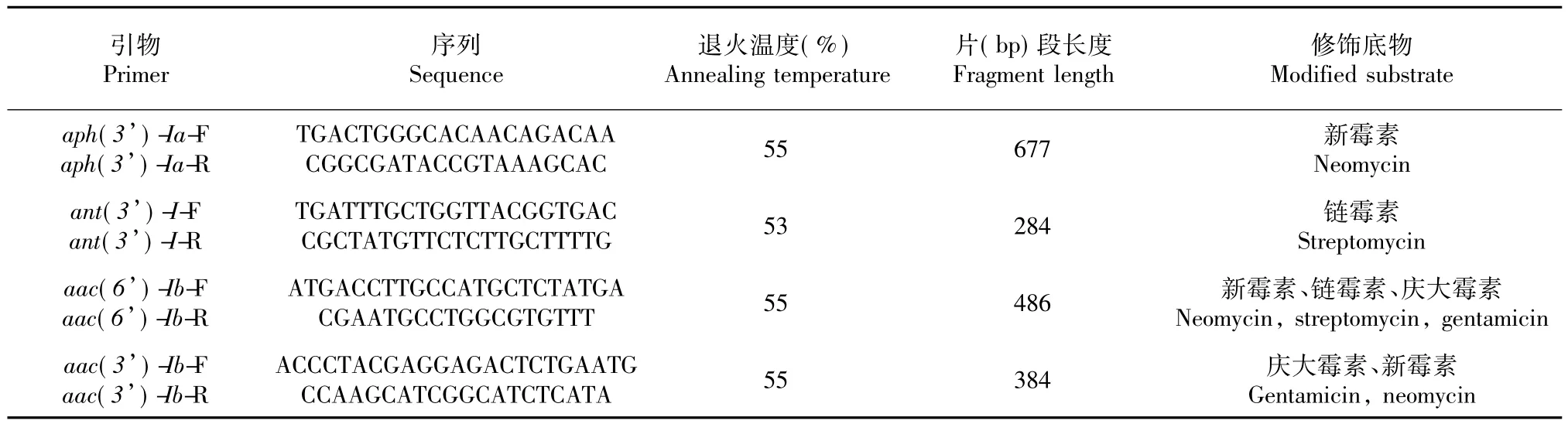
表2 耐药基因PCR扩增的引物、退火温度、目的片段长度及修饰底物Table 2 The primer,annealing temperature,fragment length and modified substrate of PCR amplification of resistance genes

表3 无乳链球菌菌株对3种氨基糖苷类药物药敏试验结果(%)Table 3 Antibiotic sensitivity test results of the Streptococcus agalactiae strains against three kinds of aminoglycosides

表4 3个市之间无乳链球菌对3种氨基糖苷类药物的耐药率比较Table 4 Comparison of the resistance rates of Streptococcus agalactiae against three kinds of aminoglycoside antibiotics among the three cities
经比较(表4),无乳链球菌对链霉素和庆大霉素的耐药率在南宁、玉林和柳州3个市中均为100.0%,差异不显著(P>0.05,下同)。新霉素在南宁市、玉林市和柳州市的耐药率依次为87.5%、100.0%、53.8%,3 个市之间差异显著(P <0.05)。
2.2 耐药基因的PCR检测结果
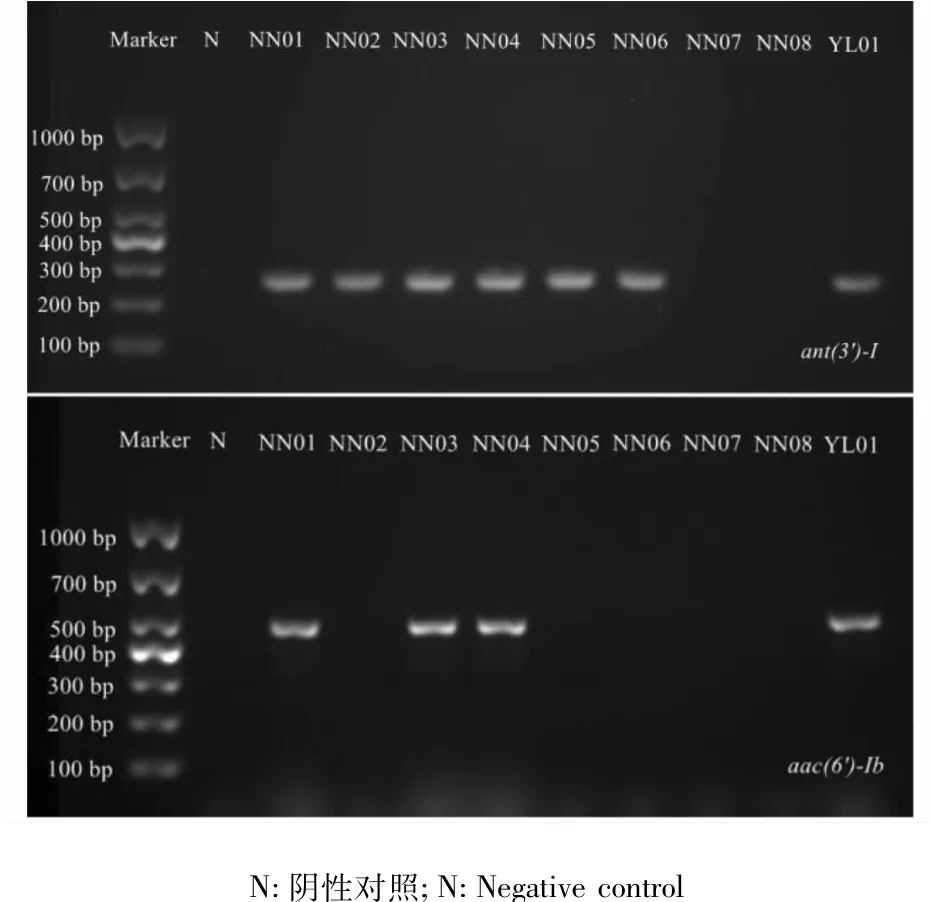
图1 部分菌株ant(3')-I(上)和aac(6')-Ib(下)的电泳结果Fig.1 Electrophoresis results of ant(3')-I(above)and aac(6')-Ib(below)genes of several strains
对32株无乳链球菌进行4种氨基糖苷类耐药基因部分序列的PCR检测结果(图1)表明,部分菌株可扩增出大小约284 bp的ant(3')-I基因片段或486 bp的aac(6')-Ib片段,与预期片段大小基本一致。但经反复PCR检测,aph(3')-Ia、aac(3')-Ib均未扩增出预期片段。将ant(3')-I和aac(6')-Ib检测为阳性的PCR产物送测序,测序结果经比对确认该序列为ant(3')-I和aac(6')-Ib基因的部分序列。
从南宁市、玉林市和柳州市ant(3')-I检测为阳性的样品中各随机抽取1个样品(分别为NN02、YL03和LZ01),基于ant(3')-I基因284 bp左右的部分序列建立系统发育树(图2),并采用DNAStar软件进行分析,结果表明,来源于 YL03、LZ01和NN02菌株的ant(3')-I基因与来源于肺炎克雷伯菌(AY675228.1)、鲍曼不动杆菌(AY551438.1)、金黄色葡萄球菌(Staphylococcus aureus,KY788646.1)及铜绿假单胞菌(Pseudomonas aeruginosa,AY675229.1)的聚为一支。序列的一致性为96.5% ~98.4%,与来源于大肠杆菌(NG052496.1)和肠道沙门氏菌(Salmonella enterica,NG_052487.1)的序列一致性为87.1% ~89.4%。

图2 基于ant(3')-I部分序列的系统发育树Fig.2 Phylogenetic tree of partial sequences of ant(3')-I
从南宁市、玉林市和柳州市aac(6')-Ib检测为阳性的样品中各随机抽取1个样品(分别为NN03、YL07和LZ08),基于aac(6')-Ib基因486 bp左右的部分序列建立系统发育树(图3),并采用DNAStar软件进行分析,结果显示,源于 YL07菌株的 aac(6')-Ib基因与源于金黄色葡萄球菌(KT709555.1)、阴沟肠杆菌(Enterobacter cloacae,AF202035.1)、维氏气单胞菌(Aeromonas veronii,HM453325.1)的聚为一支,序列的一致性分别为100%、100%和99.8%;源于LZ08和NN03的aac(6')-Ib基因与源于肺炎克雷伯菌(LC373256.1)的聚为一支,序列的一致性均为99.8%。
32株无乳链球菌的4种氨基糖苷类耐药基因检测结果(表5)表明,在所有被检菌株中,aph(3')-Ia、aac(3')-Ib、ant(3')-I和 aac(6')-Ib 的检出率依次为0.0%(0/32)、0.0%(0/32)、75.0%(24/32)和31.3%(10/32)。所检无乳链球菌中同时携带ant(3')-I和 aac(6')-Ib的菌株占28.1%(9/32),只携带其中1种耐药基因的菌株占50.0%(16/32),未检出耐药基因的菌株占21.9%(7/32)。

图3 基于aac(6')-Ib部分序列的系统发育树Fig.3 Phylogenetic tree of partial sequences of aac(6')-Ib
所检基因中,ant(3')-I基因在南宁市、玉林市和柳州市分离株中的检出率分别为75.0%、81.8%和69.2%,aac(6')-Ib基因在南宁市、玉林市和柳州市分离株中的检出率分别为37.5%、27.3%和30.8%,2种耐药基因 ant(3')-I和 aac(6')-Ib在3个市之间均无显著差异(表6)。
2.3 无乳链球菌氨基糖苷类耐药表型与耐药基因的符合率
无乳链球菌氨基糖苷类耐药表型与耐药基因的符合率分析结果(表7)表明,耐药表型和耐药基因符合率最高的为链霉素耐药表型与ant(3')-I基因的符合率(75.0%),其次为新霉素耐药表型与aac(6')-Ib基因的符合率(36.0%)及庆大霉素和链霉素耐药表型与aac(6')-Ib基因的符合率(均为31.3%)。新霉素耐药表型与aph(3')-Ia基因、庆大霉素和新霉素耐药表型与aac(3')-Ib基因的符合率最低,均为 0.0%。

表5 32株无乳链球菌氨基糖苷类耐药基因分布Table 5 Distribution of aminoglycoside resistance genes in 32 strains of S.agalactiae

表6 3个市之间氨基糖苷类耐药基因的检出率比较Table 6 Comparison of detection rates of aminoglycoside resistance genes among the three cities

表7 无乳链球菌氨基糖苷类耐药表型与耐药基因的符合率(%)Table 7 Compliance rate of aminoglycoside resistance and resistance gene of S.agalactiae
3 讨论
氨基糖苷类抗生素是由小单孢菌(Micromonospora)或链霉菌(Streptomyces)产生或半合成所制成的水溶性碱性抗生素,包括链霉素、新霉素、庆大霉素、卡那霉素和阿米卡星等[14],对肠杆菌科(Enterobacteriaceae)、不发酵糖的革兰氏阴性杆菌及一些革兰氏阳性球菌均有很好的抗菌活性,与青霉素类或头孢类抗生素联用时具有协同抗菌作用[9]。卢迈新等[15]从广东、海南等地分离的无乳链球菌对庆大霉素、新霉素及链霉素耐药率均为100.0%。彭民毅[16]采集的无乳链球菌广西分离株对新霉素、链霉素及庆大霉素耐药率均在80.0%以上。本试验中的无乳链球菌菌株对链霉素、庆大霉素及新霉素的耐药率依次为 100.0%、100.0%、78.1%,与上述文献的药敏结果相似。但广东肇庆及湛江地区罗非鱼源无乳链球菌对庆大霉素敏感率为10.17%和17.65%[2],远高于本试验结果(0.0%);而肇庆和珠海分离株的新霉素耐药率分别为10.17%和0%,明显低于本试验的78.1%;肇庆分离株对链霉素的耐药率(13.56%)也极显著低于本试验的耐药率(100.0%)。霍欢欢等[17]的研究结果表明,2010及2011年海南无乳链球菌分离株对庆大霉素的敏感率依次为28%和6%,高于本试验结果(0.0%)。本试验中,南宁市、玉林市和柳州市的无乳链球菌分离株对新霉素的耐药率存在显著差异。综合前人和本试验研究结果可知,罗非鱼源无乳链球菌对新霉素、链霉素和庆大霉素的敏感性存在一定的不同地区或同一地区不同年份差异性,可能与不同地区、不同时期的抗生素使用习惯和使用频率不同等因素有关。总体而言,由于广西罗非鱼源无乳链球菌对新霉素、链霉素和庆大霉素耐药率均较高,在防治无乳链球菌感染时上述药物不宜选用。
本试验检测了 aph(3')-Ia、ant(3')-I、aac(3')-Ib及aac(6')-Ib 4种氨基糖苷类耐药基因在广西罗非鱼源无乳链球菌中的分布情况。其中,aph(3')-Ia编码的磷酸转移酶APH(3')-Ia主要介导对卡那霉素、新霉素耐药[18]。有学者在鲍曼不动杆菌、肺炎克雷伯菌及霍乱弧菌(Vibrio cholerae)等革兰氏阴性菌及棒状杆菌(Corynebacterium)等革兰氏阳性菌中发现了 aph(3')-Ia 的存在[9,18]。aac(3')-Ib 编码的乙酰转移酶AAC(3')-Ib主要对庆大霉素、新霉素和妥布霉素产生作用,在临床分离革兰氏阴性菌中的检出率约为30%[18]。AAC(6')-Ib是导致革兰氏阴性菌产生耐药最重要的广谱乙酰转移酶,aac(6')-Ib基因在人源大肠杆菌和儿童源肺炎克雷伯菌中的检出率分别为 9.4%[8]和 15.0%[7]。由ant(3')-I基因编码的核苷转移酶ANT(3')-I主要通过修饰链霉素和壮观霉素的羟基而引起细菌产生耐药性,该基因广泛分布于革兰氏阴性菌以及金黄色葡萄球菌等革兰氏阳性菌中[18],其检出率在犬源大肠杆菌为 23.1%[13],人源大肠杆菌为 6.2%[8],儿童源肺炎克雷伯菌为5.0%[7]。本试验在32株受试无乳链球菌中均未检测出aph(3')-Ia和aac(3')-Ib基因,aac(6')-Ib和ant(3')-I基因的检出率分别为31.3%和75.0%。根据序列一致性分析结果,从无乳链球菌检出的ant(3')-I基因与来源于大肠杆菌、肺炎克雷伯菌和鲍曼不动杆菌的ant(3')-I基因的一致性为87.1% ~98.4%,aac(6')-Ib基因与源于金黄色葡萄球菌、阴沟肠杆菌和肺炎克雷伯菌的aac(6')-Ib基因的一致性为99.8% ~100%。据此推测,本试验无乳链球菌的aac(6')-Ib和ant(3')-I基因可能与这几种细菌的相应基因具有共同的起源;aac(6')-Ib和ant(3')-I基因可能随着整合子、转座子或质粒在菌株间传播的过程中发生一定变异[8]。本试验中 ant(3')-I和aac(6')-Ib的检出率均高于这2种耐药基因在人源大肠杆菌、儿童源肺炎克雷伯菌中的检出率,而aph(3')-Ia基因和aac(3')-Ib基因的检出结果均为阴性,其原因可能是无乳链球菌本身并不携带aph(3')-Ia和aac(3')-Ib基因,或是因某些因素导致无乳链球菌中的aph(3')-Ia和aac(3')-Ib基因缺失,这仍需大量的研究数据予以证实。综合分析前人和本试验研究结果,可知不同地区和来源的细菌其耐药基因分布情况不尽相同。
本试验中,广西罗非鱼源无乳链球菌氨基糖苷类耐药基因以ant(3')-I和aac(6')-Ib为主。链霉素耐药表型和ant(3')-I基因的符合率为75.0%,新霉素、庆大霉素耐药表型和aac(6')-Ib基因的符合率分别为36.0%和31.3%,说明在广西境内,核苷转移酶ANT(3')-I可能是导致无乳链球菌对链霉素耐药的主要机制,乙酰转移酶AAC(6')-Ib可能是导致无乳链球菌对新霉素或庆大霉素耐药的主要机制。但氨基糖苷类耐药基因种类繁多[12],本试验菌株是否存在其他耐药基因介导的耐药机制(如16S rRNA甲基化酶等)仍需进一步的研究。细菌耐药表型除了与耐药基因相关外,也可能与细菌外膜通透性改变、外排作用及抗生素使用方式等因素相关。如当外界环境发生变化时,大肠杆菌可调节其外膜孔蛋白OmpC和OmpF的表达以控制抗生素经细菌外膜的通透性[19];在铜绿假单胞菌中,MexXYOprM多重外排系统与氨基糖苷类耐药性形成密切相关[20]。细菌耐药性形成还与抗生素使用方式有关,许多研究表明,气单胞菌(Aeromonas)等水生动物病原菌在亚抑菌浓度诱导下可以获得对四环素类、氟喹诺酮类等抗生素的高耐药性[21-23],细菌与低浓度抗生素长期接触时容易引起细菌耐药[21]。已知氨基糖苷类修饰酶能随着可移动遗传组件(如整合子、转座子和质粒)在菌株间进行水平传播,导致不同种类的细菌产生耐药性[8,24],据此推测,养殖水环境中的细菌可能已成为耐药基因的储存库,对耐药基因在病原菌中的传播起重要作用。因此,对耐药基因的存在给罗非鱼源无乳链球菌等细菌性疾病防控工作带来的风险必需引起高度重视。总之,建议加强罗非鱼源无乳链球菌的耐药性和耐药基因监测,以提高罗非鱼无乳链球菌病的防控效率,并为进一步阐明无乳链球菌耐药机制提供基础依据。
4 结论
广西罗非鱼源无乳链球菌对3种氨基糖苷类抗生素(庆大霉素、链霉素和新霉素)的耐药率均较高。源自南宁市、玉林市和柳州市的菌株对新霉素耐药率之间差异显著(P<0.05)。罗非鱼源无乳链球菌的氨基糖苷类耐药基因以ant(3')-I为主。链霉素耐药表型与ant(3')-I基因之间的符合率最高,其次为新霉素、庆大霉素及链霉素的耐药表型与aac(6')-Ib基因的符合率,新霉素耐药表型与aph(3')-Ia基因、新霉素及庆大霉素耐药表型与aac(3')-Ib基因的符合率最低。

