纳米TiO2分散液的制备及其光催化性能*
吴志娇,翟彦青,郭 瑞,曹宝升,朴玲钰†
(1 中国科学院纳米标准与检测重点实验室,中国科学院纳米科学卓越创新中心,国家纳米科学中心, 北京 100190; 2 北京石油化工学院化学工程学院, 北京 102617)
纳米二氧化钛(TiO2)由于尺寸的细微化,表现出独特的物理和化学特性,其在新能源(各类电池材料、氢能等)制备、环境保护(空气、水体与土壤的污染控制)、化工、医药、航空和军事等领域有着广阔的应用前景[1-7]。纳米TiO2具有高的光催化活性,在污水处理与抗菌等领域具有重要应用价值。TiO2有板钛矿、锐钛矿和金红石3种常见的晶型,其中锐钛矿TiO2在光催化等方面表现出优异的性能[8-9]。由于纳米TiO2大的比表面积与高的表面能,使小颗粒极易团聚形成带有若干弱连接界面的尺寸较大的团聚体,很难稳定分散在液体介质中,从而降低了TiO2分散液的稳定性与光催化活性,影响其实际应用[10-12]。因此,纳米TiO2的均匀分散是充分发挥其性能的前提,也是制备纳米材料的关键所在。

目前,主要通过在纳米TiO2表面进行无机/有机包覆,或加表面活性剂等手段来提高TiO2分散液的均匀性与稳定性[10-15]。无机或有机物的加入,削弱了纳米TiO2的光催化活性;同时增加了材料、过程与环保成本。因此,不加稳定剂制备均匀稳定的纳米TiO2分散液是该方向的难点。本工作采用沉淀-溶剂热联用的方法,制备粒径均匀的锐钛矿型纳米TiO2材料。在无修饰的情况下,通过超声得到分散均匀、稳定性好的锐钛矿型纳米TiO2水性分散液。该分散在室温静置180 d后,仍保持澄清透明,对有机污染物罗丹明B的降解仍旧表现出优异的光催化活性。喷涂该分散液的铝板也表现出良好的亲水性与自清洁能力。
1 实验部分
1.1 实验试剂和仪器
四氯化钛(TiCl4),氨水(NH3·H2O,25%~28%,西陇化工股份有限公司),无水乙醇(C2H5OH,北京市化学试剂厂),双氧水(H2O2,30%,北京化学试剂厂)。所用试剂均为分析纯,实验用水为去离子水。
D8 Focus 型X射线粉末衍射仪(XRD,德国布鲁克公司),Cu Kα辐射源,λ=0.154 06 nm;S-4800扫描电子显微镜(SEM,日本日立公司),扫描电压5 kV,T20透射电子显微镜(TEM,美国FEI公司),加速电压200 kV,Renishaw拉曼光谱分析仪(Renishaw,英国雷尼绍公司),激发波长514 nm;U-3900型UV-Vis漫反射光谱(DRS,Hitachi U-3900),积分球测试;Escalab 250Xi X射线光电子能谱仪(XPS,美国赛默飞公司)。
1.2 分散液的制备
1.2.1 纳米二氧化钛的制备
在冰水浴中配制浓度为0.2 mol/L的酸性TiCl4水溶液,将该溶液缓慢滴加至50 mL 0.5 mol/L的氨水溶液中,至体系pH为8.0,整个过程均需搅拌,滴加完毕后,继续搅拌30 min,得到白色乳状液,静置3 h。离心分离得到白色沉淀,用去离子水将其洗涤3次,超声分散在200 mL无水乙醇中,分为4等份,分别置于100 mL聚四氟乙烯内衬不锈钢高压反应釜中。将反应釜放置在鼓风干燥箱中150 ℃反应8 h。反应结束后冷却至室温,产物分别用去离子水和乙醇洗涤数次,-65 ℃下冷冻干燥得到白色粉末。
1.2.2 纳米二氧化钛分散液的制备
准确称量不同重量的纳米TiO2白色粉末,加到1 L去离子水中,超声20 min。在搅拌下,往上述体系中缓慢滴加微量的双氧水,至体系的pH为7.0,继续搅拌30 min,得到一定浓度的淡蓝色半透明的纳米TiO2分散液。
1.3 光催化降解实验
通过在紫外光照下罗丹明B溶液的降解反应,评价纳米TiO2分散液的光催化活性与稳定性。将0.5 mL 200 mg/L的罗丹明B水溶液加入到100 mL纳米TiO2分散液中,于暗处搅拌1 h以达到吸脱附平衡。之后进行紫外光(365 nm)照射。每隔15 min取样,8 000 r/min离心5 min后,取上层澄清溶液,以紫外分光光度计分析罗丹明B溶液浓度(对应于553 nm处的吸光度)。
1.4 稳定性实验
将制备的纳米TiO2分散液置于室温环境中,每隔一段时间对分散进行拍照,观察纳米TiO2颗粒的沉降情况。同时,取分散液进行光催化降解实验,考察其活性稳定性。
1.5 涂膜实验
将制备的纳米TiO2分散液喷涂在表面清洁的铝板上,经紫外光照射后,通过测试铝板表面接触角的变化,考察其表面的亲水性。喷涂装置为日常化妆用的小喷壶。单层膜制备:喷涂一次分散液,置于烘箱中80 ℃干燥20 min,自然冷却后,测试接触角;5层与10层膜制备:单层膜烘干,自然冷却后,喷涂第2层,然后重复喷涂至需要的层数。取1 mL浓度为25 mg/L的罗丹明B溶液滴加到喷涂有分散液与空白的铝板基底上,紫外光照下,考察铝板的自清洁能力。
2 结果与讨论
2.1 纳米TiO2的表征
2.1.1 晶体结构
图1(a)为纳米TiO2经冷冻干燥后的XRD图谱。由图可见,该样品的结晶性良好,所有衍射峰与锐钛矿TiO2的PDF卡片(JPCDS Card No. 21-1272)一致,表明其为锐钛矿相[16]。该样品的拉曼图谱见图1(b),位于144、399、515与639 cm-1的拉曼峰,分别归属于锐钛矿相TiO2的Eg、B1 g、A1 g与Eg峰。因此,拉曼结果进一步证实,分散液用纳米TiO2为纯的锐钛矿相。
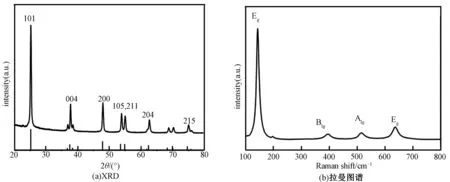
图1 纳米TiO2的XRD (a)与拉曼图谱(b)Fig.1 XRD patterns (a) and Raman spectra (b) of TiO2 sample
2.1.2 形貌
将分散液直接滴到电镜硅片或铜网上,自然晾干后,采用扫描电镜与透射电镜对分散液用纳米TiO2的形貌进行表征,测试结果见图2。明显看出,所制备纳米TiO2粒度均匀,分散良好。从TEM图统计得到,纳米TiO2的粒径约为(29±2) nm,粒径相对标准偏差小于8%,样品粒度的均一性良好。图2(c)为单个纳米TiO2颗粒的高分辨图,晶面间距0.35 nm归属于锐钛矿相TiO2的(101)晶面,表明所制备纳米TiO2为锐钛矿相的单晶颗粒。

图2 纳米TiO2的SEM(a)与TEM(b, c)图片Fig.2 SEM (a) and TEM (b,c) images of the TiO2 nanoparticles
2.1.3 表面分析
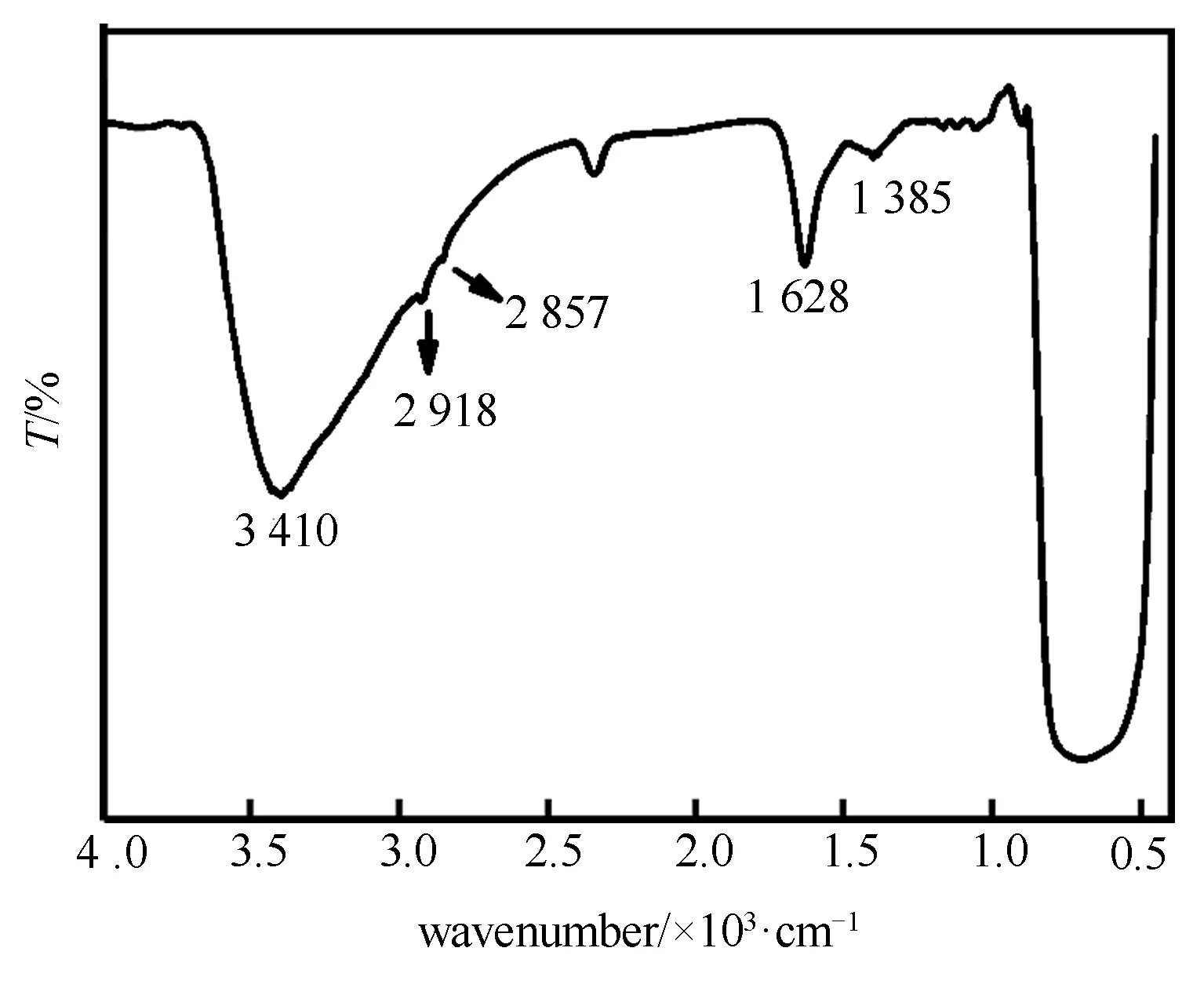
图3 纳米TiO2的红外图谱Fig.3 FT-IR spectra of the TiO2 nanoparticles
所制备纳米TiO2的红外光谱结果见图3。位于3 410 cm-1与1 628 cm-1处的振动峰分别归属于样品表面吸附的水分子中O—H的伸缩振动与弯曲振动。2 918 cm-1与2 857 cm-1处极弱的振动峰分别为C—H的非对称与对称伸缩振动峰,1 385 cm-1处为C—H的弯曲振动峰。可见,C—H的红外特征峰很弱。纳米TiO2在制备与后处理过程中,只有无水乙醇含有C—H键。因此,纳米TiO2表面残留的微量有机物为乙醇。
纳米TiO2的XPS图谱如图4所示。可看出,样品含有Ti、O、C这3种元素。其中C元素主要来自XPS测试时,环境中的污染C源,很少一部分为样品表面的微量乙醇。因此,结合红外结果可知,所制备的纳米TiO2表面处理较干净,纯度高,利于得到高催化活性的纳米TiO2分散液。
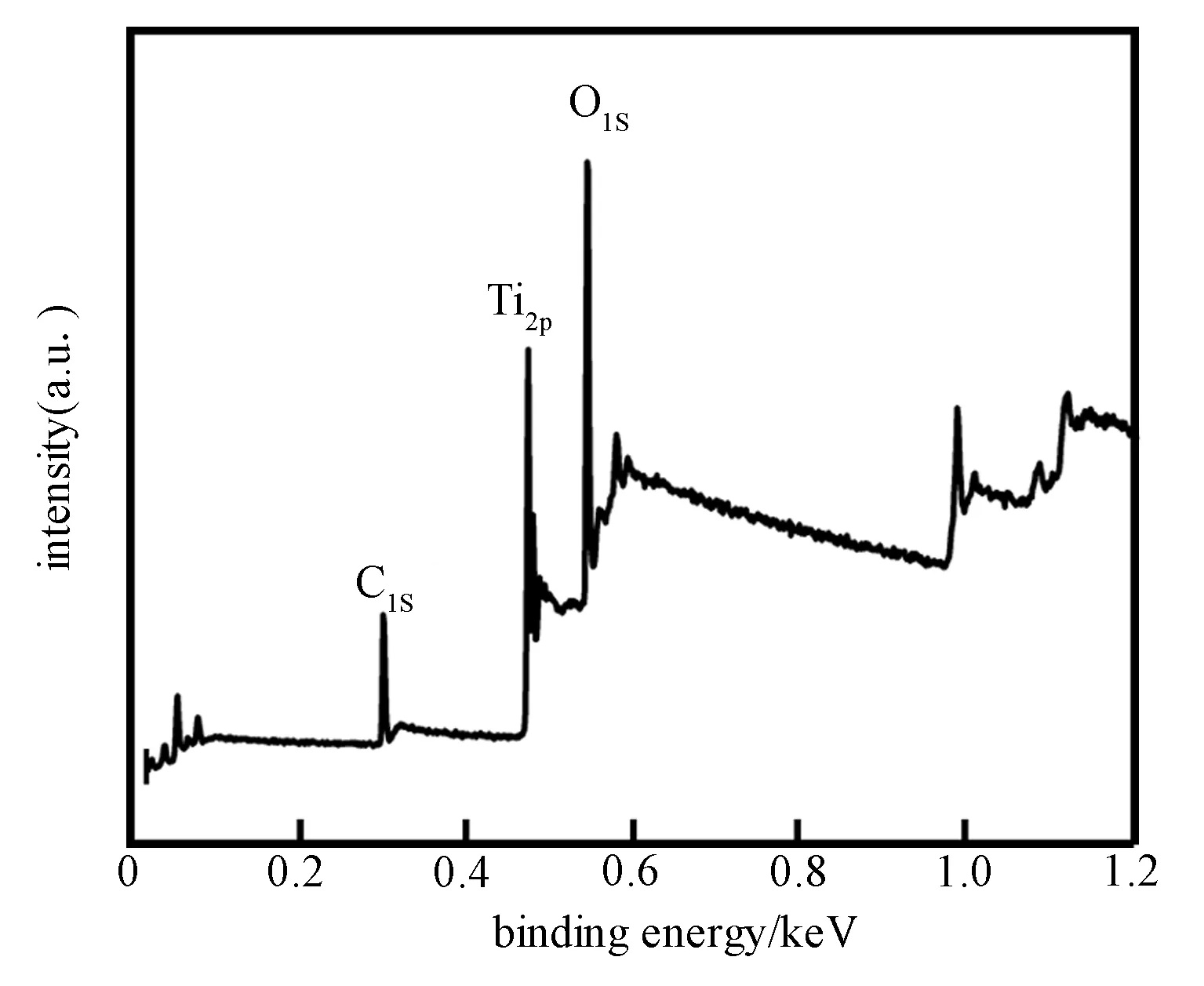
图4 纳米TiO2的XPS图谱Fig.4 XPS full survey spectra of the TiO2 nanoparticles
2.2 纳米TiO2分散液的光催化活性与稳定性
2.2.1 光催化活性
选取浓度分别为0.03、0.05与0.08 g/L的纳米TiO2分散液,加H2O2调节体系的pH为7.0,将其用于光催化降解罗丹明B,考察其催化活性。
图5为不同浓度的纳米TiO2分散液紫外光降解罗丹明B的曲线与照片。从图5(a)可看出,浓度为0.05与0.08 g/L的分散液对罗丹明B的降解在30 min之后即接近完成,表明二者具有很高的催化活性,且降解速率基本一致。0.03 g/L的分散液降解效率和速率稍弱。由图5(b)可知,3个浓度的分散液,在15 min时,罗丹明B明显褪色,30 min时,体系已由粉色变为无色,表明该纳米TiO2分散液具有高的光催化活性。上述结果表明,纳米TiO2的浓度对分散液的光催化活性有影响,浓度过低难以将罗丹明B降解完全。
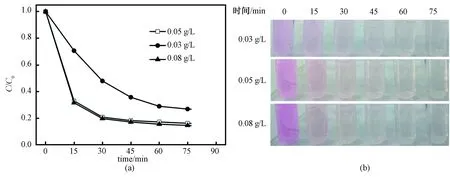
图5 不同浓度的纳米TiO2分散液紫外光降解罗丹明B曲线(a)与照片(b)Fig.5 Degradation curves (a) and photographs (b) of photocatalytic degradation of RhB in TiO2 dispersion solution with different concentrations

图6 不同催化剂紫外光降解罗丹明B曲线Fig.6 Degradation curves of RhB solution using different photocatalysts
为考察H2O2对该分散液光催化活性的影响,将与0.05 g/L分散液相同浓度的TiO2与H2O2分别作为催化剂在紫外光条件下降解相同浓度的罗丹明B溶液,实验结果如图6所示。可看出,TiO2与H2O2单独作为催化剂时,均可有效降解罗丹明B。当加入H2O2后,分散液的光催化活性明显提高。这是因为H2O2在紫外光照射下可以直接产生具有氧化性的OH·,且H2O2具有氧化性,是一种很好的电子受体,在光催化反应过程中可以捕获TiO2表面的光生电子,抑制光生电子与空穴的复合[17],从而提高分散液的光催化活性。因此,该分散液具有高的光催化活性与以下两个因素有关:1)纳米颗粒的高度分散,使纳米TiO2的光催化活性完全表现出来;2)体系中加入的微量双氧水,使体系的氧化性增强,同时抑制光生载流子的复合。
2.2.2 稳定性
选取浓度为0.05 g/L的分散液,考察纳米TiO2在分散液中的分散稳定性与活性稳定性。
浓度为0.05 g/L的纳米TiO2分散液放置不同时间的照片如图7所示。可看出,放置180 d后,该分散液仍呈半透明淡蓝色,且底部未见明显的TiO2沉淀,表明该分散液具有很好的分散稳定性。由于拍照时光线与角度未保持完全一致导致90 d时溶液颜色与0、28和180 d时溶液颜色稍有差别。该分散液的分散性与稳定性不受微量H2O2的影响。根据文献[18-19]报道,在TiO2的分散液中加入微量的H2O2,可以使体系变为黄色,因为H2O2与TiO2表面的羟基可以生成一种黄色的络合物,对TiO2起到敏化作用。在本分散液中加入微量H2O2后,分散液的颜色未发生变化,表明H2O2与TiO2表面的羟基形成了很少量的络合物。因此,H2O2对TiO2表面几乎没有修饰作用。图8(a)与8(b)分别为0.05 g/L的纳米TiO2分散液放置不同时间,在紫外光照射下,降解罗丹明B的曲线与照片。可见,该分散液的催化活性在180 d内没有随时间的延长而降低,表明其具有很好的活性稳定性,同时也进一步证实材料的分散稳定性。

图7 浓度为0.05 g/L的纳米TiO2分散液放置不同时间的照片Fig.7 Photographs of 0.05 g/L TiO2 dispersion solution aged for different days
2.3 表面自洁性能
纳米TiO2在紫外光照射下,表现出超亲水性。将其喷涂在基底上成膜,可以提高基底的亲水性与自清洁能力。本文在铝板上喷涂不同层数的0.05 g/L的纳米TiO2分散液,测试基底表面接触角随时间的变化,考察其自清洁能力。
固体表面的亲水性与接触角呈负相关关系,即接触角越小,亲水性越强。如图9所示,与光照前相比,光照5 h后,铝板的接触角大幅度减小,喷涂10层的样品更明显,接触角由84.1°减小到25.9°。当分散液喷涂层数较少时,铝板表面的纳米TiO2颗粒较少,未能将其表面紧密覆盖,光照后,接触角减小不明显。当喷涂层数较多时,纳米TiO2将铝板表面完全覆盖,光照后,接触角明显减小。
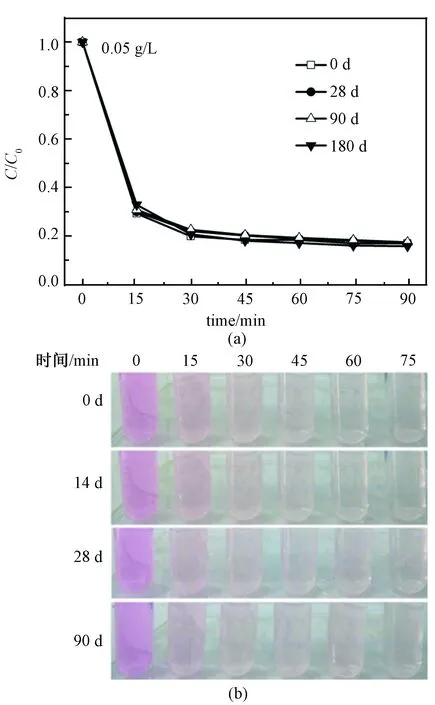
图8 纳米TiO2分散液放置不同时间后降解罗丹明B的曲线(a)与照片(b)Fig.8 Degradation curves (a) and photographs (b) of photocatalytic degradation of RhB in TiO2 dispersion solution aged for different days

图9 紫外光照前后喷涂分散液的铝板接触角的变化图Fig.9 Contact angles of aluminium plates sprayed with TiO2 dispersion solution before and after UV light irradiation
上述结果表明,喷涂分散液后,铝板表面由疏水转变为良好的亲水性。结合2.2节,该分散液具有很高的光催化活性,因此,经处理后的铝板具有良好的自清洁能力与光催化活性。
图10为放置60 d后,喷涂10层纳米TiO2分散液的铝板与空白板在紫外光照下,降解相同浓度罗丹明B的对照图片。可看出,光照20 min后,经处理的铝板表面的罗丹明B几乎完全褪色,而空白板上无明显变化。结果表明,喷涂分散液后的铝板具有很强的自清洁能力。
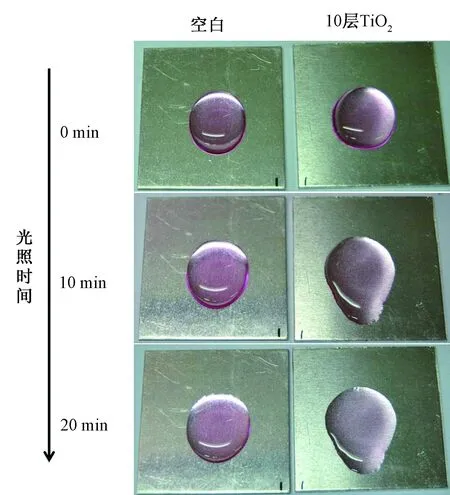
图10 喷涂分散液的铝板在紫外光照下降解罗丹明B的照片Fig.10 Photographs of photocatalytic degradation of RhB solution under UV light irradiation on aluminium plates before and after spraying TiO2 dispersion solution
3 结论
本文采用沉淀-溶剂热联用的方法,合成粒度均匀的锐钛矿型纳米TiO2材料。无表面修饰与稳定剂,将该材料超声分散在去离子水中,即可获得分散均匀、稳定性好、光催化活性高的锐钛矿型纳米TiO2水性分散液,放置180 d后仍表现出良好的分散稳定性与活性稳定性。铝板基底上喷涂该分散液后,表现出良好的亲水性与自清洁能力。

