交联酶聚集体性能改善研究进展
,,2,*, ,,,,
(1.贵州大学酿酒与食品工程学院,贵州贵阳 550025;2.贵州省农畜产品贮藏与加工重点实验室,贵州贵阳 550025;3.贵州大学化学与化工学院,贵州贵阳 550025)
酶是一种可再生能源,在温和条件下,以高区域选择性和立体选择性发生酶促反应,被广泛应用于食品、制药、化工等领域[1-2]。但在某些恶劣条件下,酶易变性和失活,这限制了它们的应用。因此,长期以来,人们都在不断努力开发有效的固定技术以增加酶的稳定性,并促进它们的回收和再循环。20世纪60年代,Doscher等[3]首次通过戊二醛与蛋白质表面上的反应性NH2基团反应产生了蛋白质交联技术。随后,该技术被用于结晶酶的交联以生产交联酶晶体(CLEC)[4]。但CLEC需要高纯度酶并使酶结晶,该过程费时费力。因此,Cao等[5]在此基础上通过沉淀酶代替结晶过程,并交联所得到的物理聚集体。从此,一种新型固定化酶技术产生-CLEAs技术。
CLEAs技术操作十分简单,仅需要经过沉淀和交联两步。在沉淀过程中,酶分子通过非共价键结合在一起发生沉降,该过程不会扰乱它们的三级结构。而交联主要是双功能交联剂通过在相邻酶分子表面上与赖氨酸残基的游离氨基发生反应,形成由分子间和分子内羟醛缩合产生的低聚物或聚合物,该过程涉及席夫碱形成和迈克尔型1,4加成到α,β-不饱和醛部分(图1)。因此,通过该技术制得的CLEAs能够很好地保留酶原始催化活性,并提高储存稳定性和操作稳定性[6-7]。被广泛应用于水解酶、氧化还原酶以及裂合酶等多种酶CLEAs制备中。同时,该技术还可用于制备催化多种生物转化的multi-CLEAs,这不仅避免了不稳定中间体的积累,还能减少二次不良反应[8-9]。
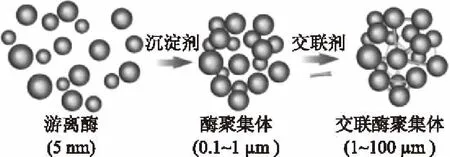
图1 交联酶聚集体(CLEAs)制备方法Fig.1 Cross-linked enzyme aggregates(CLEAs)preparation strategy
目前,CLEAs技术不断被用于不同种类和不同来源的酶固定化当中,而粒径、活力以及稳定性是评价CLEAs性能的重要指标。因此本文从粒径、改善CLEAs活力和提高稳定性等方面进行综述,以期对CLEAs的商业化生产提供一定的指导作用。
1 CLEAs的大小与形态
粒径是制备CLEAs的重要参数,它直接决定了CLEAs颗粒的尺寸[10]。合适的尺寸CLEAs不仅有利于产品的分离与回收利用,还能提供最佳的反应物表面积和扩散速度。通常,CLEAs的大小为1~100 μm,按形态分为I型、II型和簇[11-12]。I型CLEAs直径约为1 μm,如CAL-B,每个CLEA含有8×108个酶分子,呈现球形聚集体,它们主要由低糖基化酶和大疏水表面组成;II型CLEAs直径小于0.1 μm,由具有大亲水性表面和高糖基化水平的酶组成,这种类型的CLEAs中每个CLEA存在大约1×104个酶分子,呈不规则形状,且小于类型I;CLEAs可能形成较大尺寸(>1 μm)的聚集体,称为“簇”。簇的形成会存在传质限制,导致CLEAs内部的酶分子不能很好地与底物接触,降低CLEAs酶活。然而,CLEAs粒径过小又会使得酶分子过多地暴露于有机溶剂体系中,不利于酶活性。因此,有必要了解并控制CLEAs大小,为明确调控CLEAs结构和催化性能铺平道路。
2 粒径的调控方式
2.1 减少传质限制
在CLEAs制备中应减少“簇”的形成。增加搅拌速度和搅拌时间来减小CLEAs的大小是实现传质的增加和保留酶原始活性的常见方法。往复式细胞破碎机和涡流是常采用的减少“簇”传质限制的方式。涡旋搅拌90 min可以恢复80%的初始活性[13],使用往复式细胞破碎机则可以在30~60 s的处理时间内快速减少CLEAs的大小,从而恢复100%的活性。但在使用往复式细胞破碎机和涡流过程中应注意控制力度以免破坏CLEAs的内部结构。此外,CLEAs颗粒大小也会影响扩散速度,从而影响整个催化反应速率,需对交联剂/酶的比率进行适当调节。
2.2 调节pH
近年来,不少研究指出CLEAs粒径也可能会受到pH的影响,这主要与戊二醛(GA)的性质有关。在酸性pH下,水溶液中GA的分子量类似于GA单体的环状半缩醛,交联步骤中,这类分子发生的分子间相互作用是短而有序的;而在碱性pH下,GA倾向于聚合形态,这导致在酸性和碱性条件下进行交联反应得到的最终产物不同[14]。基于上述原理,人们可通过调节pH改变聚集体大小。Caballero等[15]研究了GA溶液pH对粒径影响,发现在pH4.5和pH9.5下使用GA制备CLEAs存在显著差异,表明GA溶液pH会对CLEAs结构产生影响,并且还发现这种结构变化对CLEAs活性也有显著影响(图2)。

图2 GA溶液pH4.5和9.5下制备的CLEAs光学显微镜照片[15]Fig.2 Optic microscopy photographs of cross-linked enzyme aggregates(CLEAs)using glutaraldehyde at pH4.5 and 9.5[15]注:a为用戊二醛在pH4.5,戊二醛浓度为35 mmol/L和酶/白蛋白比为15时制备的CLEAs;b为用戊二醛在pH9.5,戊二醛浓度为35 mmol/L和酶/白蛋白比为15时制备的CLEAs;图2右下方的蓝线表示100 μm的距离[15]。
2.3 选择交联方式
按沉淀与交联之间的时间段可将交联分为两种,一种是将使酶完全沉淀后或沉淀后放置一段时间再交联,也称后熟处理;另一种则是在沉淀过程中立即引入交联剂交联,这种操作能够节省时间和成本[16]。从交联机理上来说,两种交联方式的主要区别在于前者是聚集体颗粒表面被交联,而后者可能涉及到分子在聚集体内部进行交联。用新鲜(在沉淀后立即交联)与成熟(在4 ℃下存放7 d后交联)的青霉素酰化酶(PA)进行交联酶聚集体制备发现成熟的CLEAs比新鲜CLEAs的尺寸更大,表明聚集体的大小可以通过对PA的共价修饰程度来调节[17]。对于后熟处理而言,该过程涉及长时间的沉淀,可能导致酶活力下降。因此,在实验过程中需根据实际情况选择合适的交联方式。
2.4 调节沉淀剂浓度
沉淀剂浓度会改变聚集体表面的疏水/亲水残基数量发生变化。当沉淀剂浓度增加时,疏水残基随之增加,而疏水残基会倾向于产生1 μm的大孔洞,从而增加CLEAs粒径。反之亲水残基则会形成0.1 μm的小孔洞,由此影响CLEAs的大小。通过扫描电子显微镜发现高饱和度硫酸铵沉淀制得的CLEAs表面孔洞更多,粒径也更大[18]。
2.5 结合反胶团沉淀
将适量的水和表面活性剂溶于有机溶剂中,并使表面活性剂浓度超过临界胶束浓度可形成反胶束,该法可用于酶、蛋白质、核酸等生物活性物质的提取[19]。Chen等[20]首次从二氧化碳分散的反胶束溶液沉淀胰蛋白酶进行交联,获得了纳米级别的树状CLEAs(7~38 nm)(如图3)。这种方法通过改变水-表面活性剂比例(w0)和酶在反胶束溶液中的浓度使得CLEAs的直径发生变化,从而精确地控制它们的尺寸。与常规方法相比,此方法制备的CLEAs具有更高活性。

图3 CO2分散反胶束溶液制备交联酶聚集体(CLEAs)的TEM照片[20]Fig.3 TEM photographs of cross-linked enzyme aggregates(CLEAs)from the CO2-expanded reverse micellar solutions[20]注:a表示w0=20,胰蛋白酶0.5 mg/mL;表示bw0=40,胰蛋白酶0.5 mg/mL;c表示w0=40,胰蛋白酶1.0 mg/mL[20]。
CLEAs的粒径不仅影响其微观结构,同时也与酶活性相关。有研究报道了五种纳米粒子(NPs)(纳米TiO2,纳米MgO,纳米Ni,纳米Cu和纳米Fe3O4)对CLEAs活性和结构的影响,其中添加纳米TiO2会使CLEAs颗粒尺寸更小并产生更多的通道,这种结构的改变使CLEAs的Km降低和Vmax增加,从而有利于CLEAs活性。而对于其他四种NPs而言,它们的加入不能形成较多的无定形空腔,反而产生更大或更离散的粒径,因此CLEAs活性降低[12]。然而,如何精确控制CLEAs的大小实现酶尺寸的定制,目前仍然处于研究阶段。
3 改善CLEAs活力的因素
CLEAs活力是评价交联酶聚集体性能的重要指标,除上述提到的粒径影响因素外,CLEAs活力还受沉淀剂、交联剂、酶浓度以及添加剂等多种因素的影响。
3.1 沉淀剂
不同的酶组成的氨基酸序列不同,故采用不同的沉淀剂进行沉淀存在差异[21],因此制备的CLEAs活性也会有所差异。Devi等[22]研究了四种类型的沉淀剂对南极假丝酵母脂肪酶B(CAL-B)CLEAs的影响,发现PEG和饱和硫酸铵沉淀的CLEAs具有优良的活性。脂肪酶CLEAs活性回收率会随沉淀剂类型和酶来源而发生变化,这是由于不同微生物来源的脂肪酶糖基化表面不同,使用不同的沉淀试剂会形成不同的聚集、包装和配置蛋白质分子[22-23]。此外,有机溶剂作沉淀剂可能会除去蛋白质表面的水分,导致酶活性降低。有研究[24]提出通过添加葡萄糖、海藻糖和蔗糖物质来辅助沉淀可增强CLEAs在有机溶剂沉淀下的稳定性。最佳沉淀剂并不一定会制备出最佳CLEAs,因为最佳沉淀剂并不意味着能诱导出更有利于酶活性的构象[1]。
3.2 交联剂
目前,CLEAs中最常使用的交联剂是GA,因其易商业获得被广泛用于水解酶、氧化酶、裂解酶等CLEAs制备。但大量研究发现使用GA作交联剂并不总能获得理想的效果。因此有必要研究开发其他交联剂。
3.2.1 新型交联剂的开发 Talekar等[25]最早提出用果胶作交联剂,这种高度生物相容的自然多糖在高碘酸盐介导的氧化作用下能在单体单元的C2和C3键处被特异性切割,形成两个反应性醛基,这些生成的二醛基团对赖氨酸残基中的氨基特别活泼,可形成席夫碱,从而替代GA成为一种可再生且无毒的交联剂[26]。一些温和的交联剂如乙二醇-双[琥珀酸N-羟基琥珀酰亚胺](EG-NHS)可以取代GA制备青霉菌脂肪酶CLEAs,该交联剂主要通过N-羟基琥珀酰亚胺酯形成稳定的酰胺键来交联蛋白质,制得的EG-NHS聚集体较戊二醛具有更优异的水解和酯化活性[13,27](图4)。有研究[28]表明CAL-B-CLEA的热稳定性对所用双环氧化物的交联度及链长度具有很强的依赖性。苯醌也被报道用作交联剂,且在50 ℃条件下90 min的热稳定性比用GA制备的CLEAs高5倍[29]。对于一些酶而言,小分子的交联剂可能会进入蛋白质内部破坏其三级结构,导致酶活性完全丧失,因此不少研究致力于开发葡聚糖和壳聚糖等大分子制备交联酶聚集体[30-31]。

图4 蛋白质(a)经由戊二醛的和(b)乙二醇双[琥珀酸N-羟基琥珀酰亚胺]交联Fig.4 Crosslinking of proteins(a)via Glutaraldehyde and(b)Ethylene glycolbis[succinimidylsuccinate]
3.2.2 交联剂浓度与交联时间的控制 交联剂浓度与交联时间会影响CLEAs活性和稳定性。Majumder等[32]用三种不同浓度(10、40、60 mmol/L)的GA生产CLEAs时发现较高交联度下热稳定性增加;但是活性和对映选择性受损,这是因为CLEAs的形态受交联度的影响,浓度增加会引起分子刚性程度增大,导致催化活性降低。而交联时间对CLEAs活性的影响主要在于长时间的交联会产生交联过度、粒径增大、酶活性被掩盖等问题,而交联时间过短,则交联不足,导致CLEAs在浸入水中时过于柔软且不稳定[33]。因此,在CLEAs制备中,应选择适宜的交联剂浓度并合理控制交联时间,以提高CLEAs的活力。
3.3 酶浓度
酶浓度也是影响CLEAs活性的重要因素。有研究发现在一定的酶浓度(10~40 mg/mL)范围内荧光假单胞菌脂肪酶CLEAs的活性会随着酶浓度的增加而增加,这是由于酶浓度的增加会有更多的酶分子被固定[34]。但酶浓度过高会使CLEAs颗粒增大,导致酶的活性中心与底物分子接触受阻,同时还会降低反应体系中的水分含量使酶分子变性失活。因此,在酶浓度可调节的情况下,应对酶浓度加以选择,以制备较高活力的CLEAs。
3.4 添加剂
孙立梅[35],Bashir F[36]等研究表明在蛋白质浓度低的酶制剂中添加牛血清白蛋白可以促进CLEAs形成,这可能涉及到BSA可以提供更多的赖氨酸基团。在CLEAs中添加表面活性剂SDS或庚烷会增加酶的表面积,因为庚烷和疏水性分子可以使CLEAs周围的水分子重新排列,同SDS一样起到界面活化作用,使活性位点增加,给予底物提供更好的附着机会[37]。覆盖酶活性位点的盖子可在各种印记分子存在的界面处开启,因此在CLEAs制备中可通过添加油酸印迹增加酶表面残基之间静电和氢键的相互作用[38],对于酶分子表面含有少量或不含赖氨酸残基导致交联不足产生CLEAs不稳定和活力低的现象,可添加伯氨基的聚合物,如聚赖氨酸和聚乙烯亚胺来解决这一问题,同时后者可形成带正电荷的微环境,能够阻止有机溶剂与蛋白质之间的接触,从而提高CLEAs稳定性[39]。Triton X-100的加入会增加倾向于形成二聚体的脂肪酶的活性,例如棉状嗜热丝孢菌(TLL),而CAL-B几乎不受Triton X-100存在的影响[40]。表面活性剂和冠醚对脂肪酶有活化作用,这通常归因于诱导酶产生了更有利于活性的构象。添加剂不与酶共价结合,因此可以使用合适的有机溶剂将其从CLEAs中轻松冲洗出来,从而使固定化酶保持有利的催化构象[41]。
4 增强CLEA稳定性的策略
4.1 调节实验参数
大量研究表明CLEAs固定化能够提高酶的稳定性。但是在不同的商业应用中对CLEAs的稳定性要求存在差异,故需适时做出调整。一般来说,分子间和分子内共价键的数量越多,热稳定性越强。即可通过增加酶的刚性程度来提高稳定性。因此在CLEAs制备期间,可以通过调节交联时间,交联剂浓度和交联剂等实验参数来提高CLEAs稳定性。Kopp等[42]以叔丁醇做沉淀制备青霉素G酰基转移酶CLEAs,其热稳定性高于DME和PEG,董涛等[43]在制备氨基酰化酶交联聚集体选用叔丁醇做沉淀也得到了类似的结果。此外,在CLEAs制备过程中加入带电聚合物聚乙烯亚胺(PEI)可增强CLEAs的稳定性,Pan等[44]使用PEI作为共沉淀剂制备粘质沙雷氏菌粘附分枝杆菌脂肪酶与聚乙烯亚胺(CLECAs-SML-PEI)的交联酶共聚集体,发现热稳定性有显著提高。
4.2 氨基酸改善
目前,有研究提出在交联过程中加入适当的氨基酸可使交联酶聚集体更稳定,因为当游离氨基酸与蛋白质共存时,氨基酸可通过-NH2或胍基与蛋白质形成交联,此过程还涉及电荷改变,如加入Arg可以使蛋白质聚集体带上一个负电荷,而Asp则会使蛋白质聚集体带上多个负电荷[45]。而且每个氨基酸的加入都会在不同程度上增加侧链中的-(CH2)n,而戊二醛在溶液中也会形成-(CH2)n,导致同时交联[46]。Mukherjee等[47]研究了Arg,Lys,Ala,Asp对几种脂肪酶的影响,发现在形成CLEAs期间添加氨基酸能使生物催化剂更稳定。然而,不同的蛋白质的疏水化和亲水化存在差异,且在某些情况下交联可能是通过胍基而不是Lys形成[44-48],因此对不同来源和类型的酶在CLEAs制备中,我们应据实际情况选择合适的氨基酸来进行化学修饰。
4.3 结合其他固定化技术制备CLEAs
4.3.1 分子筛载体CLEAs制备 在聚合物或基质中对CLEAs进行包封能够增加其稳定性。Wilson等[44]将青霉素酰基转移酶CLEAs包封在聚乙烯醇水凝胶内能够显著提高稳定性。采用先吸附后交联的方法可在二氧化硅基质的内孔中制备胰凝乳蛋白酶和爪哇毛霉脂肪酶CLEAs,这些37 nm小孔通过直径为13 nm的通道连接,使得CLEAs不能通过该通道并保留在毛孔中。并且为防止载体CLEAs的浸出和抑制糜蛋白酶自溶,该实验在200 r/min下搅拌2周以研究CLEAs的稳定性,发现酶活基本没有降低[49]。国内也有研究报道了将CLEAs与氨基化硅胶共价交联来提高CLEAs的重复使用性和储藏稳定性[50]。黎克纯等[51]使用大孔的菲环骨架为载体固定交联淀粉酶聚集体,使其热稳定性和储存稳定性都显著提高,而且在重复反应7批次后,相对活性仍保留63.29%。
4.3.2 磁性CLEAs制备 将CLEAs用二氧化硅包埋后交联到磁珠上可提高稳定性[52]。最近,国内有研究者采用无官能修饰的纳米Fe3O4制备出了磁性纳米交联酶聚集体(M-CLEAs),并将其用于微管式反应器中实现了油酸丁酯合成和柴油废水降解[53]。Nadar[54]等采用果胶作交联剂将葡糖淀粉酶固定在3-氨基丙基三乙氧基硅烷(APTES)上形成磁性纳米颗粒。鼠李糖吡喃糖苷酶磁性交联酶聚集体(mCLEAs)的开发在糖类化合物生产中具有重要作用,且在微型填充床生物反应器中,mCLEAs最大体积生产力可达到140 μmol/L·h[55]。此外,磁性CLEA也被用于Combi-CLEAs的制备中并成为当下研究的主要热点之一,因为磁性Combi-CLEAs不仅具备一个强大的生物转化系统,而且很好的解决了Combi-CLEAs不易复原的问题,使其成为工业生物催化工具的新选择[56]。
5 结论与展望
CLEAs技术广泛应用在食品、制药、化工等领域。其固定化酶具有许多优点:制备简单,优化速度快,且能以粗酶为原料而无需纯化,CLEAs大都呈现出较好的热稳定性和有机溶剂的耐受性;同时该技术适用于制备含有两种或多种酶的Combi-CLEAs,可以有利地用于催化级联过程。在微通道反应器中使用CLEAs具有明显的快速筛选和优化的潜力。然而,目前大多数研究仍集中于CLEAs的制备和现象描述,因此,在此基础上提出以下几点建议:a.开发并探究新的交联剂,实现酶活力稳定性的进一步改善和各种交联酶聚集体的开发;b.对CLEAs技术影响酶催化效率的深层机理进行探究,实现从现象描述到深层机理的研究;c.建立包含各种酶及与之对应的沉淀剂、交联剂,添加剂等各因素的数据库,为减少优化和精确调控各因素实现CLEAs定制提供快速、充分、可靠的技术平台支持。

