太湖流域湖荡湿地有色溶解有机物特征分布与来源解析
王 青, 潘继征, 吴晓东, 马书占, 陈丙法
(1.中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,江苏南京 210008; 2.中国科学院大学,北京 100049; 3.湖北师范大学城市与环境学院,湖北黄石 435002)
有色溶解有机物(CDOM)是水中含有腐殖酸、富里酸、氨基酸和芳香烃聚合物等物质的一类可溶性有机物,是水体中溶解有机物的重要组成部分[1]。由于有色溶解有机物在可见光和紫外光区有吸收作用,其浓度和成分变化对水下光强及初级生产力有重要影响。一方面有色溶解有机物能吸收有害紫外辐射,保护水生生物并通过光漂白作用将有机大分子分解成小分子物质给水生生物利用;另一方面,水体中CDOM含量过高不利于阳光穿透水体,降低水体初级生产力[2-3]。同时,CDOM还影响着化学反应物的形成和金属物质的迁移[4]。近年来,新兴的三维荧光光谱(EEMs)荧光分析技术以操作简单、灵敏度高和选择性好等优点被广泛应用于CDOM的研究分析中。平行因子法(PARAFAC)因具有解析CDOM的EEMs图谱,定性、定量描述CDOM的组分特征等优势,已被广泛运用到水环境CDOM荧光特性描述、来源解析等研究中[5-6]。程庆霖等利用平行因子法揭示了滇池有色溶解有机物组分分布特征[7]。Kowalczuk等采用PARAFAC解析了南大西洋海域CDOM组分,鉴别出3种陆源类腐殖质、1种海源类腐殖质和2种类蛋白物质[8]。
太湖流域是长三角的核心区域,流域内湖荡湿地密布。湖荡湿地作为河-湖水系联接的关键节点,不仅有重要的社会经济功能,对太湖流域污染物拦截、净化水质和维护太湖生态系统健康具有重要作用,是太湖流域控源减负、“一湖四圈”生态修复的重要一环[9]。Dong等对长江中下游16个湖泊进行研究,结果表明湖泊尺度与有机碳的累积速率成反比,小型湖荡湿地在水质改善方面的作用应当得到重视[10]。目前太湖流域多数湖荡湿地面临许多生态问题,例如水体污染负荷水平较高,富营养化趋势加剧和生态退化严重。CDOM是影响湖荡湿地水体光照的重要因子之一。近年来,张运林等通过野外和室内试验研究了藻类降解对太湖CDOM的贡献,同时对中营养湖泊天目湖进行了研究,识别出类腐殖质及类蛋白质组分[11-12]。刘明亮等研究了2007年夏季太湖入湖河口和大太湖开敞区CDOM浓度及来源[13]。黄昌春等基于三维荧光和平行因子法研究了太湖水体CDOM组分光学特征[14]。王书航等研究了蠡湖CDOM的分布及来源,发现水体中CDOM主要是类色氨酸和类腐殖质2个荧光组分[15]。综上所述,对太湖流域水体中CDOM的研究已有一定的基础,但对湖荡CDOM整体分布及来源解析还缺乏系统研究。因此,本研究选取太湖流域不同营养水平的代表性湖荡作为研究对象,运用PARAFAC解析EEMs图谱,结合水质参数分布情况,揭示太湖流域湖荡湿地CDOM的分布特征及来源,以期为太湖流域湖荡湿地的污染生态修复提供基础资料和理论依据。
1 材料与方法
1.1 研究区域
太湖流域湖荡湿地(30°28′~32°15′N、119°11′~121°53′E)位于长江三角洲南缘,整个流域三面濒江临海。太湖流域水网纵横,湖荡众多。整个流域总面积约为735 km2,大于 0.5 km2的湖荡有189个,占流域平原面积的10.7%。太湖流域湖荡湿地具有重要的社会经济功能,历来具有养殖、航运、灌溉等基本功能,近年来,随着旅游业的兴起,湖荡湿地周围旅游资源也相继得到开发。
1.2 采样点设置
选取不同区域、不同营养水平的10个湖荡,分别为滆湖、长荡湖、尚湖、昆承湖、阳澄湖、傀儡湖、澄湖、淀山湖、元荡和宜兴三氿,共设置41个采样点。采样点位分布见图1、表1。

表1 湖荡面积、平均水深和采样点编号
1.3 样品采集与分析
1.3.1 水质指标分析 于2015年秋季对太湖流域代表性湖荡41个样点进行采集,用有机玻璃采水器采集表层(水下 0.5 m)样品,装入1 L聚乙烯塑料瓶中,置于带有冰盒的保温箱中立即运回实验室进行各项指标的分析测定。透明度(SD)用塞式透明度盘测定,水深(h)用水深测度仪测定。总氮(TN)浓度、总磷(TP)浓度、高锰酸盐指数(CODMn)及叶绿素a浓度测定方法均参照文献[16]。
1.3.2 溶解性有机物指标分析
1.3.2.1 可溶性有机物(DOC)浓度测定 水样经GF/F滤膜(玻璃纤维滤膜)(预先450 ℃灼烧4 h)过滤,滤液用总有机碳测定仪(TOC5000A,岛津)测定DOC浓度,仪器检测限为 0.004 mg/L,标准偏差<2%。
1.3.2.2 紫外可见光谱扫描及吸收系数计算 水样经GF/F膜过滤后再经0.22 μm Millipore膜(混合纤维素酯微孔膜)过滤,用于测定CDOM吸收及三维荧光光谱。将过滤后水样置于1 cm石英比色皿中,以Milli-Q超纯水作为参考水样,采用可见紫外分光光度计(UV2700,岛津)于200~800 nm波长范围进行光谱扫描,扫描间距0.5 nm。为了消除过滤清液中残留细小颗粒物的散射,利用700~800 nm波段吸收系数的均值进行散射效应订正,已校正反射效应以及仪器基线的漂移等因素。利用公式(1)计算CDOM各个吸收波段光谱吸收系数:
a(λ)=2.303×D(λ)/r。
(1)
式中:a(λ)为波长λ的吸收系数(m-1);D(λ)为吸光度;r为光程路径(m)。
1.3.2.3 三维荧光光谱扫描 采用HitachiF-7000型荧光分光光度计测定三维荧光光谱,仪器光源为150 W氙灯,光电倍增管电压700 V,激发(Ex)和发射(Em)单色器均为衍射光栅,波长误差±2 nm,激发波长为350 nm时水的拉曼峰信躁比S/N>250(P-P)。激发和发射狭缝宽度均为5 nm,扫描波长范围λEx为200~450 nm,λEm为250~600 nm,步长 5 nm,扫描速度2 400 nm/min。通过内置FL Sloutions 2.1软件减去超纯水消除水拉曼散射。
1.3.3 营养状态指数 基于总氮(TN)浓度、总磷(TP)浓度、高锰酸盐指数(CODMn)、叶绿素a浓度及透明度(SD)5个水质参数指标分别计算调查湖荡综合营养状态(TLI)指数,计算公式:
TLI(∑)=∑Wj·TLI(j)。
(2)
式中:TLI(j)代表第j种参数的营养状态指数。富营养化程度分级标准为TLI(∑)<30为贫营养、30≤TLI(∑)≤50为中营养、50
1.4 数据处理
运用Matlab2010a软件和drEEM_010数据包对EEMs数据进行PARAFAC处理,采用ArcGis软件对采样点位分布图进行绘制,采用SPSS 22软件对数据进行统计分析,采用Origin 9.0软件对数据作图。
2 结果与分析
2.1 营养盐水平
太湖流域湖荡湿地营养盐水平差异大。调查湖荡中TP浓度最低为尚湖,其值为0.028±0.003 5 mg/L,最高为宜兴三氿,其值为0.192±0.008 1 mg/L。TN浓度较低为尚湖和昆承湖,较高为宜兴三氿和滆湖。而CODMn浓度较低的分别为尚湖[(3.78±0.17) mg/L]、滆湖[(3.83±0.42) mg/L]与傀儡湖[(3.88±0.08) mg/L];DOC较低的湖荡分别为滆湖[(4.42±0.24) mg/L]、尚湖[(4.55±0.41) mg/L]和傀儡湖[(5.24±2.5) mg/L]。TP、TN、CODMn和DOC分布存在显著的空间差异(P<0.05)(图2)。
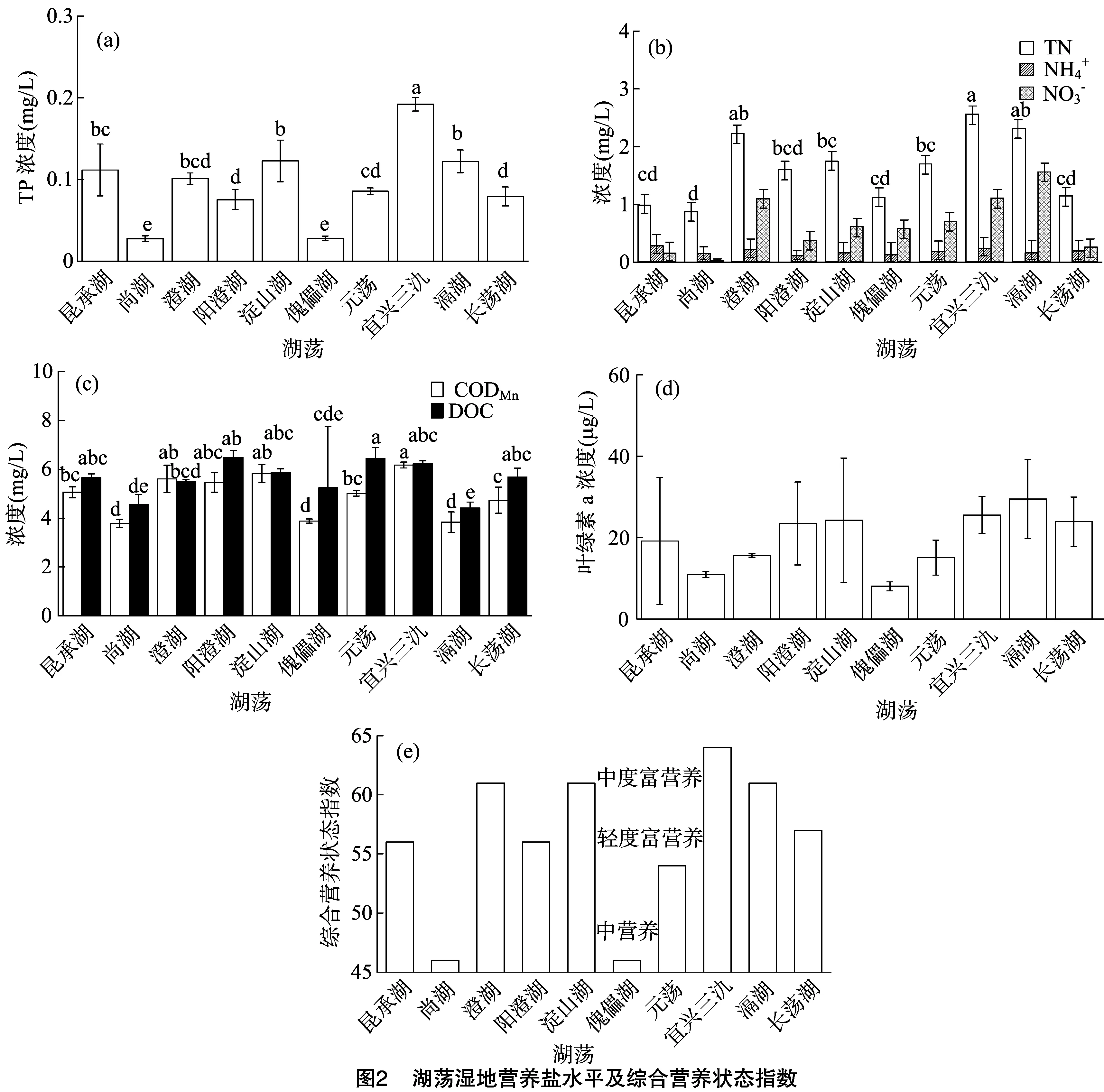
尚湖与傀儡湖水质较好,总体为Ⅱ~Ⅲ类,水生植物发育良好,综合营养状态指数均为46,属于中营养水平;昆承湖、元荡、阳澄湖、长荡湖TLI指数分别为56、54、56、57,属于轻度富营养,水质属于Ⅳ~Ⅴ类水平;澄湖、淀山湖、宜兴三氿和滆湖TLI指数分别是61、61、64和61,属于中度富营养,其中淀山湖为Ⅴ类水平,其余湖荡为劣Ⅴ类水平且均是由于TN含量超标(图2-e)。与已有研究结果相比,长荡湖水质状态有较大提升,总体由中度富营养化转变为轻度富营养,说明对长荡湖近年来采取的围网拆除、污染控制、生态修复等一系列治理措施对水质有显著改善,其余湖荡整体富营养水平并无太大波动[17-20]。
2.2 CDOM吸收特征与空间分布
CDOM结构较为复杂,通常以a(350)表征其浓度,也有用a(280)表征[21]。调查湖荡CDOM吸收系数a(280)、a(350)均值分别为(14.26±3.04)、(3.38±0.81) m-1,变化范围为(9.00~18.80)、(1.76~4.49) m-1(表2)。与已有文献报道的太湖[22]、天目湖[23]、东平湖[24]等相比,调查湖荡的CDOM吸收系数处于正常的淡水湖泊CDOM吸收系数范围内,尚湖与傀儡湖CDOM吸收系数与水质较好的中营养湖泊天目湖[18]、梁子湖[25]取值范围相近,其余湖荡CDOM吸收系数与水质较差的洪湖、东湖[25]相似,低于太湖梅梁湾地区[22]。吸收系数a(350)与TLI指数相关性显著(P<0.05),CDOM吸收系数在一定程度上也反映了湖荡的营养状况。

表2 太湖流域湖荡CDOM吸收系数
太湖流域湖荡湿地CDOM的吸收系数存在显著的空间差异(P<0.05),a(350)较低的湖荡为尚湖与傀儡湖,吸收系数值分别为(1.76±0.53)、(2.52±0.95) m-1,显著低于其他湖荡(P<0.05)。尚湖和傀儡湖水质较好,水生植物发育良好,处于中营养状态。a(350)最高的湖荡为宜兴三氿,均值为 (4.49±0.17) m-1,可能与宜兴三氿是城市湖荡,水质较差,水生植被较少有关。从单一湖荡吸收系数空间分布上看,长荡湖高值分布在西北部湖区和东北部湖区,峰值 3.561 m-1出现在位于西北部34#点。滆湖呈现出明显由北向南递减趋势,其峰值出现在北部湖区25#点(图3)。轻度富营养湖荡与中度富营养湖荡间a(350)并无差异性(P>0.05)。通过点绘a(280)与a(350)的关系,两者呈显著正相关关系(r2=0.902,P<0.001)。
研究表明,CDOM吸收系数与DOC浓度呈正相关关系,利用CDOM的吸收系数可以示踪DOC浓度的变化[26]。CDOM吸收系数与CODMn、DOC分布规律相似。对调查湖荡a(350)与CODMn、DOC浓度进行回归分析,由式(3)(4)可知它们之间存在显著性正相关关系(P<0.01),说明三者均可作为反映水体有机污染程度的参数。
CODMn=0.794(±0.141)a(350)+2.199(±0.487)(r2=0.46,P<0.001,n=41);
(3)
DOC=0.939(±0.131)a(350)+2.437±(0.450)(r2=0.59,P<0.001,n=41)。
(4)
2.3 CDOM三维荧光特征分析
运用PARAFAC,将41个样品三维荧光数据(EEMs)分解,得到3个荧光组分(图4)。组分C1激发波长为250 nm,发射波长为430 nm,对应类腐殖质A峰(230~260、380~460 nm)[27],对比其他研究结果可确定为紫外光类腐殖质,反映的是腐殖质和富里酸形成的荧光峰[21]。组分C2与组分C3较为接近,似内源类蛋白物质,组分C2激发波长与发射波长分别为265、305 nm,对应类蛋白B峰(275、305~310 nm)[27],结合已有研究结果将组分C2确定为类酪氨酸[6,28-29]。组分C3激发波长为280 nm,发射波长为330 nm,对应T峰(280、320~350 nm),反映的是类色氨酸物质所形成的荧光峰,主要是受浮游植物或水生细菌等生物降解的影响[5,30-31](表3)。



表3 三维荧光组分特征
从不同湖荡之间比较来看,3个组分的CDOM荧光强度之和Fmax值有显著差异性,尚湖、昆承湖、长荡湖、阳澄湖、淀山湖Fmax值高于其他湖荡,分别为(20.48±2.28)、8.88、(5.17±5.28)、(4.53±3.77)、(2.87±0.88) RU。其他湖荡Fmax均小于 2 RU(图5-a)。
太湖流域典型湖荡外源(C1)与内源(C2、C3)对CDOM贡献率具有差异性,尚湖外源和内源贡献率分别为2.53%和97.47%,可能是与调查期间尚湖湖区内苦草过多,人工清理过程中造成大量苦草断裂腐烂降解有关。其余湖荡内源贡献率分别为昆承湖(95.77%)>阳澄湖(88.62%)>澄湖(86.96%)>宜兴三氿(81.34%)>长荡湖(80.77%)>淀山湖(79.51%)>傀儡湖(77.43%)>元荡(75.81%)>滆湖(68.44%)(图5-b)。由此可知,调查湖荡CDOM组成内源物质占主导地位。而滆湖和长荡湖湖区外源和内源对CDOM贡献率有所差异,滆湖南部湖区采样点外源物质对CDOM贡献率接近50%,大多数湖泊CDOM外源输入以地表径流为主,滆湖入湖河流西进东出,类腐殖质荧光组分C1由西向东表现出降低趋势,内源组分荧光强度变化规律则相反,使得湖区西部外源输入对CDOM组成影响较大,总体而言,滆湖CDOM组成偏内源物质主导。长荡湖外源物质C1对CDOM贡献率范围在2.93%~40.24%之间,各采样点组分C1荧光强度并无差异性。长荡湖依赖地表径流和降雨补水,主要入湖河流为西侧的蛋金溧漕河和北河,东部为出湖河流[18]。入湖区域营养盐水平略高于其他区域,氮、磷输入使得水体生物代谢迅速,微生物或藻类代谢产物增多,湖区南部和东部内源物质荧光强度高于入湖区域,进一步说明荧光组分C2和C3主要来源于自生微生物、藻类的自生源,而对CDOM贡献较少的C1可能是入湖河流及两岸的陆源输入。通过点绘组分C2与组分C3荧光强度关系,发现二者为极显著正相关关系(r2=0.996,P<0.001),说明湖荡内源蛋白物质组成相似,来源一致(图5-c)。
对CDOM贡献率较大的荧光组分C2、C3均与TP浓度呈显著正相关关系,说明CDOM与P元素的迁移转化密切相关,这与蠡湖结论[15]一致。荧光组分C1与叶绿素a浓度呈负相关(P<0.05),代表内源输入的组分C2与C3与之均未达到显著水平。而将滆湖单独进行相关性分析发现荧光组分C2、C3均与叶绿素浓度显示出极好的相关性。这可能是由于秋季是水生植物衰亡时期,内源组分受水生植物腐烂影响,尤其是水生植物发育良好的尚湖和傀儡湖;而滆湖水生植被盖度低,2009年沉水植物覆盖度不足全湖的1%[32],2010年后,通过滆湖生态修复的开展,水生植被覆盖度略有提高,但沉水植被覆盖度依然不足1%,滆湖荧光组分C2与C3可能主要受浮游植物影响。
2.4 CDOM来源的辨识
CDOM来源可按陆源和生物源进行区分。陆源多表现为类腐殖质占主要优势;生物源表现为类蛋白物质峰占优势。生物指数(BIX)是指在激发波长为310 nm时,发射波长 380 nm 和430 nm处荧光强度的比值,可用于估计内源物质对水体中CDOM的相对贡献,反映内源生物活性,在0.8~1.0 之间时,具有较强自生源特征;大于1.0时是生物细菌活动产生[33]。本次调查湖荡中长荡湖BIX范围为0.94~0.99,具有较强的自生源特征,其余湖荡BIX指数均大于1.0(图6),说明湖荡CDOM由生物细菌活动产生。腐殖化指数(HIX)是指在激发波长为254 nm时,发射波长在435~480 nm 与300~345 nm 波段内的荧光强度平均值的比率,该指数可用于估算有机质的腐殖化程度或成熟度[33]。本次调查中采样点HIX指数范围在0.10~2.02之间,除长荡湖外各湖荡腐殖化指数均小于1.5,长荡湖HIX指数均值为1.71(图6)。按Huguet等提出的HIX溯源指标体系评判,所有湖荡CDOM主要由生物活动产生,腐殖化程度较弱(HIX<4)[33];而Zhang等提出的标准则是1.5 荧光指数(FI)是在激发光波长为370 nm时,荧光发射光谱强度在450、500 nm处的比值,该指数可用来研究和表征CDOM中腐殖质的来源,大于1.9说明主要来源于微生物代谢过程,小于1.4说明陆源占主要贡献[34]。本次研究中荧光指数均在1.4左右(图6),与BIX、HIX表征CDOM荧光特性得到的结果不一致,有研究指出荧光指数对腐殖质来源的指示不太敏感[35]。除了以上3个指标可以表征CDOM荧光特性外,还可以用CDOM中类蛋白组分的荧光强度与类腐殖质的荧光强度的比值来判断水体中CDOM的来源[36-37]。一般认为,比值大于1说明自身源占主要优势。本次调查湖荡中,C2、C3与C1的比值在1.07~42.14之间,均值为9.89±1.84,进一步说明调查湖荡CDOM以内源为主。 太湖流域湖荡湿地有色溶解有机物(CDOM)光谱吸收系数a(350)在空间分布上差异显著,且与高锰酸盐指数(CODMn)和溶解性有机物(DOC)存在相似的分布规律。 利用PARAFAC分析三维荧光图谱,解析出3种组分,即紫外光类腐殖质荧光组分C1(250 nm/430 nm)、类酪氨酸荧光组分C2(265 nm/305 nm)以及类色氨酸荧光组分C3(280 nm/330 nm)。太湖流域湖荡外源(C1)与内源(C2、C3)对CDOM贡献率具有显著差异性,各湖荡内源物质(C2、C3)对CDOM荧光强度贡献率分别为尚湖(97.47%)>昆承湖(95.77%)>阳澄湖(88.62%)>澄湖(86.96%)>宜兴三氿(81.34%)>长荡湖(80.77%)>淀山湖(79.51%)>傀儡湖(77.43%)>元荡(75.81%)>滆湖(68.44%)。 太湖流域湖荡CDOM主要以内源生物降解贡献为主,荧光指数BIX、HIX及类蛋白组分与类腐殖质的荧光强度的比值也显示相同的结果。

3 结论

