盐胁迫对苗期水飞蓟生理与活性成分的影响
唐晓清, 刘 谕, 杨 睿, 李林华, 王 雨, 施晟璐, 王康才
(1.南京农业大学中药研究所,江苏南京 210095; 2.南京市第九中学,江苏南京 210018; 3.安徽中医药高等专科学校药学系,安徽芜湖 241003)
水飞蓟[Silybummarinum(L.) Gaertn]为菊科水飞蓟属植物,以其成熟的果实入药[1],具有清热解毒、疏肝利胆的功效,主要用于肝胆湿热、胁痛、黄疸等症。其果实中主要含有水飞蓟宾、脱氢水飞蓟宾、水飞蓟宁、水飞蓟亭、水飞蓟宾聚合物等水飞蓟素类化合物[2],其茎叶含有黄酮类、氨基酸、生物碱等多种化合物[3]。现代药理研究证明,水飞蓟素与水飞蓟提取物具有稳定和保护肝细胞膜、改善肝功能、阻止肝损害、提高免疫力、抗疱疹病毒等功能[4-6]。水飞蓟原产于印度和巴基斯坦的喀什米尔山区,之后在欧洲、美洲及澳洲等多个地区都有种植[7]。1952年,北京植物园从英国引进水飞蓟,作为观赏植物栽培;1972年,由我国土产畜产进出口公司天津土产分公司从德国引种作为药用植物栽培[8]。我国很多地方都已引种成功,目前主要在西北和华北栽培。随着国内制药企业对水飞蓟原药材需求的增加,近几年价格也有所上升。水飞蓟耐严寒、耐盐碱、耐旱能力非常强,所以其对土壤要求并不严格,可利用盐碱地种植。我国的盐碱土面积较大,研究水飞蓟等耐盐植物对NaCl胁迫的响应,对利用大面积盐碱地资源,对农业盐渍土的治理、开发以及提高植物的耐盐性等方面都有非常重要的意义[9-12]。而目前在其栽培生产中,对其栽培生理与活性成分的研究较少,有研究表明水飞蓟种子萌发期,盐分主要通过改变种子吸涨能力来影响芽苗生长[13];在苗期,水飞蓟幼苗主要通过提高渗透物质含量和保护酶活性来缓解盐分造成的伤害;水飞蓟萌发期和苗期耐盐性有差异,萌发期耐盐能力明显低于苗期;而0.05~0.60 mmol/L的硝普钠(sodium nitroprusside,简称SNP)浸种能提高水飞蓟种子和幼苗的抗盐能力[14];NaCl溶液浓度在50~400 mmol/L范围内水飞蓟素含量随着盐浓度的升高有所增加[15]。而NaCl胁迫处理时间对苗期水飞蓟生长及活性成分的影响则未见报道。为此以苗期水飞蓟为试验材料,采用水培方式,以 100 mmol/L NaCl溶液处理不同时间,研究NaCl胁迫不同时间对苗期水飞蓟生理与活性成分含量的影响,为水飞蓟栽培生产中的耐盐性研究提供理论依据。
1 材料与方法
1.1 材料
试验材料为安徽省丫山野生药用植物园栽培种,经南京农业大学王康才教授鉴定为菊科植物水飞蓟[Silybummarinum(L.) Gaertn]的种子。
1.2 试验设计
于2016年1月24日将水飞蓟种子播种于周转箱内(基质为石英砂 ∶蛭石体积比=1 ∶2),3月24日选取长势基本一致的幼苗,单株移植于水培箱(45 cm×50 cm×15 cm)内,置于光照培养箱内,用Hoagland营养液水培,培养期间每2 d换1次营养液,培养条件为3 000 lx光照、25 ℃、通气;培养10 d后,进行NaCl胁迫处理,将营养液更换为100 mmol/L NaCl溶液,处理时间分别为0、1、2、3、4、5 d,分别记为CK、T1、T2、T3、T4、T5,每个处理8株,3次重复。
1.3 测定指标与方法
全部处理结束后测定其叶片的叶绿素相对含量SPAD(soil and plant analyzer develotrnent)值,另取新鲜叶片用于可溶性蛋白含量、超氧化物歧化酶(superoxide dismutase,简称SOD)活性、过氧化物酶(peroxidase,简称POD)与过氧化氢酶(catalase,简称CAT)活性、丙二醛含量(malondialdehyde,简称MDA)的测定,另取6株水飞蓟的地上部(叶片)于105 ℃烘箱内杀青15 min后,于60 ℃烘干至恒质量,粉碎过80目筛,用于测定可溶性糖、水飞蓟素、总黄酮等含量。
1.3.1 叶片叶绿素SPAD值测定 100 mmol/L NaCl胁迫处理结束后的上午,取由内至外全展且无破损的第2轮叶片的中上部作为测定部位,用SPAD 502叶绿素测定仪测定其SPAD值,每个处理测定8株。
1.3.2 叶片中可溶性蛋白含量测定 采用南京建成生物工程所试剂盒(A045-2)进行测定。
1.3.3 叶片中抗氧化酶活性的测定 (1)SOD活性的测定:采用南京建成生物工程研究所试剂盒(A001-1)测定;(2)POD活性的测定:采用南京建成生物工程研究所试剂盒(A084-3)测定。利用POD催化H2O2反应的原理,通过测定420 nm处吸光度的变化测定其活性。(3)CAT活性的测定:采用南京建成生物工程所试剂盒(A007-1)进行测定。利用CAT分解H2O2的反应可通过加入钼酸铵而迅速中止,剩余的H2O2与钼酸铵作用产生一种淡黄色的络合物,在 405 nm 处测定其变化量,计算CAT活性。
1.3.4 叶片中MDA含量测定 采用南京建成生物工程所试剂盒(A003-1)进行测定。
1.3.5 叶片中可溶性糖含量测定 采用苯酚-硫酸法进行测定。标准曲线的绘制:准确称取105 ℃干燥到恒质量的葡萄糖0.100 0 g,溶解定容于100 mL容量瓶中,得1 mg/mL葡萄糖对照品,精确吸取10 mL,再定容至100 mL,得 100 μg/mL 标准葡萄糖溶液备用。精确量取葡萄糖标准溶液0、0.1、0.2、0.4、0.6、1.0、1.5 mL置于干燥试管中,加水使总溶液为2.0 mL,加入6%苯酚1 mL,再加入浓硫酸5 mL,摇匀,冷却至室温,在490 nm下测定吸光度,以葡萄糖溶液含量为横坐标,吸光度为纵坐标,绘制标准曲线:Y=0.012 2X-0.003 7,r2=0.999 5(n=3)。可溶性糖的提取:精密称取 0.200 0 g 水飞蓟叶片粉末,置于3支试管中,加入6 mL蒸馏水,塑料薄膜封口,沸水浴提取60 min后,6 000 r/min处理 20 min 取上清液于25 mL容量瓶中,再次加入6 mL蒸馏水沸水浴提取60 min,过滤后至容量瓶中定容。测定:吸取 0.2 mL 样品液于试管中,加蒸馏水1.5 mL,加入1 mL 6%苯酚、5 mL浓H2SO4,摇匀后静置冷却,在490 nm下测定吸光度。
1.3.6 叶片中总黄酮含量测定 精密称取0.100 0 g水飞蓟叶片粉末,加入8 mL 70%乙醇,超声1 h后过滤,用乙醇定容至25 mL,混匀。取2 mL于试管中,加入0.5 mL 50 g/L NaNO2溶液0.5 mL,摇匀后静置6 min,加入0.5 mL 100 g/L Al(NO3)3溶液,摇匀,静置6 min,加入4 mL 40 g/L NaOH溶液,摇匀,用70%乙醇定容至10 mL,摇匀,静置15 min,在 510 nm 波长下比色,测定吸光度。以芸香苷为对照绘制标准曲线:Y=0.010 4X+0.001 0,r2=0.999 5(n=3)。
1.3.7 叶片中水飞蓟素含量测定 参考文献[1]的方法提取水飞蓟素。(1)色谱条件为色谱柱:Dubhe C18(250 mm×2.4 mm,5 μm);流动相:甲醇-水-冰醋酸体积比= 48 ∶52 ∶1;流速:1.000 mL/min;进样量10 μL;检测波长 287 nm。(2)标品溶液制备:精密称取水飞蓟宾标品3 mg,加甲醇制成每1 mL含0.12 mg的溶液作为母液,该母液浓度为60 μg/mL,再取适量稀释成浓度分别为0.5、1.0、2.0、5.0、10.0、30.0 μg/mL的溶液。经0.45 μm微孔滤膜过滤,滤液即为HPLC法测定用标准品溶液。(3)水飞蓟宾标准曲线:取浓度分别为0.5、1.0、2.0、5.0、10.0、30.0、60.0 μg/mL标准品溶液,按10 μL进样量注入高效液相色谱仪中,记录色谱图,以浓度为横坐标,峰面积和为纵坐标,水飞蓟宾的标准曲线为Y=15 697.0X-4 702.6,r2=0.999 8(n=3)。
1.4 数据处理
所有数据用Excel 2003和SPSS 20.0软件进行处理,处理间差异显著性比较采用Duncan氏新复极差法。
2 结果与分析
2.1 NaCl胁迫对苗期水飞蓟叶片叶绿素含量的影响
图1显示,随着NaCl胁迫时间的延长,水飞蓟叶片中叶绿素含量基本呈现降低趋势,由CK的42.04 SPAD降至胁迫处理T5的34.58 SPAD,其间NaCl胁迫处理T2到T3时,叶绿素含量由40.07 SPAD略微上升至41.05 SPAD,但是二者间不存在显著性差异(P>0.05)。与CK比较,NaCl胁迫处理T1、T2、T3的叶绿素含量与CK间无显著性差异(P>0.05),而NaCl胁迫处理T4、T5的叶绿素含量显著低于CK(P<0.05),但叶绿素含量总体降幅较小。表明,随着NaCl胁迫处理时间的延长,水飞蓟叶片叶绿素的合成受到一定程度的抑制。

2.2 NaCl胁迫对苗期水飞蓟叶片抗氧化酶活性和MDA含量的影响
2.2.1 NaCl胁迫对抗氧化酶活性的影响 由图2可知,在100 mmol/L NaCl胁迫下,苗期水飞蓟叶片中的SOD、POD、CAT活性变化基本一致,呈现升高-降低-升高-降低的趋势,T1处理下SOD、POD、CAT活性显著高于CK(P<0.05),说明NaCl胁迫1 d后水飞蓟体内的抗氧化酶已经开始发挥抗逆作用,以减轻NaCl胁迫对其的伤害。其中CAT在胁迫处理T1时活性达到最大值43.69 U/mg,比CK显著增加 61.87%,可见CAT对NaCl胁迫反应在三者中最敏感;胁迫处理T2时POD、CAT降低至各处理间的最低水平,其中CAT活性显著低于对照(P<0.05),说明3种抗氧化酶在清除活性氧后,水飞蓟植株恢复到了较好的生理水平,抗氧化酶活性降低。在NaCl胁迫处理T3、T4时,SOD、POD、CAT活性继续升高,说明持续的盐胁迫刺激下,SOD、POD、CAT继续发挥作用,以缓解盐胁迫对其的伤害。其中T4处理时,SOD与POD的活性最高,分别为30.44、21.02 U/mg,显著高于相应CK处理(P<0.05),此时的CAT与对照间无显著差异(P>0.05)。胁迫处理T5时3种酶活性均低于处理T4时的活性,说明持续较长时间的盐胁迫后,叶内的抗氧化酶系统可能受到一定的破坏。

2.2.2 NaCl胁迫对MDA含量的影响 由图3可知,在 100 mmol/L NaCl胁迫下,苗期水飞蓟叶片中MDA含量表现为降低-升高-降低的趋势,与CK相比NaCl胁迫处理T1、T2、T3的MDA含量显著下降(P<0.05),其中T2、T3间无显著性差异,T2处理的含量(3.61 nmol/mg)最低,胁迫处理T4时MDA含量有所增加,但仍显著低于CK(P<0.05),NaCl胁迫处理T5时MDA含量再次显著低于CK(P<0.05)。说明苗期水飞蓟在100 mmol/L NaCl胁迫下前期通过降低MDA含量以应对胁迫的伤害,3~4 d后伤害有所缓解其含量开始升高,但随着胁迫时间的延长,水飞蓟须要再次通过降低MDA含量以应对持续的盐胁迫伤害。
2.3.1 NaCl胁迫对可溶性蛋白含量的影响 图4结果显示,NaCl胁迫处理不同时间后水飞蓟叶片中可溶性蛋白含量呈现降低-升高-降低-升高的趋势,其中胁迫处理T2、T3时可溶性蛋白含量高于CK,处理T2时的含量(61.15 mg/g)最高,比CK显著增加20.20%(P<0.05),处理T3时的可溶性蛋白含量与CK间无显著性差异(P>0.05),处理T1、T4、T5时的含量均显著低于对照(P<0.05)。
2.3.2 NaCl胁迫对可溶性糖含量的影响 由图4可知,水飞蓟叶片中可溶性糖含量随着NaCl胁迫时间的延长呈现降低-升高-降低-升高的趋势,不同时间胁迫后的各处理均显著低于CK(P<0.05),其中胁迫处理T2时的含量(48.71 mg/g)最低。由此推测,一定浓度的NaCl胁迫不同时间后其体内可能须要分解可溶性糖以缓解盐胁迫的伤害。
2.4 NaCl胁迫对苗期水飞蓟叶片总黄酮含量的影响
由图5可知,随着100 mmol/L NaCl胁迫处理时间的增加,水飞蓟叶片中总黄酮含量呈现先降低后升高的趋势,其中胁迫处理T2时总黄酮含量最低(3.11%),且与CK无显著性差异(P>0.05);在NaCl胁迫处理T3、T4、T5时,总黄酮含量逐渐上升,且均显著高于CK的总黄酮含量(P<0.05),胁迫处理T5的总黄酮含量(7.44%)最大。表明盐胁迫处理一段时间有利于苗期水飞蓟叶片中总黄酮的积累。

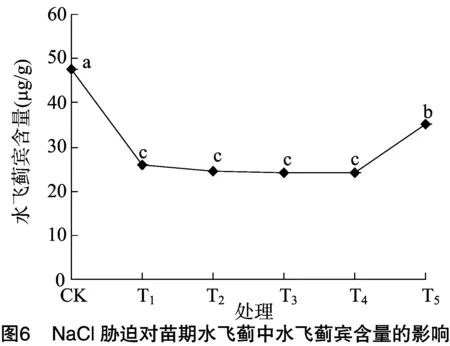
2.5 NaCl胁迫对苗期水飞蓟叶片中水飞蓟宾含量的影响
由图6可知,100 mmol/L NaCl胁迫处理苗期水飞蓟不同时间后,叶片中水飞蓟宾含量呈现先降低再升高的趋势,但均显著低于CK(P<0.05)。在NaCl胁迫处理T1、T2、T3时,叶片中水飞蓟宾含量显著低于对照CK(P<0.05),在NaCl胁迫处理T4时,水飞蓟宾含量开始略微上升,在NaCl胁迫处理T5时,水飞蓟宾含量升高幅度较大(T5高出T4处理45.46%),且T5处理显著高于T1~T4处理(P<0.05)。可见,一定时间的NaCl胁迫处理不利于苗期水飞蓟叶片中水飞蓟宾的积累。
3 结论与讨论
3.1 NaCl胁迫下苗期水飞蓟抗氧化酶活性和MDA含量的响应特征
活性氧是指极为活泼、氧化能力很强的含氧物的总称。NaCl胁迫下,植物细胞内的活性氧产生和清除不平衡,大量活性氧会积累在植物体内,活性氧增多会引起膜脂过氧化、蛋白质变性、核酸降解等不良反应。膜质过氧化的最终产物是MDA,MDA可以作为膜质过氧化的一个指标[16]。在NaCl胁迫下,SOD、POD、CAT 3种酶的协同作用能降低氧自由基的积累,阻遏O2-和H2O2通过Fenton型Haber-Weiss反应转化成破坏性强的·OH,减轻了自由基对生物大分子的降解破坏,也减轻了其对生物膜的损害[17],以缓解植物因胁迫受到的伤害。
本研究中,在NaCl胁迫下,SOD、POD和CAT均能积极响应,在NaCl胁迫处理T1时,SOD、POD和CAT活性均增加,3种酶对NaCl胁迫反应较迅速,能够快速增大活性来抵御盐胁迫对自身的伤害;在胁迫处理T2时酶活性降低,3种抗氧化酶清除了大部分的活性氧,说明生长代谢基本恢复正常;在胁迫处理T3时,3种酶活性又开始增加,持续的盐胁迫下3种酶再次被激活,活性增强,从而使叶片细胞代谢保持在正常水平。而胁迫处理T5时,3种酶活性减小的原因可能是在较长时间的NaCl胁迫下,3种酶的调节能力有限,产生活性氧的速度大于这3种酶清除活性氧的速度,导致活性氧迅速破坏生物大分子,使酶活性降低。
随着盐胁迫时间的延长,作为膜质氧化产物的MDA,其含量与SOD、POD、CAT活性变化的趋势前期是相反的,说明在NaCl胁迫初期SOD、POD和CAT大量地清除活性氧,MDA含量降低,NaCl胁迫后期SOD、POD和CAT的活性受到限制,清除活性氧的能力降低,活性氧增多,这可能是导致NaCl胁迫4 d后MDA含量升高的原因。
3.2 NaCl胁迫下苗期水飞蓟渗透性物质的响应特征
NaCl胁迫可对植物产生水分胁迫,促使植物体内积累各种有机物质以提高细胞液浓度,降低细胞液的渗透势,保持一定的压力势,维持体内水分,以适应NaCl胁迫环境。可溶性糖、可溶性蛋白是植物体内有效的渗透调节剂。可溶性糖包括蔗糖、葡萄糖、果糖、半乳糖等,其积累主要是由于淀粉等大分子碳水化合物的分解作用。其中,可溶性糖还是合成其他有机溶质的碳架和能量来源,对细胞质膜和原生胶体有稳定作用,可在细胞内无机离子浓度高时起保护酶类的作用[18]。可溶性蛋白含量与植物的保水能力有一定的关系。本研究发现,可溶性蛋白及可溶性糖含量在NaCl胁迫过程中表现出相似的变化趋势,推测前期降低的原因可能是二者对NaCl胁迫比较敏感,细胞受到胁迫伤害后其体内通过分解可溶性蛋白及可溶性糖以应对胁迫伤害,经过一定时间后耐受性增强,促使其产生更多的可溶性蛋白和可溶性糖来平衡细胞内外的渗透性。其中NaCl胁迫2 d可明显促进可溶性蛋白的积累,降低细胞渗透势,增强渗透调节能力,维持植物正常的生长生理需求。而NaCl胁迫处理不同时间后可溶性糖的积累均受到抑制,说明一定时间的NaCl胁迫致使苗期水飞蓟体内大分子化合物分解,从而影响可溶性糖的积累,再加上植物生理机能的破坏,加快了可溶性蛋白和可溶性糖的分解速度,最后表现为一定时间的NaCl胁迫后两者含量均显著低于对照。
3.3 NaCl胁迫下苗期水飞蓟总黄酮及水飞蓟宾含量的响应特征
NaCl胁迫条件下,植物次生代谢产物的合成水平会提高,次生代谢产物含量会增加。在NaCl胁迫处理T3、T4、T5时,苗期水飞蓟叶片总黄酮含量随着NaCl胁迫时间的增加而增加,说明一定时间内NaCl胁迫可能激发了其体内的次生代谢,能促进某些代谢途径中的防御性次生代谢产物的产生和增加。在NaCl胁迫处理初期,苗期水飞蓟的总黄酮含量略微降低,原因可能是在NaCl胁迫初期次生代谢系统的防御功能需要一定的缓冲时间,总黄酮无法积累而致使其含量有所降低。
水飞蓟宾属于黄酮类化合物,在NaCl胁迫处理下,叶片的水飞蓟宾含量随着NaCl胁迫时间的增加呈现先降低后升高的趋势。但各处理中含量最高的T5处理的水飞蓟宾仍低于CK,推测原因可能是NaCl胁迫时间不够长。与总黄酮含量结果相对比发现,NaCl胁迫处理T3时,总黄酮含量开始升高,而水飞蓟宾含量降至最低,之后两者含量都有明显的升高趋势。推测原因可能是水飞蓟宾对盐胁迫的响应较慢,其他黄酮类物质的合成较多。
综合分析,苗期水飞蓟在适度的NaCl胁迫下,具有一定的耐盐性,在NaCl胁迫处理后,叶片中叶绿素含量下降,光合作用受到抑制。SOD、POD与CAT活性在NaCl胁迫初期上升,NaCl胁迫后期其生理机制受到破坏而下降,可溶性糖含量显著低于对照,总黄酮和水飞蓟宾含量在NaCl胁迫初期时下降,在NaCl胁迫后期上升。由此推测苗期水飞蓟的耐盐机制可能为适度的NaCl胁迫下,通过提高保护酶活性和分解部分渗透调节物质以缓解NaCl胁迫伤害,其体内的次生代谢也受到抑制,但随着胁迫时间的延长(T3~T5),其体内的次生代谢可能被激活,从而使其代谢产物的合成水平得以提高以抵御外界的渗透胁迫。

