核酸疫苗pEGFPN1-MLAA34-B7H4IgV的构建及其免疫活性观察
赵臣,王婉莹,赵佳琪,刘爽,王丽,张梦凡
(吉林医药学院检验学院,吉林吉林132013)
急性白血病(AL)是一种常见的、致死性的血液系统恶性肿瘤,病死率高,极易复发。微小残留白血病(MRD)是指急性白血病经诱导化疗完全缓解或干细胞移植后,患者体内仍然残留有少量白血病细胞的状态,MRD是急性白血病复发的根源。核酸疫苗是将外源基因导入动物体细胞内,并通过宿主细胞表达抗原蛋白,诱导宿主产生免疫应答反应,以达到预防和治疗疾病的目的[1]。研究发现,核酸疫苗能同时诱导细胞免疫和体液免疫,激发白血病患者特异性免疫应答,清除化疗后残余肿瘤细胞,是有望克服MRD的方法之一[2]。2015年1月~2017年12月,我们选择急性白血病相关抗原基因MLAA34以及负性共刺激分子B7H4作为构建核酸疫苗靶基因,优化抗原表位基因,构建核酸疫苗pEGFPN1-MLAA34-B7H4IgV,并对其免疫活性进行观察,旨在为白血病的免疫防治奠定基础。
1 材料与方法
1.1 主要材料 E.coli DH5α菌株、pEGFPN1质粒、pEGFPN1-MLAA34质粒、pEGFPN1-B7H4IgV质粒、单核巨噬细胞THP-1为本课题组保存;噻唑蓝(MTT)试剂、限制性内切酶(EcoR Ⅰ/BamH Ⅰ)、无内毒素质粒提取试剂盒购自NEB公司;总RNA提取试剂盒、RT-PCR试剂盒、T4 DNA连接酶和胶回收纯化等试剂盒及胎牛血清(FBS)、DMEM(低糖)培养基购于生工生物工程(上海)股份有限公司;广谱蛋白Maker购自Hyclone公司;ELISA试剂盒购自上海酶联生物科技有限公司;BALB/c小鼠(SPF级,雌性,6~8周龄)购自北京维通利华实验技术动物有限公司。
1.2 实验方法
1.2.1 核酸疫苗pEGFPN1-MLAA34-B7H4IgV的构建
1.2.1.1 引物设计 根据MLAA34基因(GenBank:AY288977.2)和B7H4IgV基因(GenBank: NM_001190366.1)序列分别设计MLAA34基因引物P1/P2和B7H4IgV基因引物P3/P4,见表1。其中MLAA34基因长度为1 014 bp,B7H4IgV基因长度为849 bp。P2和P3引物末端分别加入重叠序列GGGGGCGGAGGCTCCGGCGGCGGGGGGTCTGGGG-
GCGGGGGAAGC,引物由生工生物工程(上海)股份有限公司合成。

表1 MLAA34和B7H4IgV基因引物序列
注:P1和P4引物下划线为酶切位点;P2和P3引物下划线为互补重叠序列。
1.2.1.2 pEGFPN1-MLAA34-B7H4IgV重组质粒的构建与鉴定 采用重叠延伸(SOE)-PCR法。分别以pEGFPN1-MLAA34质粒和pEGFPN1-B7H4IgV质粒为模板,以P1/P2和P3/P4引物扩增MLAA-34基因和B7H4IgV基因;再以P1和P4为引物,SOE-PCR法扩增MLAA34-B7H4IgV融合基因;最后将pEGFPN1质粒和融合基因MLAA34-B7H4IgV分别用限制性内切酶EcoR Ⅰ/BamH Ⅰ进行双酶切,酶切产物用T4 DNA连接酶进行连接,将连接产物转化感受态菌E.coli DH5α。挑取阳性克隆,提取质粒,分别用PCR法、酶切法鉴定。
1.2.2 核酸疫苗pEGFPN1-MLAA34-B7H4IgV免疫活性观察
1.2.2.1 动物分组与免疫 BALB/c鼠28只,随机分为4组各7只。按试剂盒说明书大量制备和纯化质粒DNA,并用生理盐水调整至1.0 mg/L;P、M、B、MB组分别在小鼠两侧股四头肌内侧肌内注射磷酸盐缓冲液pEGFPN1、pEGFPN1-MLAA34、pEGFPN1-B7H4IgV、pEGFPN1-MLAA34-B7H4IgV质粒,每只100 μg。接种前24 h,用0.25%布比卡因100 μL预处理。在0、2、4周,各行1次同剂量加强免疫;分别于0、4、8周眼球取血1.5 mL/只(肝素抗凝),取血后立即处死无菌摘取脾脏。
1.2.2.2 血清抗体及细胞因子水平检测 取1.2.2.1中的肝素抗凝血约1.0 mL,离心提取血浆;ELISA法检测免疫8周血清中抗体IgG1、IgG2a,以及免疫0、4、8周血清细胞因子IL-2、IL-4、IFN-γ,按试剂盒说明书操作。
1.2.2.3 THP-1细胞增殖抑制作用观察 将脾脏置于不含FBS的RPMI1640培养基中,剪去脂肪及筋膜组织;于200目不锈钢网筛上研碎,重悬于含5% FBS的Hank′s液中;以2 000 r/min离心5 min,低渗裂解红细胞;用含10% FBS的RPMI1640培养基清洗3次,调整细胞密度为1×107/mL。脾淋巴细胞悬液倍比稀释后,取100 μL加入到培养的THP-1细胞中,使效靶比分别为50∶1、25∶1、12.5∶1、6.25∶1,各设3个复孔;在37 ℃、5% CO2中孵育24 h进行反应,同时设不同浓度效应细胞对照孔及靶细胞对照孔。MTT法检测THP-1细胞增殖情况,计算细胞增殖抑制率,以此表示小鼠脾淋巴细胞的杀伤活性。细胞增殖抑制率=1-(对照组OD-实验组OD)/(对照组OD-空白组OD)×100%。
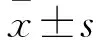
2 结果
2.1 核酸疫苗pEGFPN1-MLAA34-B7H4IgV构建结果 MLAA34-B7H4IgV融合基因PCR产物电泳检测约为2 000 bp,与理论值(1 922 bp)相符;pEGFPN1-MLAA34-B7H4IgV酶切后电泳检测为5 000~7 500 bp,与理论值(6 655 bp)相符。
2.2 各组血清细胞因子水平比较 与同组免疫0周时、同时点P组比较,免疫4、8周时M、B、MB组血清细胞因子IL-2、IL-4水平升高而IFN-γ水平降低(P均<0.05或<0.01)。与同时点M、B组比较,MB组血清细胞因子IL-2、IL-4水平升高而IFN-γ水平降低(P均<0.05);M、B组同时点比较,差异无统计学意义。见表2。
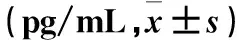
表2 各组血清IL-2、IL-4、IFN-γ水平比较
注:与同时点P组比较,aP<0.05,bP<0.01;与M组比较,cP<0.05;与B组比较,dP<0.05;与同组免疫第0周比较,eP<0.05。
2.3 各组血清抗体水平比较 见表3。
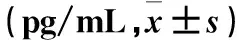
表3 各组血清IgG1、IgG2a水平比较
注:与P组比较,aP<0.05;与M组比较,cP<0.05;与B组比较,dP<0.05。
2.4 各组THP-1细胞增殖抑制率比较 见表4。
3 讨论
1990年,美国学者Wolff等发现将纯化的DNA或RNA表达质粒直接肌内注射给小鼠,可使局部肌细胞内表达该基因,并且这种表达持续时间长,可达数月甚至终生,这一重大发现被称为疫苗研究史上第3次革命[3,4]。核酸疫苗制作简单、应用安全、免疫效果好,可刺激机体同时产生细胞免疫和体液免疫,可用于MRD的免疫治疗[5]。
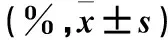
表4 小鼠脾淋巴细胞杀伤活性
注:与同效靶比P组比较,aP<0.05,bP<0.01;与M组比较,cP<0.05;与B组比较,dP<0.05。
导入机体内的目的基因是核酸疫苗发挥免疫保护作用的关键。本研究选择急性白血病相关抗原基因MLAA-34和负性共刺激分子B7-H4来构建目的基因。MLAA-34基因与急性单核细胞白血病的发生密切相关,其表达下调能抑制白血病细胞在体外增殖,诱发白血病细胞的凋亡,与急性白血病的不良预后密切相关[6~8];B7-H4可以抑制T细胞的激活、增殖,抑制细胞因子释放和T细胞毒作用,参与了肿瘤的免疫逃逸[9]。研究发现,B7-H4的IgV样区与MHC分子轻链可变区作用相似,B7-H4主要通过其IgV样区与受体相结合,从而抑制T细胞的增殖、细胞因子的释放和细胞毒作用[10],对T细胞的免疫应答发挥抑制性调节作用[11],是理想的肿瘤免疫治疗的靶基因。
本研究采用SOE-PCR技术将两个目的基因MLAA-34和B7-H4IgV融合在一起,形成MLAA34-B7H4IgV融合基因,两个基因之间采用柔性肽基因GGGGGCGGAGGCTCCGGCGGCGGGGGGTCTGGGGGCGGGGGAAGC作为重叠序列,保证了两个蛋白融合表达且正确折叠,MLAA-34和B7-H4IgV皆能发挥其独特功能,相比于限制性内切酶的酶切更加简便快捷[12]。将此融合基因作为核酸疫苗的目的基因,利用B7-H4IgV将MLAA-34表达到免疫细胞表面,产生相应的抗体和细胞因子,拉近免疫细胞与靶细胞的距离;之后anti-B7H4IgV与靶细胞表面B7-H4受体结合,阻断了肿瘤细胞的免疫逃逸,提高T细胞的应答反应,激活T细胞释放因子和发挥细胞毒性作用[9],使核酸疫苗充分发挥其免疫保护作用。
本研究表明,免疫BALB/c小鼠后,MB组THP-1细胞增殖抑制率高于同效靶比其他各组。这表明小鼠脾淋巴细胞在核酸疫苗pEGFPN1-MLAA34-B7H4IgV的作用下,被致敏活化,对相应的白血病细胞产生了较强的增殖抑制作用;同时BALB/c小鼠经核酸疫苗免疫后,MB组血清IL-2和IFN-γ水平增高。这说明在核酸疫苗pEGFPN1-MLAA34-B7H4IgV的作用下,其细胞免疫被激活,产生了较强的特异性细胞免疫,参与了系统机体免疫应答。此外,BALB/c小鼠经核酸疫苗免疫后,MB组血清IgG1水平高于其他各组,而细胞因子IL-4水平降低。这说明该核酸疫苗pEGFPN1-MLAA34-B7H4IgV能诱发强烈的体液免疫,增强了机体对肿瘤细胞的免疫应答,具有明显的免疫保护作用。
总之,本研究以优势表位基因构建了核酸疫苗pEGFPN1-MLAA34-B7H4IgV,并对其抗原性和免疫原性进行检测,发现核酸疫苗能激活动物体内细胞免疫和体液免疫,对白血病细胞具有杀伤作用,具有明显的抗白血病效应,为白血病的免疫治疗研究奠定了基础。

