空气中CO2浓度对灵芝三萜的影响及其分子机制研究*
姚 珂,韩嘉钰,贺黎铭,余梦瑶,许晓燕,江 南,李 芳,罗 霞
(四川省中医药科学院菌类药材研究所,四川 成都 610041)
灵芝[Ganoderma lucidum(Curbs:Fr.)P.Karst][1]作为我国被人熟知的传统名贵中药材,在多种疾病治疗与预防中[2-3],灵芝的提取物如灵芝多糖、三萜类化合物都起到不可或缺的作用[4]。目前由于科技的发展,灵芝人工栽培技术日益成熟,可以实现大规模种植。但由于种植的条件[5]、方式不同,灵芝往往只从其农艺性状来判定品质好坏,却忽略所得子实体中生理活性成分的含量。因此研究了如何通过控制灵芝生长时空气CO2浓度[6-9]来提高子实体三萜含量及其相关分子机制,试验结果不仅有利于灵芝栽培过程条件控制,还有利于提升灵芝药材的品质,最终可以为市场输出优质的菌类药材原料。
1 材料和方法
1.1 供试菌株
灵芝ZL13(Ganoderma lucidum),由四川省中医药科学院菌类药材研究所提供。
1.2 试验材料和试剂
木屑、棉籽壳、玉米芯、麦麸、石灰和石膏购自农资市场;葡萄糖、蒽酮、浓硫酸、香草醛、齐墩果酸、无水乙醇、NaHCO3、冰醋酸、EASYspin Plus RNA快速提取试剂盒、FastQuant RT Kit(with gDNase)、快速反转录试剂盒(TAKARA)、Ultra SYBR Mixture(with ROX)、Super Gelgreen染料 (10 000×水溶液)、琼脂糖;50×TAE电泳液;基因sqs、gdp、ls、hmgr的扩增引物。
1.3 供试培养基
母种培养基:马铃薯浸出粉3 g、葡萄糖20 g、琼脂15 g,蒸馏水1 000 mL,pH自然。
栽培种培养基:麦粒99%、石膏1%,pH自然,含水量为60%。
栽培培养基:木屑15%、棉籽壳60%、玉米芯15%、麦麸8%、石灰1%、石膏1%,pH 5~6,含水量60%左右。将木屑、麦麸、棉籽壳、石灰和石膏混合均匀,掺入预湿24 h的玉米芯、棉籽壳中拌匀,最后将混合均匀的栽培料堆料发酵3 d。选用17 cm×33 cm×0.05 cm的聚丙烯袋,每袋装湿料1 kg,121℃高压灭菌3 h,冷却至室温后每袋接入小麦粒原种10 g左右。
1.4 培养条件和栽培方法
菌丝生长阶段的培养温度为27℃,避光,湿度60%;出芝阶段培养条件为光照1 000 lx,湿度85%~90%,日间温度25℃,夜间温度22℃。
菌丝满袋后,打开封口膜,将每个菌袋口接种部分的基质除去,按照下列条件设置进行出芝试验:温度27℃,相对湿度80%,光照1 000 lx~1 200 lx。
设置低、中、高三个浓度组,通过调节通气量,以保证环境中CO2浓度维持在稳定范围内。处理1(CO2低浓度组):全天不间断排气,环境CO2浓度在0.05%~0.06%(500 mg·L-1~600 mg·L-1);处理2(CO2中浓度组):全天每小时排气10 min,环境CO2浓度在0.08%~0.09%(800 mg·L-1~900 mg·L-1);处理3(CO2高浓度组):完全封闭,全天不排气,环境 CO2浓度在 0.13%~0.14% (1 300 mg·L-1~1 400 mg·L-1)。灵芝生长试验均在人工气候培养箱内完成。
1.5 采样方法
子实体取样方法:根据灵芝子实体生长特性,将灵芝生殖生长期分为4个阶段:原基形成期(菌丝扭结呈白色圆状或椭圆状)、菌蕾期(白色子实体原基开始分化突起,子实体后端表面出现褐色)、开片期(灵芝子实体前段开始横向生长呈扇形,有淡黄色和白色边缘)、成熟期(灵芝子实体淡黄色边缘消失,完成孢子弹射),每个时期取3个重复样品,采样后将样品按照《中国药典》(2015年版)的要求,烘干并打碎成粉末,过20目筛后,放置于自封袋内,备用待测。
1.6 灵芝三萜的测定方法
灵芝子实体中总三萜类化合物含量的测定,参照《中国药典》(2015年版)中灵芝三萜的测定方法[10]。
1.7 总RNA的提取
操作前,将要使用的去RNA酶的移液器枪头和离心管放于高压蒸汽灭菌锅中,在121℃高压蒸汽灭菌20 min。其余试验器械在高温烘箱中180℃温度烘干6 h。
总RNA的提取依照EASYspin Plus RNA快速提取试剂盒说明进行。
1.8 RNA质量检查
上述所提取的RNA样品浓度和质量,通过核酸蛋白测定仪器(SmartSpec Plus) 和浓度为1.5%的琼脂糖电泳验证。
RNA质量的检测和定量分析:取RNA样品10 μL,稀释10倍,在核酸检测的仪器紫外光下,检测RNA样品的A260/A280数字并读取RNA浓度。
RNA完整性的检测:每20毫升的新鲜的1×TAE液体中,添加0.3 g固体琼脂糖凝胶,加热溶解使其完全混合均匀,按每20毫升琼脂糖凝胶加入1 μL的比例添加Super Gelgreen染料,倾尽模具中,常温中凝固,拔出制孔梳。清洗电泳槽并向其中倒入新鲜TAE缓冲液,放入制备好的琼脂糖凝胶,各取 RNA 样品 5 μL,加入 1 μL 6× loading buffer,点样,电泳(80 V,20 min)。凝胶成像仪观察(Gel Doc XR),拍照记录。符合下游要求的RNA样品,即为提取成功。
1.9 逆转录
将上步已经成功提取的总RNA,通过购买的快速反转录试剂盒(TAKARA) 反转录为第一链DNA(cDNA)(引物是 Oligo d(T) primer),逆转录产物用于接下来的实时荧光定量PCR(RT-PCR)。取2 μg总RNA为模板,构建20 μL反应体系,具体操作流程参照快速反转录试剂盒说明进行。
1.10 定量PCR
采用Primer5并参考相关文献综合而得到基因gpd、hmgr、sqs、ls的扩增引物[11-12]。以cDNA为模板,进行常规PCR分析。即分别点5 μL扩增样本加入到1.5%琼脂糖凝胶里,电泳(80 V、20 min)。凝胶成像仪观察,拍照记录。
按照Ultra SYBR Mixture(withROX) 试剂盒提供的方法,把cDNA模板逐步按梯度稀释,优化反应体系,使用iCycler iQTM实时荧光PCR检测系统进行荧光定量PCR分析。50 μL反应体系的成分为:2×扩增缓冲液 25 μL、正向引物 (10 μm) 1 μL、反向引物 (10 μm) 1 μL、模板 DNA 2 μL,加双蒸水至 50 μL。
每个反应体系重复3次。
采用两步法进行PCR扩增,程序为95℃预变性10 min;95℃变性 15 s,62℃退火/延伸 1 min,40 个循环。溶解曲线分析:95℃反应1 min,55℃反应1 min,55℃反应15 s。在退火/延伸步骤,62℃时进行实时荧光系统采集。
基因gpd是灵芝生长过程中必需表达的管家基因,在灵芝体内表达相对稳定,故选择基因gpd为内参基因,其余所测目标基因均通过基因gpd校正。灵芝子实体时间变化规律试验中,以低CO2浓度组灵芝子实体和原基期子实体所测基因表达量定义为1,其余处理各个基因的表达量表征为相应倍数,根据 2-ΔΔCt法[13]计算。
2 试验结果
2.1 空气中CO2浓度对灵芝子实体形态、总三萜含量变化规律的影响
2.1.1 空气中CO2不同浓度对灵芝子实体形态变化的影响
空气中CO2不同浓度处理组,灵芝整个生殖生长时期不同阶段子实体形态的变化情况见图1。

图1 不同CO2浓度处理组灵芝子实体生长形态Fig.1 Growth morphology of Ganoderma lucidum fruiting body in different concentrations of CO2
从图1可以看出,空气中的CO2浓度对灵芝子实体形态影响显著。在灵芝原基生长期,CO2低浓度组子实体原基形态较为膨大且覆盖整个、单一且覆盖整个菌袋口生长,并有少许分化迹象;CO2中浓度组和CO2高浓度组子实体原基丛生且较小,CO2浓度越高,原基形态发育越细长。从整个灵芝生殖生长阶段来看,CO2低浓度组子实体具有明显的菌盖和不明显的菌柄,而CO2中浓度组具有明显的菌柄,与CO2低浓度组相比灵芝子实体菌盖形态差异不大;CO2高浓度组,即空气CO2浓度大于0.1%处理组灵芝子实体不形成菌盖,子实体只伸长生长,最终形成细长的鹿角状灵芝。有研究表明空气CO2浓度[14-15]主要影响灵芝子实体菌蕾发育和菌盖开片的情况。
2.1.2 空气中CO2浓度对子实体不同生长期内总三萜含量变化规律的影响
空气中CO2浓度对灵芝子实体总三萜含量变化规律的影响结果见图2。

图2 不同CO2浓度组灵芝子实体不同生长期内总三萜含量变化Fig.2 Changes of total triterpene in the different growth stage of Ganoderma lucidum in different concentrations of CO2.
由图2可以看出,CO2低浓度组灵芝子实体总三萜含量随灵芝子实体生长发育出现先升高,到灵芝子实体成熟后略有下降;CO2中浓度组灵芝子实体总三萜含量呈一直上升的趋势;CO2高浓度组灵芝总三萜含量一直维持在一定范围内保持不变。在子实体发育的各个时期,随空气中CO2浓度的升高,灵芝子实体总三萜含量也呈升高趋势,其中在子实体发育早期差异更明显。有研究表明,空气中CO2浓度不仅影响灵芝子实体总三萜含量,而且对不同生长期灵芝总三萜含量的变化规律也有明显影响[14-17]。

图3 CO2浓度对不同生长期灵芝子实体中hmgr、sqs、ls基因表达的影响Fig.3 Effect of different concentrations of CO2on the relative expression of gene hmgr,sqs,ls of Ganoderma lucidum in different growth stage
2.2 CO2浓度对子实体总三萜酸合成关键酶基因表达量的影响
2.2.1 溶解曲线和扩增效率的分析
内参基因gpd和3个目的基因hmgr、sqs、ls的荧光定量PCR溶解曲线均为单峰,这表明扩增产物特异性较好。
对内参基因和3个目的基因的扩增效率进行分析,扩增效率接近100%,且相对偏差小于5%,可以认为4个基因的扩增效率一致,因此,对不同CO2浓度处理组灵芝子实体三萜酸合成3个关键酶基因的表达分析可采用2-ΔΔCt法。
2.2.2 CO2浓度对子实体总三萜合成关键酶基因表达量的影响
CO2浓度对不同时期灵芝子实体中总三萜合成途径关键酶基因表达的影响如图3所示。
由图3可以看出,在灵芝子实体生长的原基形成期和菌蕾期,CO2浓度的升高促进了基因hmgr表达量的增加,而在灵芝子实体成熟期CO2浓度的升高使基因hmgr的表达量减少。在原基形成期,CO2中、高浓度组中sqs基因的表达量不及CO2低浓度组,而从菌蕾期开始,CO2中、高浓度组中sqs基因的表达量明显地高于CO2低浓度组,特别是成熟期CO2高浓度组,sqs基因表达量高于其余2组10倍以上。在灵芝子实体生殖生长的各个时期,ls基因的表达量均随CO2浓度的升高呈阶梯升高的趋势。结合灵芝总三萜的含量来看,ls基因的表达量与总三萜含量变化趋势一致。
2.2.3 不同CO2浓度组各生长期各基因表达量的变化规律
将不同CO2浓度组原基形成期所测基因的表达量定义为1,研究不同CO2浓度组在各生长期基因表达量的变化规律,结果见图4~图6。
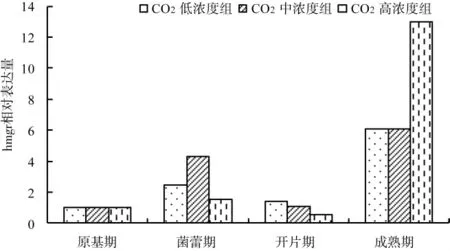
图4 各生长期不同CO2浓度组基因hmgr表达量变化Fig.4 Change of relative expression of gene hmgr of each growth stages in different concentrations of CO2

图5 各生长期不同CO2浓度组基因sqs表达量变化Fig.5 Change of relative expression of gene sqs of each growth stages in different concentrations of CO2

图6 各生长期不同CO2浓度组基因ls表达量变化Fig.6 Change of relative expression of gene ls of each growth stages in different concentrations of CO2
从图4~图6可以看出,随着灵芝子实体的生长,hmgr基因的表达量逐渐增加,在开片期表达量会有所下调,但成熟期hmgr基因的表达量又会明显上调。这说明CO2浓度未影响hmgr基因表达量的变化规律。对于sqs基因来说,在菌蕾期和开片期CO2中、高浓度组中其表达量明显增加,在成熟期又有所下调;而CO2低浓度组sqs基因表达在子实体发育后期较原基形成期相对偏低。3个浓度组中,ls基因的表达量只在CO2低浓组中菌蕾期有小幅下调,其余均随灵芝子实体生长而增加。结合总三萜的变化规律来看,ls基因相对表达量的变化幅度与三萜含量的变化规律一致。
3 讨论
从形态学上观察可知,原基形成期低浓度CO2更适宜灵芝原基的生长,菌蕾期适当地升高CO2浓度有利于灵芝菌柄的形成,但在开片期灵芝则无法承受较高的CO2浓度,当CO2浓度高于0.1%时灵芝将不能形成菌盖。这表明,灵芝子实体在不同生长阶段对CO2浓度的承受力不同,其中子实体形成期>原基形成期>菌丝生长期。但CO2浓度调控灵芝子实体菌盖形成的具体作用机制尚不明确,猜测可能与一些子实体内部激素的调控有关[18]。
空气中的CO2浓度对灵芝子实体三萜含量的变化有显著的影响。当CO2浓度高于0.1%时,子实体中三萜含量较高;在灵芝子实体发育的早期(原基形成期和菌蕾期),CO2浓度也对灵芝三萜含量影响较大;而成熟期时由于灵芝自身三萜的合成,CO2浓度对其含量的影响反而较小。
在子实体发育的原基形成期和菌蕾期,高CO2浓度组灵芝子实体生物合成基因hmgr和基因ls的表达水平与子实体三萜含量呈正相关关系;在子实体开片期和成熟期,高CO2浓度组基因sqs和基因ls的表达水平与灵芝子实体三萜含量呈正相关关系。高CO2浓度影响灵芝子实体三萜含量的升高,这可能是通过调控灵芝三萜合成途径相关基因的表达实现的。灵芝整个生殖生长周期中,CO2高浓度和中浓度组中,基因hmgr、sqs、ls的表达量在其他时期均高于原基形成期,而CO2低浓度组中菌蕾期和开片期基因sqs的表达量却较低,这可能是导致CO2低浓度组中灵芝三萜含量不高的原因。不同CO2浓度组基因ls表达量在不同生长期的变化规律与子实体总三萜含量的变化规律高度一致。在已知的MVP合成途径中,羊毛甾醇合酶(LS)是合成灵芝三萜中羊毛甾醇的关键,因此推断基因ls的表达可能与灵芝三萜的合成多少相关。CO2浓度可能主要通过诱导基因ls的高表达以提高灵芝三萜含量。在灵芝子实体原基形成期,CO2浓度可能同时诱导了基因hmgr和基因ls的表达上调,因此造成三萜含量的差异较大。

