日循环变化偏热环境对肉鸡血清脑肠肽和盲肠菌群 多样性的影响
常双双,李萌,厉秀梅,石玉祥,张敏红,冯京海
日循环变化偏热环境对肉鸡血清脑肠肽和盲肠菌群 多样性的影响
常双双1,2,李萌1,厉秀梅1,石玉祥2,张敏红1,冯京海1
(1中国农业科学院北京畜牧兽医研究所/动物营养学国家重点实验室,北京 100193;2河北工程大学农学院,河北邯郸 056021)
【目的】应激可改变畜禽脑肠轴功能,同时改变肠道菌群结构,其中热应激是影响畜禽健康最为主要的环境影响因素之一。研究日循环变化偏热环境对肉鸡血清脑肠肽和盲肠菌群多样性的影响,为肉鸡健康养殖提供理论依据。【方法】选取22d健康、体重相近爱拔益加(AA)肉鸡120只,随机分成2个处理组,每组6个重复,每个重复10只鸡(公母各5只)。将2个处理组的肉鸡转入环境控制舱,在环境温度为21℃,相对湿度为60%的条件下适应7d。29d时开始正式试验,试验组环境温度采用24h循环变温(26℃—29℃—32℃—29℃—26℃),相对湿度为60%;对照组环境温度为21℃,相对湿度为60%,试验条件维持至试验结束,共计14d。分别于试验第7和14天,每组随机选取6只肉鸡(公母各半,每个重复1只肉鸡),肉鸡采用静脉采血,采用ELISA测定血清中5-HT、VIP、SP的含量。同时用无菌收集盲肠内容物,将同一处理组的6个样品迅速混匀,装置无菌离心管中,液氮速冻,-80℃保存备用。采用16S rDNA的PCR-DGGE分子技术,结合共性和特异性条带割胶回收DNA进行克隆和测序,分析日循环变化偏热环境对肉鸡血清脑肠肽和盲肠菌群多样性的影响。【结果】(1)试验第7天时,日循环变化偏热环境组肉鸡血清5-HT含量显著高于对照组(<0.05);而对照组和日循环变化偏热环境组肉鸡VIP和SP并无显著差异。试验第14天时,日循环变化偏热环境组肉鸡血清VIP含量显著低于对照组(<0.05),对照组和日循环变化偏热环境组肉鸡血清5-HT和SP并无显著差异。(2)试验第7天,日循环变化偏热环境组肉鸡盲肠细菌条带数低于对照组,第14天日循环变化偏热环境组与对照组细菌条带数相同,但日循环变化偏热环境组肉鸡盲肠菌群多样性下降。(3)对照组和日循环变化偏热环境组肉鸡盲肠共性菌群为、、和;而日循环变化偏热环境组利于和的生长,抑制和的定植。【结论】(1)日循环变化偏热环境组与对照组相比,试验第7天肉鸡血清5-HT的含量增加;试验第14天肉鸡血清VIP的含量下降;SP无显著差异。(2)日循环变化偏热环境影响肉鸡盲肠菌群结构和多样性。
肉鸡;偏热环境;脑肠肽;肠道菌群
0 引言
【研究意义】应激可改变脑肠轴功能和肠道菌群结构[1],其中热应激是影响畜禽健康最为主要的环境影响因素之一。【前人研究进展】笔者所在课题组近年来初步探讨了偏热环境对肉鸡生理、行为、物质代谢、肠道菌群和生产性能等方面的影响。研究发现,26和30℃偏热处理影响肉鸡休息行为且30℃偏热处理显著升高肉鸡体核温度[2];持续偏热处理(26和31℃)影响肉鸡糖脂代谢及禽类解偶联蛋白(av UCP)m RNA表达,降低肉鸡生长性能,且不同偏热程度对肉鸡影响程度不同[3];持续偏热处理(26 和31℃)与 21 ℃相比,降低肉鸡盲肠菌群多样性[4]。脑肠肽是一类同时存在于中枢神经系统和胃肠道的胃肠肽类激素,以旁分泌、自分泌或内分泌等形式作用于胃肠效应细胞[5],调控着肠道运动、感觉、分泌等功能,由血液所携带的脑肠肽是胃肠道向脑内传递的重要化学信号。现已发现5-羟色胺(5-hydroxytryptamine,5-HT)、血管活性肽(vasoactive intestinal peptide,VIP)、P物质(substance P,SP)等脑肠肽与胃肠活动相关[6]。脑肠肽影响肠道菌群的多样性,VIP可以改善肠道微环境,促进肠道有益菌的定植[7]。反过来,肠道菌群及其代谢产物也影响脑肠肽的分泌[8],如产芽孢细菌(SP)及其代谢产物短链脂肪酸(SCFA)[9-10]可以影响5-HT的产生;肠道菌群紊乱可导致5-HT水平的失衡,而利用益生菌制剂后可以明显缓解5-HT的失衡[11]。可见,脑肠肽分泌与肠道菌群多样性之间存在着相互影响的关系。另外也发现,不同变温模式对脑肠肽和菌群的影响不一样,如长期热应激(31±1.5℃)影响胆囊收缩素(CCK)的表达[12]。急性热应激(35±1℃)发生时,脑肠肽(如促生长素Ghrelin和CCK)在对食欲的调节发挥重要的作用,尤其是腺胃、十二指肠和空肠中增加Ghrelin是导致采食量降低的重要原因[13]。【本研究切入点】目前有关环境温度对肉鸡肠道菌群的影响大多集中于32℃以上且通常采用恒温模式,但实际养殖过程中多数情况下环境温度都不是恒定的;近年来,主要研究热应激下脑肠肽(CCK与Ghrelin等)对机体摄食行为的控制作用,而有关环境温度对肉鸡血清脑肠肽5-HT、VIP和SP影响的相关研究尚未见报道。【拟解决的关键问题】本试验通过检测肉鸡血清脑肠肽的含量与盲肠菌群16SrDNA DGGE图谱分析,探讨日循环变化偏热环境对肉鸡血清脑肠肽和盲肠菌群多样性的变化。
1 材料与方法
研究于2016年10—11月在中国农业科学院北京畜牧兽医研究所动物营养学国家重点实验室昌平基地的人工环境控制舱完成。
1.1 试验动物与饲养管理
选取22d健康、体重相近爱拔益加(AA)肉鸡120只,随机分成2个处理组,每组6个重复,每个重复10只鸡(公母各5只)。试验在动物营养学国家重点实验室的环境控制舱内进行,温、湿度自动控制(精度±1℃、±7%),无风、24 h 光照。试验肉鸡均采用单层平养,所选用笼具为动物营养学国家重点实验室研发的单层平养笼具[14],自由采食与饮水,常规免疫。试验动物所用饲粮与文献[2-4]的试验配方一致。
1.2 试验设计
将2个处理组的肉鸡转入环境温度为21℃、相对湿度为60%的环境控制舱适应7d。29d时开始正式试验,试验组环境温度采用24h循环变温(26℃-29℃-32℃-29℃-26℃)见表1,相对湿度为60%;对照组环境温度恒定为21℃,相对湿度为60%,试验条件维持至试验结束,共计14d。
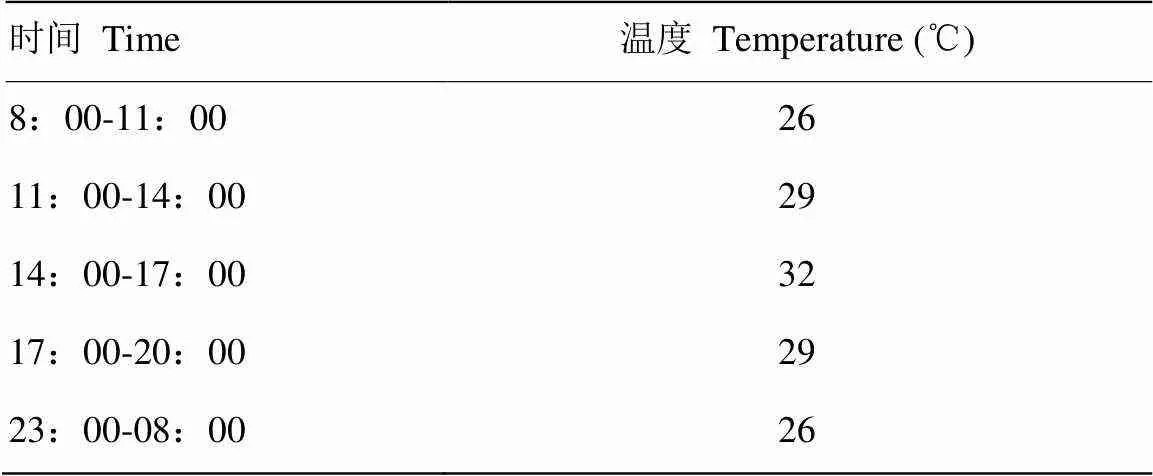
表1 环境温度变化时间表
1.3 测定指标与方法
1.3.1 血液采集与测定方法 分别于试验第7和14天,每组随机选取6只肉鸡(公母各半,每个重复1只肉鸡),肉鸡采用静脉采血,静置2h后,3 000r/min低温离心10min吸取血清,至-80℃冰箱保存。
采用酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA),委托北京方程生物科技有限公司测定血清中5-HT、VIP、SP的含量。
1.3.2 肠道样品的采集与测定方法
1.3.2.1 盲肠样品的收集 分别于试验第7和14天,每组随机选取6只肉鸡(公母各半,每个重复1只肉鸡)剪断颈静脉处死,全身消毒后剖开腹腔,分离肠道,结扎回盲交界处,剪下盲肠迅速移至超净工作台,用无菌剪刀剪开肠壁,收集盲肠内容物,将同一处理组的6个样品迅速混匀,装置无菌离心管中,液氮速冻,-80℃保存备用。
1.3.2.2 细菌16S rDNA片段的PCR扩增 以样品基因组 DNA 为模板,采用细菌通用引物 GC-338F 和 518R 扩增样品 16S rDNA 高变区序列,引物信息见表2。
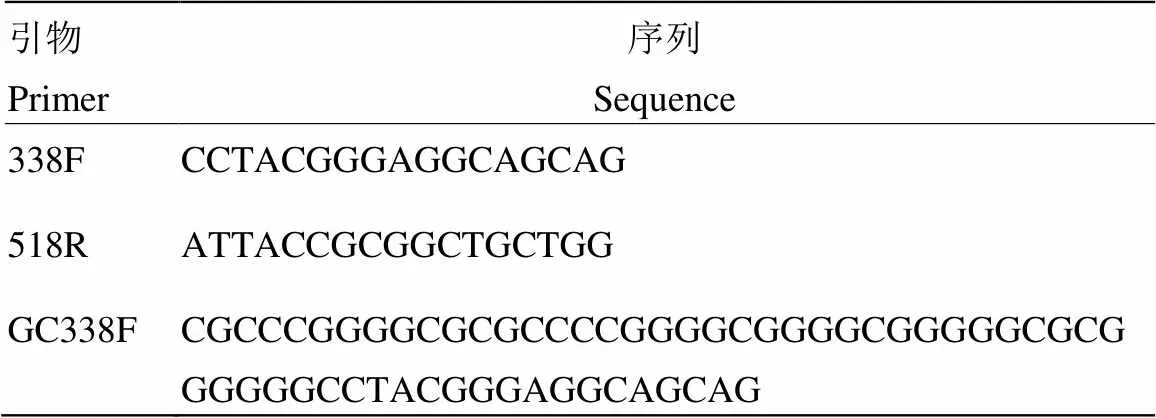
表2 引物信息
PCR 扩增体系(50 μL)为:10×PCR buffer 5 μL;dNTPMixture(2.5 mmol·L-1)3.2 μL;ExTaq(5 U·μL-1)0.4 μL;GC-338F(20 μmol·L-1)1 μL;518R(20 μmol·L-1)1 μL;模板 DNA 50 ng;补ddH2O至50 μL。
PCR 扩增程序为:94℃预变性 5 min;94℃变性 1 min,55℃复性 45 s,72℃延伸 1 min,30 个循环;最终 72℃延伸 10 min。
PCR产物采用OMEGA公司DNAGel Extraction Kit 纯化回收。
PCR 仪为 Biometra 公司生产的 T-gradient,凝胶成像仪为 Bio-Rad 公司的 Gel-Doc2000 凝胶成像系统。
1.3.2.3 PCR产物的变性梯度凝胶电泳(DGGE)分析取10 μL PCR 的产物进行变性梯度凝胶电泳(DGGE)分析。采用变性梯度为 35%—55%、浓度为 7%的聚丙烯酰胺凝胶在 1×TAE缓冲液中 150V 60℃下电泳5h。
变性梯度凝胶电泳(DGGE)完毕后、采用银染法染色、步骤如下:
a) 固定液(乙醇 50 mL、冰醋酸 2.5 mL、定容 500 mL)固定 15 min;
b) Milli-Q纯水清洗、20 s 和 2 min各一次;
c) 银染液(硝酸银 1 g、37%甲醛 0.75 mL、定容 500 mL)染色 15 min;
d) Milli-Q纯水清洗、20 s 和 2 min各一次;
e) 显色液(氢氧化钠 7.5 g、37%甲醛 2.5 mL、定容 500 mL)显色 5—7 min;
最后用终止液(乙醇 50 mL、冰醋酸 2.5 mL、定容 500 mL)终止反应。
1.3.2.4 DGGE 图谱中优势电泳条带的序列测定 DGGE 凝胶条带回收后,以338F/518R 为引物进行 PCR 扩增,PCR 产物纯化后连接到pMD18-T载体上,转化至DH5α感受态细胞中,筛选阳性克隆测序。测序结果与GenBank 中的序列进行比对,得到条带所代表的细菌类型。每个回收条带选取3个克隆进行了序列测定。
1.4 数据处理
试验数据使用SAS9.2统计分析软件进行单因素分析(One-way ANOVA),<0.05为差异显著;采用软件Quantity One分析DGGE图谱多样性。
2 结果
2.1 日循环变化偏热环境对肉鸡血清脑肠肽的影响
由表3可以看出,试验第7天时,日循环变化偏热环境组肉鸡血清5-HT含量显著高于21℃组(<0.05);而对照组和日循环变化偏热环境组肉鸡VIP和SP并无显著差异。试验第14天时,日循环变化偏热环境组肉鸡血清VIP含量显著低于对照组(<0.05),对照组和日循环变化偏热环境组肉鸡血清5-HT和SP并无显著差异。
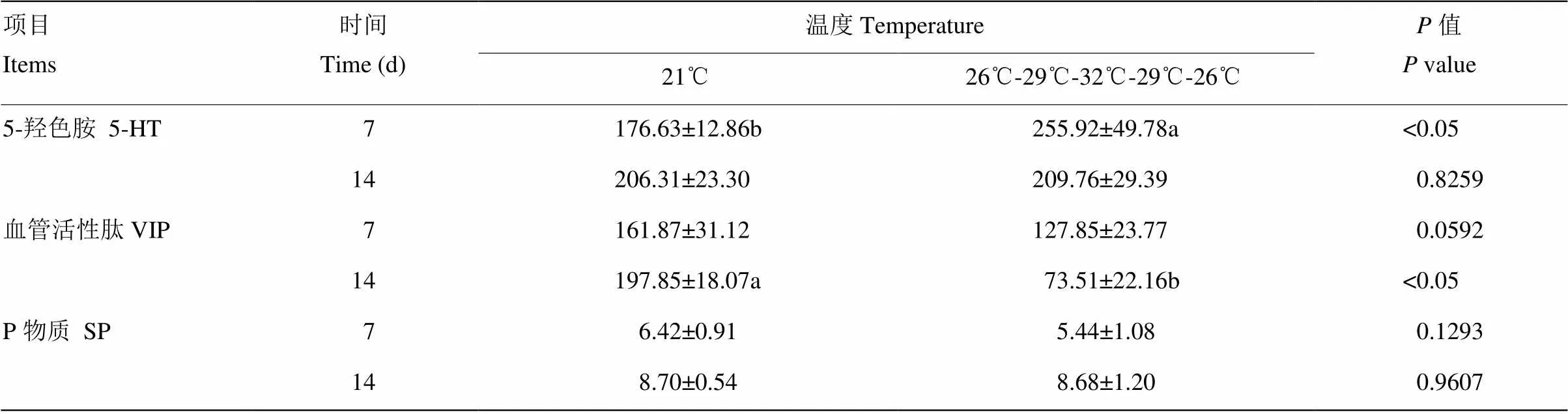
表3 日循环变化偏热环境对肉鸡血清脑肠肽的影响
同列数据无字母或相同字母表示差异不显著(>0.05) ,不同小写字母表示差异显著(<0.05)
In the same column, values with no letter or the same letter superscripts mean no significant difference (>0.05) ,while with different small letter superscripts mean significant difference (<0.05)
2.2 日循环变化偏热环境对肉鸡肠道菌群多样性的影响
2.2.1 肉鸡肠道菌群PCR-DGGE扩增指纹图谱 通过肉鸡肠道菌群PCR-DGGE指纹图谱(图1)可以看出,试验第7天,日循环变化偏热环境组较对照组细菌条带数减少2条;试验第14天,对照组和日循环化偏热环境组细菌条带数相同。
2.2.2 肉鸡肠道菌群结构多样性分析 由表4可以看出,试验第7天,对照组和日循环化偏热环境组细菌间的相似系数为79.9%;试验第14天,对照组和日循环化偏热环境组细菌间的相似系数为66.1%;试验第14天与第7天相比,日循环化偏热环境组细菌间相似系数下降。
2.2.3 肉鸡肠道特异性菌群和共性菌群分析 从肉鸡肠道菌群16S rDNA V3区PCR-DGGE指纹图谱中分别割胶回收了2条特异性条带和5条共性条带,由图1和表5可以看出,试验第7天和14天肉鸡盲肠内容物中均检测出共性条带:1号菌条带()、3号菌条带()、4号菌条带()、5号菌条带()和7号菌条带();日循环变化偏热环境处理后,肠道菌群发生变化,试验第14天较第7天,日循环化偏热环境组1、3和7号菌条带丰富度下降而4号和5号菌条带丰富度显著增加;且试验第14天日循环化偏热环境组并未检测出2号菌条带()和6号菌条带()
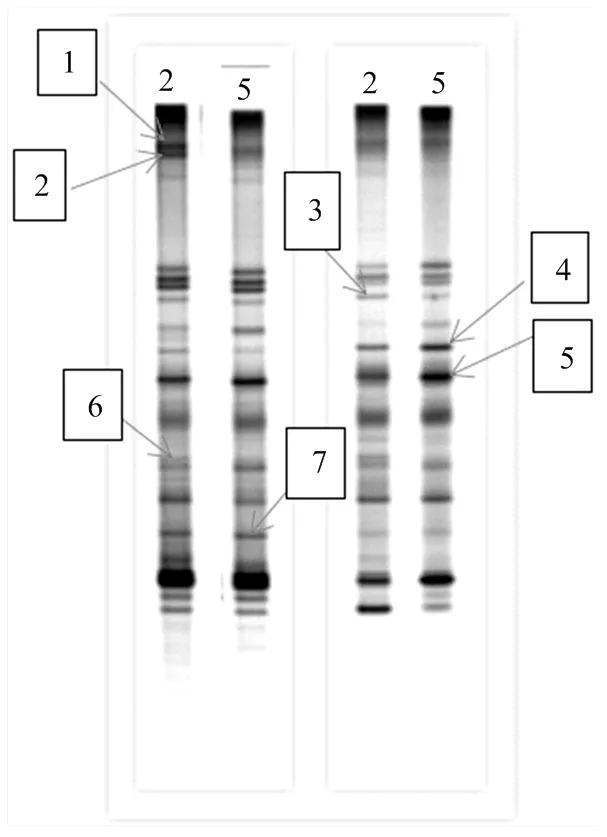
左图编号2代表为试验第7天对照组;编号5为试验第7天日循环变化偏热环境组;右图编号2为试验第14天对照组;第二个编号5为试验第14天日循环变化偏热环境组
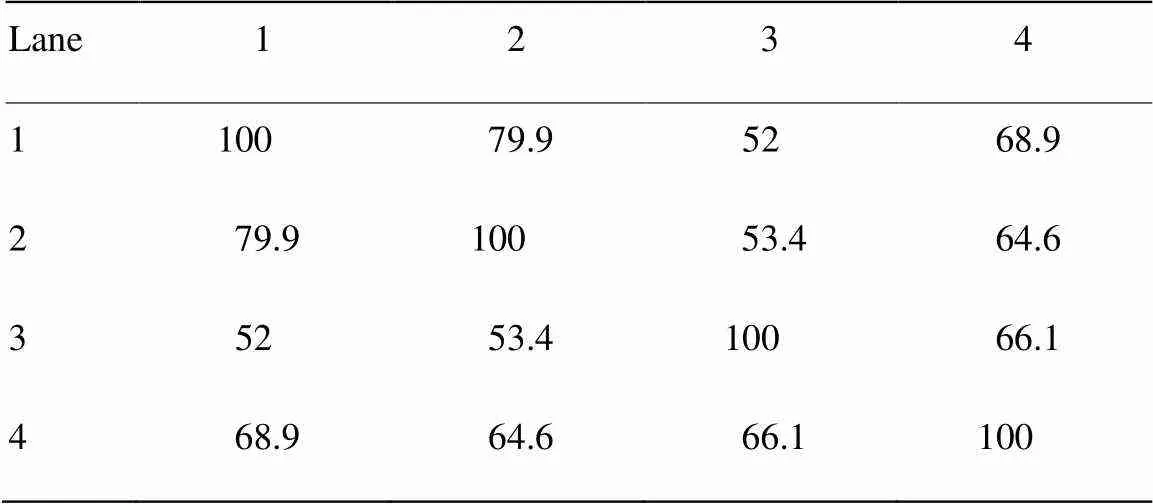
表4 戴斯系数比较PCR-DGGE图谱的相似性
1:试验第7天对照组;2:试验第7天日循环变化偏热环境组;3:试验第14天对照组;4:试验第14天日循环变化偏热环境组
1: Control group 7 d; 2: Treatment group 7 d; 3: Control group 14 d; 4: Treatment group 14 d
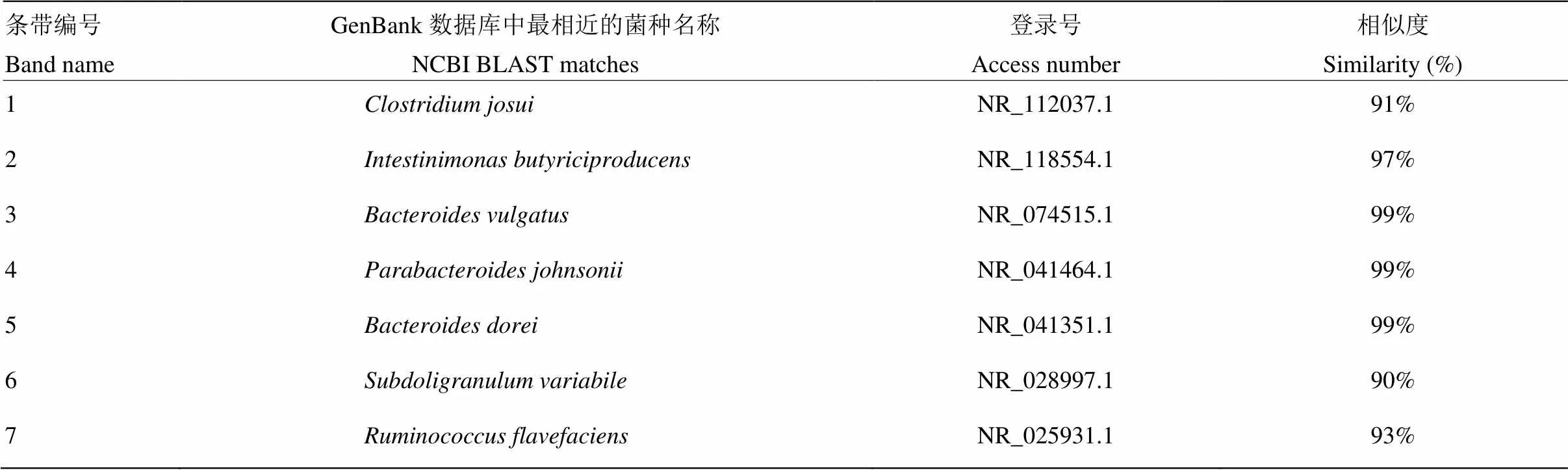
表5 DGGE 图谱中条带的基因片段序列比对
从测序结果可见,7条菌群序列均分布于厚壁菌门()和拟杆菌门(),与 GenBank 数据库中细菌的同源性绝大多数都在90%以上。
3 讨论
3.1 对肉鸡血清脑肠肽的影响
脑肠肽可以直接作用于中枢神经系统,由血液所携带的脑肠肽是胃肠道向脑内传递的重要化学信号,这些信号物质可以通过脑干的最后区直接入脑而作用于脑干迷走复合体,进而影响迷走神经的传出功能,参与胃肠运动、食欲及摄食功能的调节[15]。
5-羟色胺(5-hydroxytryptamine,5-HT),又名血清素(serotonin),是一种神经递质,也是重要的肠道生理调节器,主要由肠内分泌细胞产生,参与调解肠道运动、感觉,直接或间接刺激肠道分泌。本试验结果显示,试验第7天,日循环变化偏热环境组肉鸡血清5-HT含量显著高于对照组(<0.05),而试验第14天并无显著差异。由此可推断血清5-HT的增加可能会通过肠道分泌和运动的变化而引起肠道菌群的变化。
血管活性肠肽(vasoactive intestinal peptide,VIP)是一种非胆碱能非肾上腺素能抑制系统的神经递质,对胃肠活动起抑制性调节作用,引起全胃肠环形肌松弛[16]。研究报道,血管活性肠肽分泌神经元可刺激胰液和肠液分泌,保护肠黏膜,调节胃肠吸收[17]。此外还能改善肠黏膜组织微循环及内环境,为肠上皮细胞提供营养物质和氧,并清除过多的氧自由基等有害物质[18]。有研究表明,VIP含量减少,对肠道动力的抑制作用减小,致使肠道蠕动增强,改变肠道内环境。本试验结果得出,试验第7天和14天,日循环变化偏热环境组肉鸡血清VIP均低于对照组。从以上相关研究结果可以认为,本试验血管活性肠肽的下降可能将导致肠道内环境及菌群结构的变化。
P物质(substance P,SP)本身又是一种速激肽,可增加胃肠蠕动,强烈促消化道平滑肌收缩,加强结肠的集团推进运动,刺激小肠、结肠黏膜分泌水和电解质,使胃肠道的血管扩张,通透性增高,血浆外渗,并参与炎症过程和免疫反应[19]。该研究结果发现,试验第7和14天,两组肉鸡血清SP并无显著差异。
3.2 对肉鸡盲肠菌群多样性的影响
早先研究表明肉鸡盲肠肠道内含有复杂的微生物菌群[20-23],主要以厚壁菌门()为主,其次为变形菌门()、拟杆菌门()和放线菌门()[24-25]。而家禽在生长发育过程中,温度过高改变家禽肠道微生物菌群结构[26]。研究报道,持续偏热环境(26℃和31℃)下肉鸡盲肠细菌条带数和菌群多样性下降[4]。本研究通过对肉鸡盲肠微生物进行图谱条带和多样性分析得出,第7天日循环变化偏热环境组较对照组,肉鸡盲肠细菌条带数下降,第14天日循环变化偏热环境组和对照组细菌条带数相同但细菌间相似性下降,结果表明日循环变化偏热环境影响肉鸡盲肠菌群平衡,且随着偏热环境时间的增加,对菌群结构的影响增大。
据报道,肉鸡暴露于34—38℃下,热应激导致拟杆菌属、柔嫩梭菌属、颤螺菌属、梭菌属、考拉杆菌属、萨特氏菌属、Dorea 丰度比例降低;而毛螺旋菌科和瘤胃菌科的瘤胃球菌属、厌氧原体属、丰度比例增加[27]。本研究发现试验第14天日循环变化偏热环境组和丰度下降而和丰度显著增加,同时日循环变化偏热环境组不利于和的定植。和属于拟杆菌门,拟杆菌门是肠道革兰氏阴性菌中数量最大的一类细菌,产降解植物细胞壁的酶,参与植物细胞壁的降解,从而与肠道的消化功能有关。和属于厚壁菌门,研究表明,后肠微生物区系中的优势菌群是厚壁门菌,其含量大约占60%—70%,其中丁酸盐产生菌对肠上皮细胞的发育具有重要作用[28],而宿主肠道内丁酸盐产生菌大多来自厚壁菌门中的柔嫩梭菌类群(IV)和球状梭菌类群(XIVa)。瘤胃球菌()是最重要的一种可水解纤维素的细菌,它通过一系列可被纤维素衍生物抑制的作用机制吸附在纤维素上,进而参与纤维素的降解消化,在肠道的消化功能上起到重要作用[29]。在肉鸡肠道内的作用机制有待进一步研究探讨。
3.3 盲肠菌群多样性与脑肠肽分泌的关系
肠道内既定植着400—1 000种细菌,总数达一百万亿,是人体自身细胞总数的10倍[30-31],这些细菌具有维持宿主肠道微生态平衡、调节肠道动力、提高免疫功能、影响营养物质的吸收等多种重要的生理功能[32-36];同时肠道也是人体最大的内分泌器官,能分泌胃泌素、胃动素、胆囊收缩素等多种肽类激素。有研究表明[7-11],肠道菌群结构和种类与脑肠肽分泌之间存在相互影响的关系。5-HT的产生受到肠道菌群及其代谢产物影响,特别是产芽孢细菌(SP)和短链脂肪酸(SCFA)[8-9]。宿主肠道内SCFA丁酸盐产生菌大多来自厚壁菌门中的柔嫩梭菌类群,而丁酸盐产生菌对肠上皮细胞的发育具有重要作用;来自健康老鼠和人类微生物群的固有的SP促进结肠EC产生5-HT[37]。据报道,在生命早期缺乏菌群的时候,会导致血浆色氨酸水平的升高[38]。还有研究表明双歧杆菌可以影响色氨酸的代谢[39],口服婴儿双歧杆菌可诱导大鼠神经递质多巴胺、5-HT血浆浓度升高[40]。肠道菌群紊乱可导致5-HT水平的失衡,而利用益生菌制剂后可以明显缓解5-HT失调的症状[11]。反过来,脑肠肽也会影响菌群的多样性。VIP可以改善肠道微环境,减少脂多糖对肠黏膜的损伤,促进有益菌的定植使菌群比例恢复正常[7]。以上结果说明,本试验得出的5-HT和VIP含量的变化与肉鸡菌群多样性的变化是有关系的,但是5-HT含量的增加和VIP含量降低与细菌菌群结构变化(和的增加,以及和的减少)的确切关系还需进一步研究。
4 结论
4.1 日循环变化偏热环境升高血清5-HT含量,降低血清VIP含量。
4.2 日循环变化偏热环境降低肉鸡盲肠细菌多样性,改变菌群结构,促进和的生长,抑制和的定植。且随着日循环偏热环境作用时间的延长,肉鸡盲肠菌群相似性差异增大。
[1] SUN Y, ZHANG M, CHEN C C, III M G, SUN X, ELZAATARI M, HUFFNAGLE G B, YOUNG V B, ZHANG J J, HONG S C, MING Y. Stress-induced corticotropin-releasing hormone-mediated NLRP6 inflammasome inhibition and transmissible enteritis in mice., 2013, 144(7): 1478-1487.
[2] 胡春红, 张敏红, 冯京海, 苏红光, 张少帅. 偏热刺激对肉鸡休息行为, 生理及生产性能的影响. 动物营养学报, 2015, 27(7): 2070-2076.
HU C H, ZHANG M H, FENG J H, SU H G, ZHANG S S. Effects of thermal stimulation on behavior of resting posture, physiology and performance in broilers., 2015, 27(7): 2070-2076. (in Chinese)
[3] 甄龙, 石玉祥, 张敏红, 冯京海, 张少帅, 彭骞骞. 持续偏热环境对肉鸡生长性能, 糖脂代谢及解偶联蛋白 mRNA 表达的影响. 动物营养学报, 2015, 27(7): 2060-2069.
ZHEN L, SHI Y X, ZHANG M H, FENG J H, ZHANG S S, PENG Q Q. Effects of constant moderate temperatures on performance, glucose and lipid metabolism, expression of uncoupling protein of broilers., 2015, 27(7): 2060-2069. (in Chinese)
[4] 彭骞骞, 王雪敏, 张敏红, 冯京海, 甄龙, 张少帅. 持续偏热环境对肉鸡盲肠菌群多样性的影响. 中国农业科学, 2016, 49(01): 186-194.
PENG Q Q, WANG X M, ZHANG M H, FENG J H, ZHEN L, ZHANG S S. Effects of constant moderate temperatures on Cecal microflora diversity of broilers., 2016, 49(01): 186-194. (in Chinese)
[5] 陆英杰, 连至诚. 胃肠激素对胃肠动力的影响. 免疫学杂志, 2008 (z1): 94-96.
LU Y J, LIAN Z C. Effects of gastrointestinal hormones no gastrointestinal motility., 2008 (z1): 94-96. (in Chinese)
[6] 陈倩. 隔药灸脐法对脾气虚型肠易激综合征患者血清脑肠肽影响的临床研究[D]. 济南: 山东中医药大学, 2004.
CHEN Q. Clinical study on patient’ blood serum brain-gut peptides with herbs-isolated umbillical moxibustion in treating Irritable Bowel Syndrome of Spleen Qi-deficiency Type[D]. Jinan: Shandong University of Traditional Chinese Medicine, 2004. (in Chinese)
[7] CAMPOS-SALINAS J, CAVAZZUTI A, O'VALLE F, FORTE- LAGO I, CARO M, BEVERLEY S M, DELGADO M. Therapeutic efficacy of stable analogues of vasoactive intestinal peptide against pathogens., 2014, 289(21): 14583-14599.
[8] LYTE M. Microbial endocrinology in the microbiome-gut-brain axis: how bacterial production and utilization of neurochemicals influence behavior., 2013, 9(11): e1003726.
[9] Yano J M, Yu K, Donaldson G P, SHASTRI G G, MA L, HSIAO E Y. Indigenous bacteria from the gut microbiota regulate host serotonin biosynthesis., 2015, 161(2): 264-276.
[10] Reigstad C S, Salmonson C E, Rainey III J F, LINDEN D R, SONIYENGURG J L, KASHYAP P C. Gut microbes promote colonic serotonin production through an effect of short-chain fatty acids on enterochromaffin cells., 2014, 29(4): 1395-1403.
[11] SJÖGREN K, ENGDAHL C, Henning P. The gut microbiota regulates bone mass in mice., 2012, 27(6): 1357-1367.
[12] SONG Z, LIU L, SHEIKHAHMADI A, JIAO H C, LIN H. Effect of heat exposure on gene expression of feed intake regulatory peptides in laying hens., 2012, 2012.
[13] 姚泰, 吴博威. 生理学. 第六版. 北京: 人民卫生出版社, 2004.
YAO T, WU B W.. Sixth Edition. Beijing: People's Health Press, 2004. (in Chinese)
[14] 张敏红, 苏红光, 冯京海. 采集用于建立肉鸡生活环境舒适性评价模型数据的方法和专用装置: 中国, CN103404447A[P]. 2015-11-18.
ZHANG M H, SU H G, FENG J H, TANG X F. The method of collecting chickens living environment for establishing comfort evaluation model data and special equipment: China, CN103404447A [P]. 2015-11-18. (in Chinese)
[15] WANG L, ZHOU L, TIAN R. Role of the area postrema of medullaoblongata in the regulation of canine interdigesting migrating motorcomple., 2002, 115( 3) : 384-388.
[16] 崔莉红. 胃肠激素对结肠运动的调节作用. 医学综述, 2008, 14(3): 380-382.
Cui L H. Effect of gastrointestinal hormones on colonic motility., 2008, 14(3): 380-382. (in Chinese)
[17] NUSSDORFER G G, MALENDOWICZ L K. Role of VIP, PACAP, and related peptides in the regulation of the hypothalamo— pituitary–adrenal axis., 1998, 19(8): 1443-1467.
[18] 吴美玉, 胡团敏. 血管活性肠肽与消化系疾病的研究进展. 世界华人消化杂志, 2012, 20(16): 1453-1457.
WU M Y, HU T M. Research progress of vasoactive intestinal peptide and digestive system diseases., 2012, 20(16): 1453-1457. (in Chinese)
[19] 陈晓敏, 张燕华, 吴跃龙. 肠易激综合征结肠黏膜 P 物质和血管活性肠肽变化的研究. 实用临床医药杂志, 2008, 12(11): 31-33.
CHEN X M, ZHANG Y H, WU Y L. Changes of colonic substance P and vasoactive intestinal polypeptide in irritable bowel syndrome., 2008, 12(11): 31-33. (in Chinese)
[20] BARNES E M, MEAD G C, BARNUML D A, HARRY E G. The intestinal flora of the chicken in the period 2 to 6 weeks of age, with particular reference to the anaerobic bacteria., 1972, 13(3): 311-326.
[21] BARNES E M. The intestinal microflora of poultry and game birds during life and after storage., 1979, 46(3): 407-419.
[22] MEAD G C, ADAMS B W. Some observations on the caecal micro‐flora of the chick during the first two weeks of life., 1975, 16(2): 169-176.
[23] SALANITRO J P, FAIRCHILDS I G, ZGORNICKI Y D. Isolation, culture characteristics, and identification of anaerobic bacteria from the chicken cecum., 1974, 27(4): 678-687.
[24] GONG J, SI W, FORSTER R J, HUANG R, YU H, YIN Y L, YANG C B, HAN Y M. 16S rRNA gene-based analysis of mucosa-associated bacterial community and phylogeny in the chicken gastrointestinal tracts: from crops to ceca., 2006, 59(1): 147-157.
[25] 王丽凤. 益生菌 L. plantarum P-8 对肉鸡肠道菌群, 肠道免疫和生长性能影响的研究[D]. 呼和浩特: 内蒙古农业大学, 2014.
WANG L F. Effect of probiotic L. plantarum P-8 on gut microbiota, intestinal immunity and growth performance of broiler[D]. Hohhot: Agricultural University of the Inner Mongol, 2014. (in Chinese)
[26] BURKHOLDER K M, THOMPSON K L, EINSTEIN M E, APPLEGATE T J, PATTERSON J A. Influence of stressors on normal intestinal microbiota, intestinal morphology, and susceptibility to Salmonella enteritidis colonization in broilers., 2008, 87(9): 1734-1741.
[27] 杨梅梅. 中药复方与益生素对热应激下肉鸡肠道菌群及生长的影响[D]. 广州;华南农业大学, 2016.
YANG M M. Effect of Traditional Chinese Medicine Compound and probiotics on the intestinal bacteria and growth performance of broiler under heat stress[D]. Dissertation for Master degree. Guangzhou; Agricultural University of South China, 2016. (in Chinese)
[28] PRYDE S E, DUNCAN S H, HOLD G L, STEWART C S, FLINT H J. The microbiology of butyrate formation in the human colon., 2002, 217: 133-139.
[29] MORRIS E J, COLE O J. Relationship between cellulolytic activity and adhesion to cellulose in., 1987, 133(4): 1023-1032.
[30] QIN J, LI R, RAES J, ARUMUGAM M, BURGDORF K S, MANICHANH C, MENDE D R. A human gut microbial gene catalogue established by metagenomic sequencing.e, 2010, 464(7285): 59.
[31] LEY R E, PETERSON D A, GORDON J I. Ecological and evolutionary forces shaping microbial diversity in the human intestine., 2006, 124(4): 837-848.
[32] BROWN E M, SADARANGANI M, FINLAY B B. The role of the immune system in governing host-microbe interactions in the intestine., 2013, 14(7): 660.
[33] TATTOLI I, PETITTA C, SCIROCCO A, AMMDSCATO F, CICENI A, SEVERI C E. Microbiota, innate immune system, and gastrointestinal muscle: ongoing studies., 2012, 46: S6-S11.
[34] YU X Y, YIN H H, ZHU J C. Increased gut absorptive capacity in rats with severe head injury after feeding with probiotics., 2011, 27(1): 100-107.
[35] SUN B, HU C, FANG H, ZHU L, GAO N, ZHU J. The effects of Lactobacillus acidophilus on the intestinal smooth muscle contraction through PKC/MLCK/MLC signaling pathway in TBI mouse model., 2015, 10(6): e0128214.
[36] TAN M, ZHU J C, DU J, ZHANG L M, YIN H H. Effects of probiotics on serum levels of Th1/Th2 cytokine and clinical outcomes in severe traumatic brain-injured patients: a prospective randomized pilot study., 2011, 15(6): R290.
[37] TSAVKELOVA E A, KLIMOVA S Y, CHERDYNTSEVA T A, NETRUSOV A I. Hormones and hormone-like substances of microorganisms: a review., 2006, 42(3): 229-235.
[38] 白宇, 胡云霞, 陈俊伟, 于希忠, 方南元. 细菌-脑-肠轴理论体系的建立. 东南大学学报: 医学版, 2016, 35( 5) : 781-785.
Bai Y, Hu Y X, Chen J W, Yu X Z, Fang N Y. Establishment of a theory system of bacterial brain gut axis., 2016, 35( 5) : 781-785. (in Chinese)
[39] DESBONNET L, GARRETT L, CLARKE G, BIENENSTOCK J, DINAN T G. The probiotic: an assessment of potential antidepressant properties in the rat., 2008, 43(2): 164-174.
[40] DESBONNET L, GARRETT L, CLARKE G, KIELY B, CRYAN J F, DINAN T G. Effects of the probioticin the maternal separation model of depression., 2010, 170(4): 1179-1188.
(责任编辑 林鉴非)
Effects of the Daily Cycle Variation of the Moderate Ambient Temperatures on the Serum Brain Gut Peptide and the Diversity of Caecal Microflora in Broilers
CHANG ShuangShuang1,2, LI Meng1, LI XiuMei1, SHI YuXiang2, ZHANG MinHong1, FENG JingHai1
(1State Key Laboratory of Animal Nutrition, Institute of Animal Sciences, Chinese Academy of Agricultural Sciences, Beijing 100193;2College of Agriculture, Hebei University of Engineering, Handan 056021, Hebei)
【Objective】Stress can alter the function of brain - gut axis and the structure of intestinal flora, among which heat stress is one of the most important environmental factors affecting the health of livestock and poultry. This study was carried out to investigate the effects of the daily cycle variation of the moderate ambient temperatures on the serum brain gut peptide and the diversity of caecal microflora in broilers, and to provide a theoretical basis for the healthy broiler breeding mode. 【Method】 The study included trials with Arbor Acres (AA) broilers. At the 22d, 120broilers with equal average body weights were selected, randomly divided into 2treatments × 6 replicates of 10 birds each(male and female half and half) . The pretest period lasted for 7 days and broilers were kept at 21℃ and 60% relative humidity. When the chickens were aged 29 days, formal tests began. The environmental temperature was changed by 24h cycle (26 -29, -32, -26, -29), and the relative humidity was set to 35%, 60%, 85%, respectively. Both kept constant until the end of the experiment. The trial period lasted for 14 days. On day 21 and 42, one birds from each replicate were randomly selected and killed. The broiler was sampled with jugular vein. The contents of 5-HT, VIP and CCK in serum of broilers were measured with Elisa kit. Meanwhile cecal contents were aseptically collected, placed in a centrifugal tube, rapidly frozen in liquid nitrogen, and stored at -80℃. The effect of different humidity on serum brain gut peptide and bacterial diversity in the ceacal digesta of broilers at the daily cycle variation of the moderate ambient temperatures was studied by using 16S r DNA-based denaturing gradient gel electrophoresis (DGGE). 【Result】(1) At the 7d , the content of Serum 5-HT at the daily cycle variation of the moderate ambient temperatures was higher than control group (<0.05); the content of serum 5-HT and VIP in the control group and were no significant difference; at the 14d, the content of serum VIP in broilers at the daily cycle variation of the moderate ambient temperatures was lower than the control group (<0.05); the content of serum 5-HT and SP in the control group and were no significant difference. (2)At the 7d, the bacteria bands at the daily cycle variation of the moderate ambient temperatures were lower than the control group; at the 14d, the bacteria bands at the daily cycle variation of the moderate ambient temperatures and the control group were same, but broiler cecal microflora diversity decreased at the daily cycle variation of the moderate ambient temperatures. (3) Common microflora of broiler cecum includedand; The daily cycle variation of the moderate ambient temperatures was beneficial to the growth ofand, and inhibited the colonization ofand.【Conclusion】Compared with the control group, at the 7d, the content of serum 5-HT in broilers increased at the daily cycle variation of the moderate ambient temperatures , and at the 7d, the serum VIP content in broilers decreased at the daily cycle variation of the moderate ambient temperatures , and there was no significant difference in SP between the two groups; The daily cycle variation of the moderate ambient temperatures affected the cecal microflora structure and diversity in broilers.
broiler; moderate temperatures; serum brain gut peptide; caecal microflora
2018-02-21;
2018-09-12
国家重点研发计划课题“肉禽舒适环境的适宜参数及限值研究”(2016YFD0500509);中国农业科学院科技创新工程(ASTIP-IAS07)
常双双,Tel:15733078872;E-mail:2403486624@qq.com。
张敏红,Tel:010-62895517;E-mail:zmh66@126.com
10.3864/j.issn.0578-1752.2018.22.014
