细胞学方法评价南美草药阿萨伊的寒热药性
林伟明 王子晨 吴文敬 费文婷 张建军 熊 平
(1 华南农业大学制药工程系,广州,510640; 2 北京中医药大学中医学院,北京,100029)
阿萨伊(英文名:Açaí),又名巴西莓,来源于棕榈科植物阿萨伊棕榈树EuterpeOleraceaeMart.的新鲜果实。据当地医学记载[1-3],阿萨伊在巴西亚马逊流域地区被用作食物和治疗多种疾病的草药已有几百年的历史。现代研究认为,阿萨伊有抗氧化、抗炎、免疫调节、抗辐射损伤、降脂、降糖、解酒保肝等作用[4],且富含多种营养成分,具有类似于我国中草药的基本特征。
近十年来,随着全球人口流动日趋频繁,阿萨伊被引入中国,并在2013年被批准为新资源食品,但当前国内对阿萨伊的研究还较少,已有的报道主要集中在抗氧化、对酒精性肝损伤和辐射损伤的防护作用[5-7]。尽管阿萨伊有独特的药用价值,但若将此种外来天然药用资源融入到中草药资源中,并有效推广应用到临床,仍要遵循中医药基础理论,对阿萨伊开展“中药化”研究,阐释阿萨伊的药性,而药性中寒热属性则是要阐释的关键问题。
关于中药寒热药性的判别,近代探索基本建立在药理药效的差异上。随着现代科技的发展,中药寒热药性的辨识研究方法渐趋多样[8]。对于南美草药阿萨伊的药性分析上,目前王林元等学者[9]已通过动物体内实验,在药理药效差异方面作了较为深入的研究。而本研究采用细胞学的研究方法,通过同类比较阿萨伊以及传统寒凉中药黄柏对2种人肝癌细胞株HepG2和Hep3B在生长增殖和能量代谢等方面的影响,从体外角度论证阿萨伊的寒热药性,为阿萨伊药性鉴别提供更多科学依据。
1 材料与方法
1.1 材料
1.1.1 细胞 人肝癌细胞株HepG2,由广东省疾病预防控制中心捐赠;人肝癌细胞株Hep3B,由暨南大学药学院捐赠。
1.1.2 药物 阿萨伊粉,产自巴西帕拉州,由北京中医药大学张建军教授提供。黄柏配方颗粒(购于北京康仁堂药业有限公司,批号:15015431)。
1.1.3 试剂与仪器 高糖型DMEM细胞培养基,赛默飞世尔生物化学制品北京有限公司;胎牛血清,杭州四季青生物工程材料有限公司;青链霉素双抗、噻唑蓝(MTT)、台盼蓝,北京普博欣生物科技有限公司;辅酶INAD(H)试剂盒,南京建成生物工程研究所;FC-18R台式高速冷冻离心机,广州市方统生物科技有限公司;Sim FD8-6P真空冷冻干燥机,西盟国际公司;新芝JY92-IIN超声波细胞破碎仪,宁波新芝生物科技股份有限公司;Thermo HERAcell 240i全能型控温湿CO2细胞培养箱,Thermo Varioskan Flash全波长多功能酶标仪,赛默飞世尔科技(中国)有限公司,SkanIt RE for Varioskan Flash 2.4.3分析软件;OLYMPUS IX51倒置生物显微镜,上海普赫光电科技有限公司;NIS-Elements F/Viewer图像分析软件,上海成贯仪器有限公司。
1.2 方法
1.2.2 给药方法
1.2.2.1 受试物前处理 阿莎伊前处理:将8 g阿萨伊粉溶解于80 mL灭菌纯水中,4 ℃以10 000 r/min离心30 min,取上清液,按同法对沉淀重复处理1次,合并上清液,置于-80 ℃预冻24 h,然后真空冷冻干燥,48 h后收集冻干粉,密封,常温保存。
黄柏前处理:精确称取黄柏配方颗粒3.60 g,由20 g黄柏饮片制成(每1 g颗粒约相当于5.56 g饮片),加水适量,煎煮3次,30 min/次,合并煎液,浓缩,在4 ℃以10 000 r/min离心30 min,收集上清液,其余操作同阿莎伊前处理。
1.2.2.2 受试溶液的配制 精确称取100 mg经前处理的阿萨伊和黄柏,分别溶于10 mL细胞培养基中,35 kHz功率超声10 min,经0.22 μm滤膜过滤,制备10 mg/mL浓度的阿莎伊和黄柏受试母液,1 mL灭菌离心管分装,置于4 ℃保存。使用时,用细胞完全培养基将2种母液依次稀释成100、40、20、10、5、2、1、0.5、0.25 μg/mL浓度梯度的受试液,4 ℃保存,用于细胞生长增殖试验;另将二者受试母液分别稀释为100、50、25 μg/mL浓度梯度的受试溶液,4 ℃保存,用于细胞能量代谢试验。
1.2.3 检测指标与方法
1.2.3.1 细胞复苏与接种 将HepG2和Hep3B 2种人源肝癌细胞株复苏,接种于9 cm培养皿上,置于37 ℃、5% CO2细胞培养箱孵育1 h,观察细胞生长情况。24 h后若单层细胞覆盖培养皿80%以上,进行细胞传代。持续传5代,至细胞生长、代谢稳定,观察细胞贴壁生长情况。
1.2.3.2 对细胞生长增殖的影响 1)分组与处理:实验以黄柏受试溶液为阳性对照,分为8个不同浓度黄柏受试组、8个不同浓度阿萨伊受试组、空白对照组和调零组,除空白对照组和调零组设6个复孔外,其余各组3个复孔。取96孔板,200 μL培养液/每孔中接种104个细胞,将细胞置于37 ℃、5%CO2细胞培养箱中孵育24 h,待细胞贴壁后,弃培养基,每孔加入200 μL相应浓度受试溶液处理,空白对照组和调零组加入200 μL培养基,换液后继续孵育48 h。2)细胞增殖抑制试验:孵育48 h后,弃培养基,各组按180 μL/孔更换细胞培养基,同时每孔加入20 μL 5 mg/mL MTT溶液,轻轻吹打混匀,置于37 ℃ CO2培养箱中孵育4 h。取出细胞培养板,各孔弃去上清液后,加入150 μL DMSO,以60次/min的频率震荡10 min,采用酶标仪以检测波长490 nm测定各孔吸光度(A)值,并计算细胞增殖抑制率(抑制率=(1-受试组A值÷空白对照组A值)×100%)。抑制率为正值,表示药物对细胞增殖有抑制作用;抑制率为负值,表示药物对细胞增殖有促进作用。实验重复3次。3)细胞生长形态观察:按“2.2.1”项下操作方法,细胞经阿萨伊受试液处理48 h后,从37 ℃ CO2细胞培养箱中取出,各组按每孔200 μL更换细胞培养基,采用倒置相差光学显微镜4倍物镜选定视野,于10倍物镜下观察并记录各组细胞生长状况及形态变化情况。4)台盼蓝染色排斥试验:按“2.2.1”项下操作方法,细胞经阿萨伊受试液处理48 h后,从37 ℃ CO2细胞培养箱中取出,各组每孔按180 μL更换培养基后,再加入20 μL 0.4%台盼蓝染液作用5 min,然后置于倒置相差显微镜4倍物镜下选定视野,于10倍物镜下进行镜检并拍照。
1.2.3.2 对细胞能量代谢的影响 1)分组与处理:取9 cm细胞培养皿进行试验,实验设置4个组,包括3个不同浓度的阿萨伊药液受试组和空白对照组。当HepG2和Hep3B人源型肝癌细胞株处于对数生长期时,弃培养液,用胰酶消化洗脱,收集细胞悬液以1000 r/min离心10 min,弃上清,用PBS洗涤细胞2~3次,1000 r/min离心10 min,弃洗液,用细胞培养基调整细胞密度为1.5×106/L,充分混匀后接种于9 cm培养皿,每个皿所含细胞总数为3×106个细胞,接种后将细胞置于37 ℃、5%CO2细胞培养箱中孵育24 h,待观察到细胞贴壁后,弃培养基,每皿加入6 mL含相应浓度阿萨伊溶液的培养液,空白对照组加入6 mL细胞培养液,然后将培养皿置于CO2细胞培养箱中孵育24 h。2)细胞NADH含量及NADH/NAD+比值的变化:按“辅酶I NAD(H)试剂盒说明书”的方法操作,提取2种细胞中的NADH和NAD+,分光光度法检测并计算细胞中2种物质的含量,以nmol/104 Cells表示,并计算NADH/NAD+比值。实验重复3次。

2 结果
2.1 阿萨伊对细胞生长增殖的影响结果 实验结果显示,设置的8个浓度的阿萨伊溶液均对HepG2和Hep3B细胞株的生长增殖产生不同程度的抑制作用,抑制效果与阳性对照药黄柏相似,表现在其抑制曲线随受试浓度的增大总体上均呈现上升趋势。而值得注意的是,阿萨伊对2种细胞株的抑制效应在低浓度均出现谷值,使该范围曲线呈现类似“V”型的趋势变化(如图1,2所示)。从阿萨伊药液对HepG2细胞株的剂量效应关系来看,当阿萨伊生药浓度≤0.5 μg/mL的低浓度和(或)≥10 μg/mL的高浓度范围时,与空白对照组比较,差异有统计学意义(P<0.05;P<0.01);从阿萨伊药液对Hep3B细胞株的剂量效应关系看,则在阿萨伊生药浓度≤1 μg/mL的低浓度以及≥5 μg/mL的高浓度范围时,与空白对照组比较,差异有统计学意义(P<0.05;P<0.01),高浓度时与阳性对照组的抑制效应相一致,结果见表1,2所示。由此可见,阿萨伊对2种细胞株的作用效果一致,并都呈现以抑制为主的效应,这种效应现象符合程薇薇等学者[10]提出的寒性药在高、低浓度给药剂量下均抑制细胞增殖的表现,因此,在对细胞生长增殖上可以判断阿萨伊的药性偏寒凉。
2.2 阿萨伊对细胞生长形态的影响结果 光镜观察结果如图3,4所示,未经处理的空白对照组HepG2和Hep3B细胞呈现成片堆积于整个细胞培养皿底部,细胞间紧密交汇连接,形态多为类圆形,因接触抑制脱落死亡的颗粒状褶皱细胞残骸随处可见(Hep3B细胞尤为明显);而经各浓度阳性药液(黄柏)处理48 h的HepG2和Hep3B细胞数量均有明显减少,细胞间连接明显较空白对照组细胞疏松,生长空间充足使细胞呈扁平不规则多边形铺展,颗粒感减弱,呈类圆形细胞形态明显少于未经处理细胞,悬浮的细胞残骸少见;经各浓度阿萨伊溶液处理48 h的2种细胞株生长形态与黄柏溶液处理的基本一致,同时,2种细胞株的生长疏松程度也基本与MTT试验中随药物浓度变化的结果相一致,≥10 μg/mL的高浓度阿莎伊组细胞显示出更少的细胞数量,不规则性形态更为显著,细胞稀疏散在生长。结果表明,在所设定浓度范围内,阿萨伊溶液对2种细胞株的作用与黄柏药液的效应相似,对受试细胞株均呈细胞增殖抑制作用,剂量效应关系明显。

表1 阿萨伊溶液对HepG2细胞增殖的影响
注:与空白对照组比较:*P<0.05,**P<0.01

表2 阿萨伊溶液对Hep3B细胞增殖的影响
注:与空白对照组比较:*P<0.05,**P<0.01
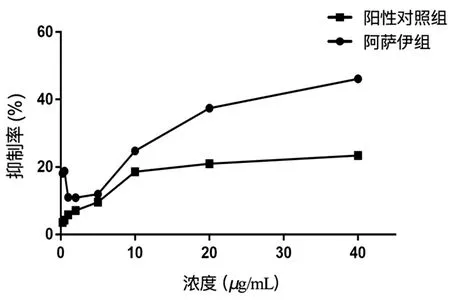
图1 HepG2细胞增殖抑制率曲线

图2 Hep3B细胞增殖抑制率曲线
2.3 阿萨伊对细胞株的毒性作用 台盼蓝染色排斥实验结果如图5,6所示,经不同浓度阳性药液处理的2种细胞株,经台盼蓝染色后,染成蓝色的细胞为颗粒状的脱落细胞,其在数量上少于空白对照组,经不同浓度阿萨伊溶液处理的2种细胞株染色情况与黄柏对照组基本一致。结果表明,阿萨伊溶液在所设浓度范围内对2种细胞株均无明显毒性作用。

图3 阿萨伊溶液对HepG2细胞生长和形态变化的影响(×10)
2.4 阿萨伊对细胞能量代谢的影响 细胞中NADH含量和NADH/NAD+比值的变化均能反映细胞糖酵解和三羧酸循环的强弱变化,即能量代谢变化情况。实验结果如表3,4和图7,8所示,3个受试浓度的阿萨伊溶液对HepG2和Hep3B 2种细胞株的NADH含量和NADH/NAD+比值均起到下调作用。其中,经阿萨伊溶液处理后的细胞中NADH/NAD+比值与空白对照组细胞比较,3个受试浓度的阿萨伊溶液均显著或极显著地降低了2种细胞株的NADH/NAD+比值,差异有统计学意义(P<0.05,P<0.01)。阿萨伊溶液的受试浓度与影响2种细胞中NADH含量和NADH/NAD+比值变化之间呈明显的正相关,阿萨伊下调效应在高浓度尤为显著。经阿萨伊处理后,2个指标的下降,提示受试细胞的糖酵解和三羧酸循环减弱,细胞的能量代谢下降,此时细胞呼吸耗氧量降低,细胞生长增殖受抑制。

图4 阿萨伊溶液对Hep3B细胞生长和形态变化的影响(×10)

图5 HepG2细胞的台盼蓝染色结果(×10)

图6 Hep3B细胞的台盼蓝染色结果(×10)

表3 阿萨伊溶液对HepG2细胞能量代谢的影响
注:与空白对照组比较,*P<0.05,**P<0.01
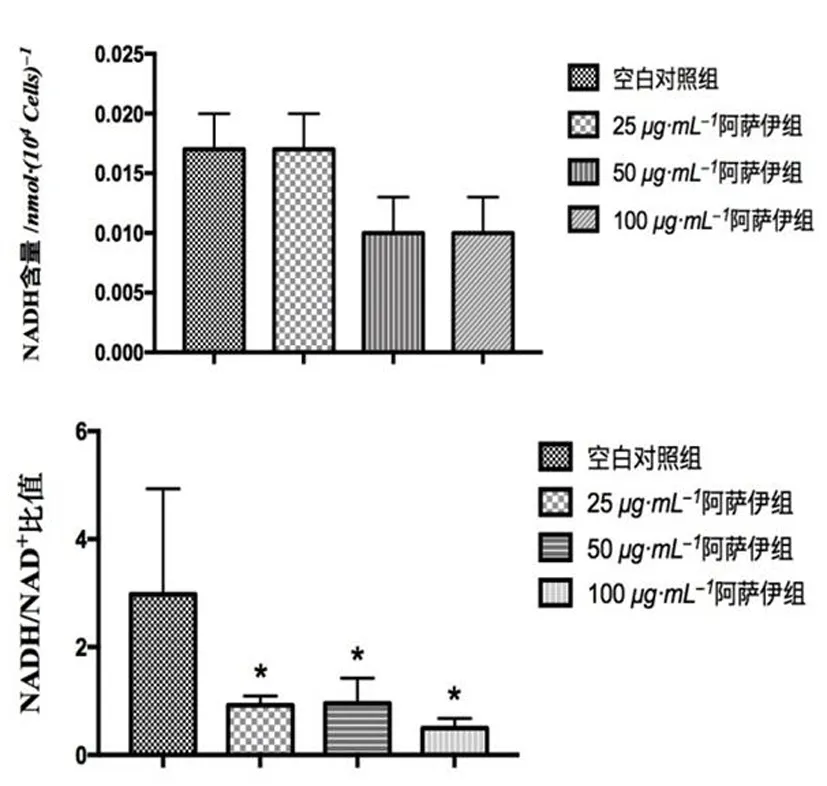
图7 HepG2细胞能量代谢变化

组别NADH含量/nmol·(104 Cells)-1NADH/NAD+空白对照组0.022±0.0112.225±0.06625 μg/mL阿萨伊组0.008±0.005*0.596±0.336**50 μg/mL阿萨伊组0.012±0.0030.652±0.283**100 μg/mL阿萨伊组0.004±0.005**0.154±0.136**
注:与空白对照组比较:*P<0.05,**P<0.01

图8 Hep3B细胞能量代谢变化
3 讨论
细胞学方法评价寒热药性基于药物效应特征,以细胞为材料,具有组间差异小,均一性强、重现性好的优点,并利于结合蛋白和基因表达差异、热动力学(能量)分析等方法,克服了整体动物实验个体差异明显,指标波动性大、实验周期长等缺陷。国内程薇薇等人[10]较早将细胞学方法用于药性的寒热分析,根据药物作用于细胞上的药效表现(如细胞增殖、生长状态等)来判别未知药性药物的寒热属性,提出了“热性药低浓度促进细胞生长、代谢和增殖,高浓度产生细胞毒性;寒性药低浓度则可产生无明显细胞毒性的抑制效果”的评价标准[10]。当前,还没有人采用细胞学方法对阿萨伊开展寒热药性的相关研究,因此,本文借鉴了中药药性研究的细胞模型方法[10-11],从另一个角度对阿萨伊的药性进行判别评价。
阿萨伊冻干粉为混合成分,针对其经前处理仍存在植物药特有褐色的问题,因此在实验受试剂量选取上进行了考察,预实验对1~400 μg/mL浓度梯度的阿萨伊药液进行了比色分析,选取了浓度间药液颜色差异小,浓度较低的0.25~40 μg/mL,以减少药物残留于贴壁细胞层造成颜色差异所带来的实验误差[12],并可排除热性药浓度过高时的细胞毒性作用所造成的假阳性结果[10],台盼蓝染色排斥试验结果说明,在0.25~40 μg/mL浓度范围内阿萨伊对肿瘤细胞的增殖抑制并不由细胞毒性所致。
阿萨伊的寒热药性经其传统应用推理为寒性[4]。王林元等通过动物实验,以地塞米松磷酸钠和氢化可的松琥珀酸分别对SD大鼠进行虚热和虚寒病证体质造模,检测造模并给药后大鼠血清中内分泌激素(T3,T4,rT3)、环核苷酸(cAMP,cGMP)和代谢标志物(TP,UA,TC,TG,ALB)等反映机体产热和代谢变化的生化指标,结合大鼠体重、毛色、精神状态、自主活动、寒热温度耐受及大便情况等改变,对比阳性药的作用,以同类比较、异类反证法验证了理论推导的阿萨伊的偏寒药性[9]。随后王子晨等也以同样的方法造模,基于大鼠血清当中的环核苷酸,去甲肾上腺素(NE)、多巴胺(DA)、多巴胺β羟化酶(D-β-H)等神经递质及相关酶,以及免疫球蛋白G(IgG)、免疫球蛋白M(IgM)、补体C3(C3)、补体C4(C4)等免疫分子水平的变化和大鼠体征变化,也从阿萨伊对模型鼠精神亢奋程度(神经系统)、体质和抗邪能力(免疫系统)以及在两系统间起媒介作用的第二信使的改善和调节作用中证实了阿萨伊的寒药偏性[13]。
同一中药药材往往会因提取方法的不同而导致其化学组成或指纹图谱发生改变,而药材的化学组成作为药物产生药效的基础,又与其药性尤其是寒热药性密切相关[14],所以提取方法会影响到药物的药性。在本实验中,阿萨伊受试药液以水为溶媒制备而成,未经过炮制加工处理,跟通常水提或煎煮使用方法相一致,基本保留了阿萨伊的主要化学成分,因此,本文以细胞学方法表征阿萨伊受试溶液的寒热药性可以代表南美草药阿萨伊本身的寒热药性。同时,本实验对阳性对照药物黄柏选用一致的药液制备方法、受试浓度范围和实验操作流程进行相关测试。黄柏在传统中药里面被公认为寒性药物,其性苦、寒,在本次实验中显示出其对人肝癌细胞株HepG2和Hep3B细胞增殖有显著抑制作用,并具有剂量效应正相关性,两细胞株的生长形态和染液排斥程度体现出寒性药对细胞生长的作用特征[10]。而阿萨伊对2种人源肝癌细胞株的增殖、生长形态及台盼蓝染色排斥反应的作用结果,则完全符合这种寒性药所体现的作用特征[10],提示阿萨伊的药性偏寒凉,对细胞毒性作用不明显,这与其传统应用推理和动物体内实验的结果[4,9,13]相一致。
另外,机体整体表征的产能产热变化为药物寒热药性的重要反映指标,热性药表现为机体兴奋作用,能量代谢和产热均被促进,而寒性药则表现为与此相反的抑制作用[8]。在细胞能量代谢上,经阿萨伊处理的2种模型细胞,其NADH含量和NADH/NAD+比值均明显下降,提示细胞功能活动下降,能量代谢降低。NADH是生物功能性分子烟酰胺腺嘌呤二核苷酸(辅酶I)的还原态,产生于糖酵解和三羧酸循环,它作为电子供体进一步参与到机体能量代谢过程中呼吸链的电子传递以及氧化磷酸化产生大量ATP的重要环节[15],由于氧化磷酸化为真核生物主要的产能产热过程,检测细胞中NADH的含量可间接反映糖酵解和三羧酸循环的强弱以及细胞能量代谢的活跃程度。NADH/NAD+比值不受NADH的含量差异的限制,可更有效反映细胞内能量代谢情况。该项检测同样可印证阿萨伊的寒药特性。
总之,本研究以同类比较法对比考察了阿萨伊对2种人源肝癌细胞株HepG2和Hep3B的细胞增殖影响,独立分析了其对两细胞株能量代谢影响的可能机制,综合认为阿萨伊具有寒凉的中药药性。在中药化学应用方面,阿萨伊可在传统中医药理论的指导下,单独或配伍运用到治疗热证疾病中,可改善机体的热证症状,具体的应用还需在临床中不断总结和验证。

