基于数据挖掘分析STK11基因在前列腺癌中的表达及意义
李 娟,曹 芳,苗 裔,刘培军
(西安交通大学第一附属医院 转化医学中心,陕西西安 710061)
前列腺癌(prostate cancer,PCa)是位于第3位的男性泌尿生殖系统恶性肿瘤,且发病率呈逐年上升趋势[1-2]。随着我国人口老龄化的加剧和饮食结构的改变,前列腺癌已经跃升为仅次于肺癌的男性第二大致死性肿瘤[3]。
随着肿瘤分子生物学的发展,现已揭示了部分前列腺的易感基因和与其发展密切相关的癌基因和抑癌基因,如RNASEL[4]、PTEN[5]、CDN1B[6]、RB[7]和KLF6[8]等。但是,前列腺癌的发生发展具有显著的复杂性和异质性,目前治疗手段也相对常规,缺乏十分有效的靶向性治疗。因此,进一步研究评估前列腺癌的预后指标及潜在治疗靶点是前列腺癌研究的重点。
能量代谢紊乱是肿瘤细胞区别于正常细胞的关键特征[9]。STK11-AMPK激酶是细胞能量代谢的关键感应及调节激酶[10],其下游的mTOR信号通路又可调节细胞极性、染色质稳定性和细胞干性等方面[11-12]。因此,我们选取STK11基因作为本文的研究目标。生物信息学数据库现已应用于医学基础研究、临床医学研究和药物研发等多个医学领域,成为评估临床诊断、预防和治疗的重要武器,鉴于大量的生物信息学数据,可以更加全面和准确地挖掘出更多与疾病相关的基因和诊断治疗靶点。本研究利用多种生物信息学数据库全面分析了STK11基因与PCa临床病理特征和预后的关系,揭示其在PCa中的治疗和预测价值。
1 材料与方法
1.1STK11基因与PCa预后的关系GEPIA网站 (http://gepia.cancer-pku.cn/index.html)是由北京大学开发的交互式web服务器,专门分析基因差异表达及与预后的相关性。基于该数据库的测序数据,我们统计分析了STK11表达量与PCa预后的相关性。
1.2STK11基因与PCa临床病理特征的关系LinkedOmics网站(http://www.linkedomics.org/login.php)包含了来自TCGA的32种癌症的多组数据。该网站有3个分析模块:LinkFinder、LinkInterpreter和LinkCompare。我们利用LinkFinder模块分析了STK11的mRNA表达水平与PCa临床病理特征的关系。
1.3STK11基因与前列腺癌恶性进程的关系GEO (Gene Expression Omnibus)(http://www.ncbi.nlm.nih.gov/projects/geo/)数据库收录了大量高通量测序的实验数据,其中包括以微阵列为基础的mRNA丰度测定、基因组DNA和蛋白质组的实验数据。GEO Profiles数据库是GEO中专门收录单个基因在一次试验中的表达定量数据。我们利用该数据库分析了STK11在不同种类前列腺癌中的mRNA表达水平,探讨其在前列腺癌恶性进程中的作用。
1.4STK11基因在不同等级PCa组织中的表达The Human Protein Atlas网站(https://www.proteinatlas.org)包含了基于转录组学和系统生物学、抗体的成像技术、基于质量光谱的蛋白质组学等多种信息,绘制了人类细胞、组织、器官内的所有蛋白质。我们引用网站中对不同等级PCa组织的免疫组化结果,分析了STK11在低等级和高等级PCa组织中的蛋白表达及定位。
1.5STK11基因的调控网络STRING数据库(https://string-db.org/)是专门研究已知蛋白和预测蛋白之间相互作用的数据库。该数据库预测的相互作用包括蛋白之间的直接物理相互作用和间接的功能相互作用。我们引用该网站预测了与STK11关系最为密切的10个相互作用蛋白。
1.6统计学方法GEPIA数据库中分析的STK11表达量与PCa预后相关性的数据,利用了Cox回归统计学方法。LinkedOmics数据库中分析的STK11的mRNA表达水平与PCa N分期的数据,应用Wilcox检验;分析的STK11的mRNA表达水平与PCa T分期和淋巴结转移的数据,应用Kruskal-Waillis检验。
2 结 果
2.1STK11表达与PCa临床病理特征的相关性利用LinkedOmics数据库分析了STK11基因的mRNA与PCa临床病理特征的相关性,结果显示:STK11的表达量与T分期(P=0.007,n=490)呈显著正相关性(图1A),T3型前列腺癌中的STK11表达量高于T2型前列腺癌;STK11的表达量与N分期(P=0.000 8,n=424)和淋巴结转移个数(P=0.002,n=406)呈显著正相关性(图1B、C),发生淋巴结转移的前列腺癌中STK11表达量高于无淋巴结转移的前列腺癌,并且随着转移淋巴结个数的增加,STK11的表达量也逐渐增加。
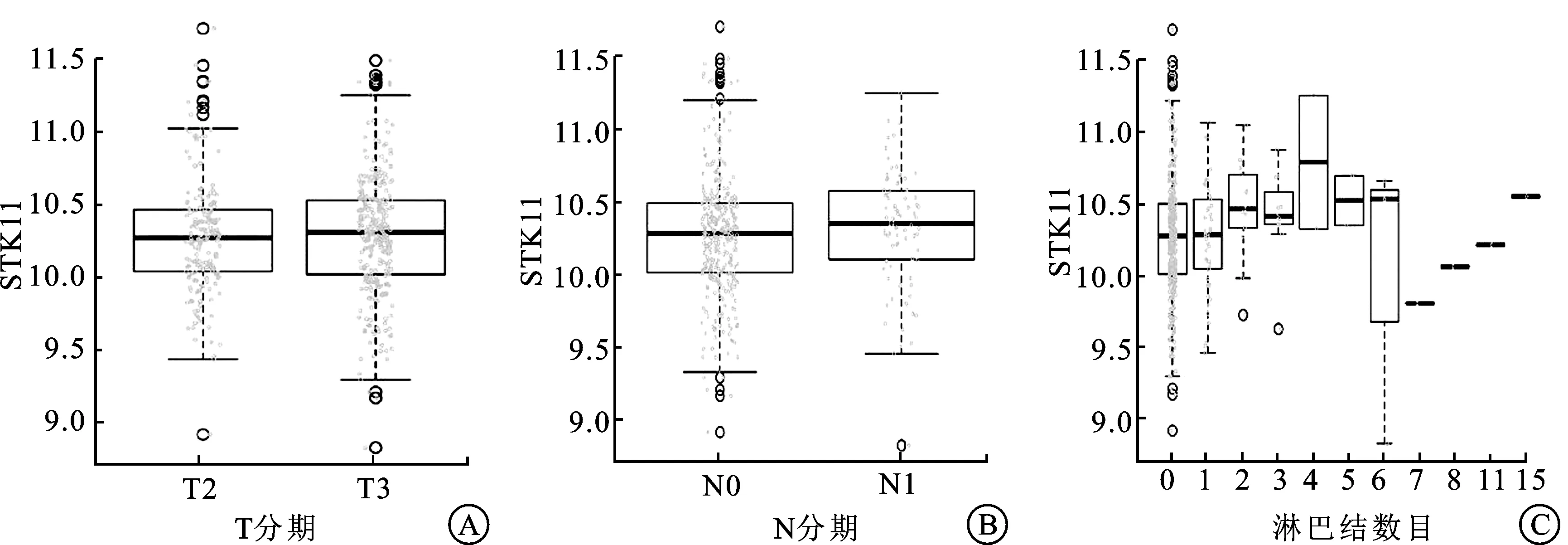
图1STK11表达与PCa临床病理特征的相关性
A:STK11表达与T分期的关系(n=490);B:STK11表达与N分期的关系(n=424);C:STK11表达与淋巴结转移数目的关系(n=406)。
2.2STK11水平与前列腺癌恶性进程的关系利用GEO Profiles数据库分析了不同类型前列腺癌中STK11的mRNA表达水平。该研究共分析了19例前列腺癌中STK11的mRNA表达水平,其中良性前列腺组织5例;原发性前列腺癌组织7例;转移性前列腺癌组织6例。统计结果显示:STK11基因在转移性前列腺癌中表达量显著高于良性前列腺组织(P<0.05)和原发性前列腺癌组织(P<0.01)(图2)。该结果提示STK11的高表达可能在前列腺癌的恶性进程中发挥着重要作用。
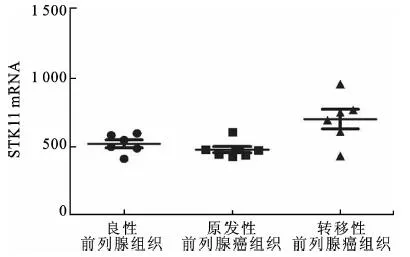
图2 STK11在良性前列腺组织、原发性前列腺癌组织和转移性列腺癌组织中的表达
2.3STK11蛋白在PCa组织中的表达及定位情况利用The Human Protein Atlas数据库,分析不同等级PCa组织中STK11的表达及定位水平。该数据库提供的免疫组化结果表明:STK11在高等级PCa组织中的表达显著高于低等级PCa组织,并且主要定位于肿瘤细胞的胞质和胞膜(图3)。
2.4STK11表达与PCa患者预后之间的关系我们利用GEPIA数据库分析了STK11表达与PCa患者预后之间相关性,结果表明:STK11基因的表达水平对PCa患者的总生存率和无病生存率有显著影响。与STK11基因高表达组相比,STK11基因低表达组的PCa患者其总生存率(LogrankP=0.029,HR=7.3,P(HR)=0.062)和无病生存率均显著升高(LogrankP=0.001 9,HR=1.9,P(HR)=0.002 3),如图4所示。
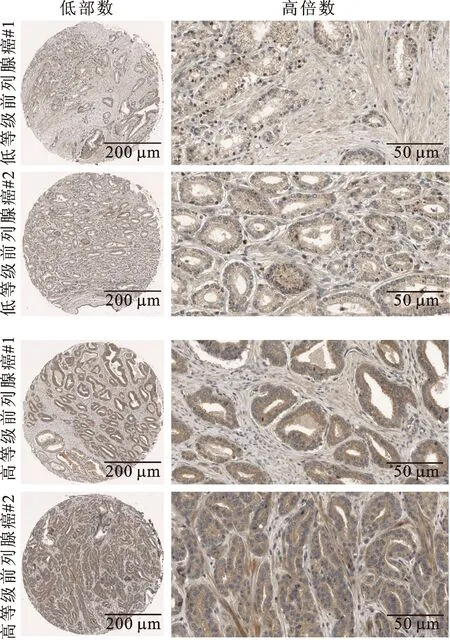
图3 The Human Protein Atlas数据库提供的STK11蛋白在不同等级PCa组织中的免疫组化染色
3 讨 论
随着人口老龄化的加剧及环境和饮食结果的改变,前列腺癌的发病率呈现出逐年上升的趋势,现已成为除膀胱癌、肾肿瘤外的第3大常见多发男性泌尿生殖系统恶性肿瘤。因此,有关前列腺癌的诊断、治疗和预防研究已经成为肿瘤研究的热点,但是前列腺癌诊治相对复杂,异质性较高。所以,寻找与前列腺癌预后相关的关键基因对前列腺癌术后复发监测和治疗靶点的研究具有重要的意义。
STK11基因是Pentz-Jeghers综合症(Peutz-Jeghers syndrome,PJS)的关键致病基因,该疾病又称为黑斑息肉综合症,主要表现为皮肤、黏膜特定部位色素斑和胃肠道多发性息肉,并且伴随着多种恶性肿瘤[13-14]。PJS合并的恶性肿瘤多为消化系统肿瘤,但是伴随着前列腺癌、睾丸癌、肾癌及不确定组织类型的肿瘤[15-19]。因此,我们采用临床大样本数据库从STK11基因在PCa中的表达、与PCa临床病理特征的相关性、与PCa预后的相关性等方面,全面评估了STK11在PCa诊断与预后中的重要作用。
在本研究中,我们首先分析了STK11与PCa临床病理特征之间的相关性,研究发现STK11的表达分别与T分期、N分期和淋巴结转移个数呈显著正相关性。随后在STK11与PCa恶性进程相关性的分析中发现,STK11在转移性前列腺癌中的表达显著高于良性前列腺组织和原发性前列腺组织。而在The Human Protein Atlas数据库中进一步验证了STK11在不同等级PCa组织中的表达及定位。最后分析STK11的表达量是否会影响PCa患者预后,结果表明高表达STK11的患者其总体生存率与无疾病生存率均显著低于低表达STK11者。上述结果从PCa的临床病理特征、恶性进展和预后等多方面,全面分析了STK11在前列腺癌中的重要作用。
STK11作为细胞能量代谢的关键感应及调节激酶,在基因组稳定、细胞极性及细胞干性等方面都具有十分重要的作用[10-12]。在乳腺癌中LKB1的低表达与肿瘤的不良预后密切相关,敲低LKB1能够促进肿瘤细胞的侵袭、迁移和干性[20]。另有研究证明当细胞经受UVB照射时,LKB1与其下游激酶NUAK1共同磷酸化CDKN1A调节DNA的损伤修复。LKB1缺失将造成CDKN1A积累,DNA修复受损和凋亡抗性[21]。此外,当细胞内活性氧水平增加,LKB1能够与cdc42-PAK1(p21 activated kinase 1)结合,通过激活p38及其下游信号通路增加过氧化物酶和SOD-2两种抗氧化酶的活性,保护细胞免受活性氧积累造成的损伤[22]。而在子宫内膜癌中,LKB1的缺失诱导细胞自发产生炎症趋化因子配体2(CCL2),该配体能够招募巨噬细胞促进肿瘤进程[23]。而在现有研究中有关STK11具体调节前列腺癌发生发展的机制研究鲜有报道。因此,我们利用STING数据库预测STK11的调控网络,进一步预测STK11调控前列腺癌发生发展的潜在机制(图5)。
在前十位的STK11潜在靶点中,包含了TP53和SMAD4等与前列腺癌发生发展密切相关的重要因子。TP53是一种关键的抗凋亡因子,其通过激活DNA修复蛋白来维持遗传物质的稳定性,同时引起细胞周期阻滞和凋亡,此外其还能够调控细胞极性和干性,在肿瘤发展中具有重要功能[24-25]。SMAD4是介导TGF-β信号通路的关键信号级联分子,能够激活TGF-β1应答基因的转录,从而调控细胞凋亡、分化和增殖[26]。因此,STK11有可能通过影响上述关键因子调控前列腺癌的恶性进程。
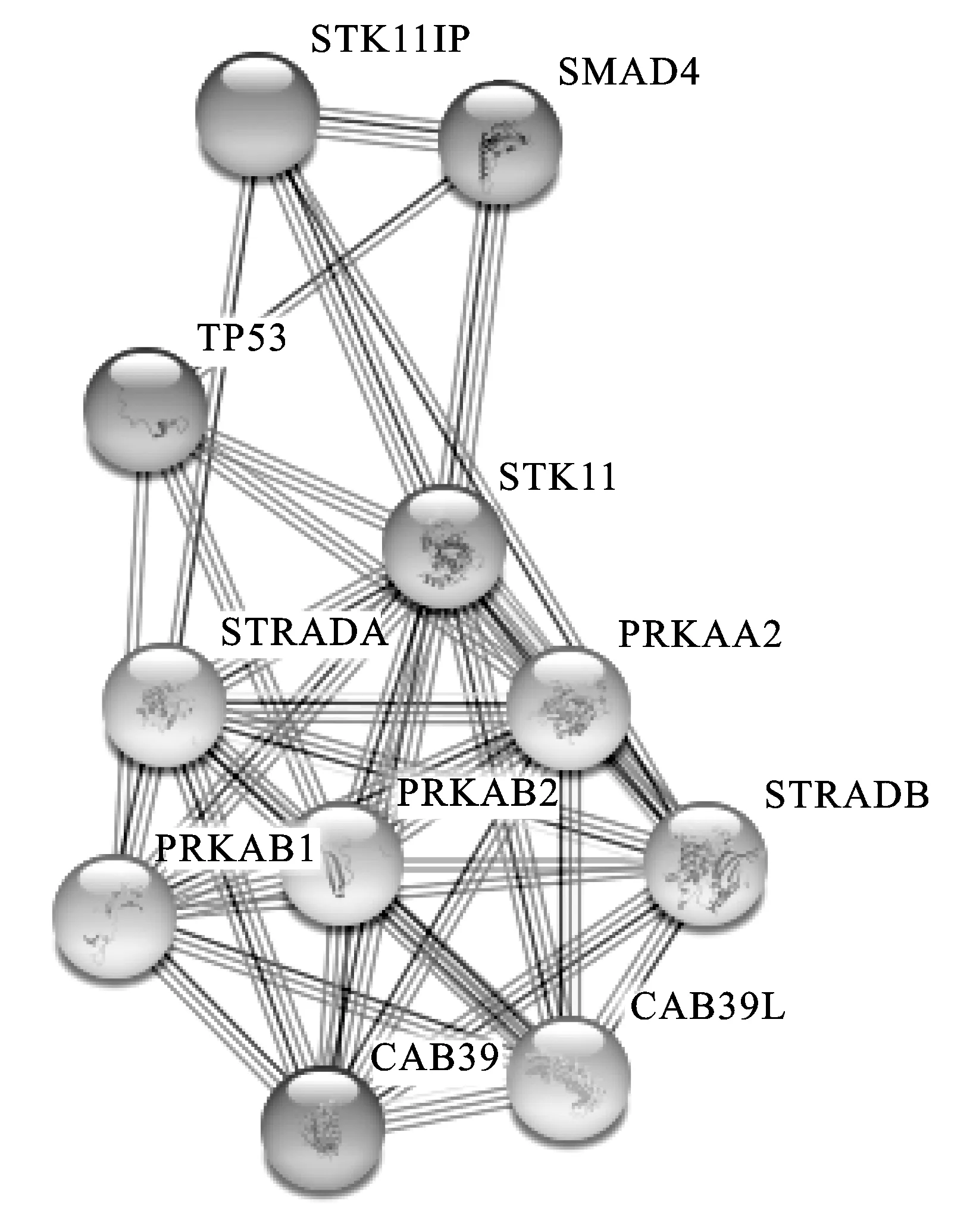
图5 STK11的调控网络
综上所述,STK11在PCa的发生与发展中具有重要意义,其可能作为PCa的预测及治疗靶点。

