中药脑还丹对APP/PS1小鼠海马区细胞内[Ca2+]i的影响
,,
阿尔茨海默病(Alzheimer′s disease,AD)是发生在老年期或老年前期的一种原发性中枢神经系统退行性病变,以进行性持续性学习记忆功能减退为主要临床特征,以老年斑(senile plaque,SP)、神经元纤维缠结(neurofibrillary tangles,NFT)、神经元丢失为主要病理改变。现代研究证实,钙离子稳态失调及自由基生成过多是体内一切细胞死亡的“共同通道”[1]。脑还丹是在具有抗衰老作用古方草还丹基础上,结合现代中药药理研究,以骨碎补、熟地黄、石菖蒲等中药组成的复方;既往研究表明,脑还丹能使AD病人的临床症状得到明显改善;可明显提高去势老龄大鼠血清胰岛素样生长因子水平[2],稳定去势老龄大鼠海马区神经元结构,维持其突触密度[3],抑制快速老化鼠SAMP8脑内过氧化反应及神经元超微结构的损伤,促进抗凋亡基因bcl-x及海马CA1区PSD-95、Shank-1蛋白的表达[4-5]。本研究以反映神经细胞凋亡情况的细胞内钙离子浓度([Ca2+]i)为主要观察指标,以APP/PS1双转基因小鼠为AD模型,观察脑还丹对其学习记忆能力及细胞内[Ca2+]i的影响,进一步探讨脑还丹改善学习记忆功能的机制。
1 材料与方法
1.1 实验动物 3个月龄SPF级雄性APP/PS1双转基因小鼠48只,同月龄、同遗传背景、C57BL/6J小鼠12只,体重30 g±5 g,以上动物均购自中国医学科学院实验动物研究所[生产许可证号:SCXK(京)2013-0002]。
1.2 实验用药 脑还丹由人参、熟地黄、骨碎补等组成,采用颗粒剂(广东一方制药有限公司提供,批号312046T),盐酸多奈哌齐片[商品名:安理申,规格:每片5 mg,卫材(中国)药业有限公司提供,批号130437B],实验时均按照需要,用蒸馏水配制成所含生药量不同浓度的药液。
1.3 主要试剂及仪器 YLS-Q6小鼠灌胃器[安合盟(天津)科技发展有限公司],Morris水迷宫(由中山大学解剖教研室提供),Fluo-4/AM荧光探针[东仁化学科技(上海)有限公司],超净工作台(苏州净化仪器厂),BD FACS Calibur流式细胞仪(碧迪医疗器械有限公司)。其他如双蒸水、胰酶、水合氯醛、磷酸缓冲盐溶液(PBS)等。
1.4 实验方法
1.4.1 动物分组 将上述48只小鼠随机分为4组,分别为模型组、脑还丹低剂量组、脑还丹高剂量组及多奈哌齐组,每组12只;另选取C57BL/6J小鼠12只作为正常对照组。
1.4.2 药物配制及给药 脑还丹及多奈哌齐用药剂量按动物体表面积比率等剂量法换算[6],以成人(体重60 kg为参考)常规剂量折算为小鼠的基础剂量,常规剂量2倍作为高剂量。用双蒸水将脑还丹颗粒冲剂配制成浓度为1 g/mL和0.5 g/mL药液,盐酸多奈哌齐配制成浓度为0.24 mg/mL药液,冷藏保存,使用时加至常温并搅拌均匀。按以下剂量对给药组小鼠进行灌胃:脑还丹高剂量组41.6 g/(kg·d),脑还丹低剂量组20.8 g/(kg·d),多奈哌齐组8.0 mg/(kg·d)。正常对照组、模型组小鼠每日灌以等量蒸馏水。每日1次,持续4个月。
1.4.3 Morris水迷宫实验 采用由中国科学院研制Morris水迷宫(中山大学北校区解剖教研室)进行行为学测试[7],包括隐蔽平台实验5 d及空间探索实验1 d。以此评价小鼠的学习记忆能力及多奈哌齐和脑还丹对其影响。
1.4.4 标本采集 Morris水迷宫测试结束后,每组取8只小鼠断头处死,无菌条件下剥出全脑,沿大脑纵裂切开,并用玻璃棒分离出海马组织,放入冻存管立即置于液氮内保存备用,用于细胞内[Ca2+]i的检测。海马区细胞内[Ca2+]i检测:①将海马组织置于生理盐水中进行机械剪切,之后添加胰酶进行消化,制备单细胞悬液,加入终浓度为4 μmol/L的Fluo-4/AM荧光探针,37 ℃细胞培养箱孵育20 min后除去Fluo-4/AM工作液;用PBS溶液洗涤细胞3次,之后加入PBS重悬细胞,37 ℃培养箱孵育约30 min后加入PBS液,调整细胞悬液浓度为1×105/mL,以流式细胞仪检测细胞内[Ca2+]i。②结果统计:以发射波长为516 nm,激发波长为488 nm条件下使用流式细胞仪检测到的神经细胞内[Ca2+]i的荧光强度作为统计值,进行统计分析。

2 结 果
2.1 各组小鼠定位航行实验结果比较 定位航行实验的观察主要包括小鼠找到平台的时间(潜伏期)和搜索路线。随着观察时间延长,模型组小鼠潜伏期明显长于正常对照组(P<0.01);从第3天开始,脑还丹高剂量组低剂量组及多奈哌齐组潜伏期较模型组明显缩短(P<0.01),与脑还丹低剂量组比较,脑还丹高剂量组和多奈哌齐组找到平台所用时间明显缩短(P<0.05);多奈哌齐组与脑还丹高剂量组比较,差异无统计学意义(P>0.05)。详见图1、图2、表1。
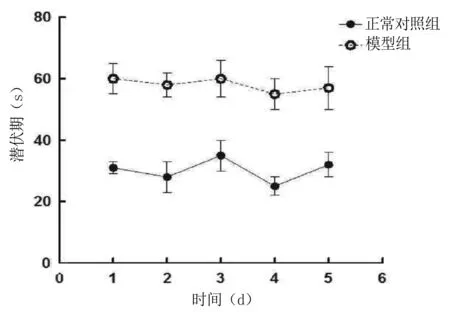
图1 正常对照组与模型组小鼠逃避潜伏期比较

图2 脑还丹低剂量组、高剂量组、多奈哌齐组及模型组小鼠逃避潜伏期比较

表1 各组小鼠隐蔽平台实验结果比较(±s) s
搜索平台路线方面,随着时间增加,各组小鼠采取边缘式、随机式探索次数逐渐减少,而趋向式、直线式探索路线次数逐渐增加。从第2天开始,正常对照组趋向式、直线式探索路线次数较其他4组明显增加。第4天、第5天脑还丹低剂量组、高剂量组及多奈哌齐组采取直线式、趋向式路线次数明显多于模型组。详见图3。
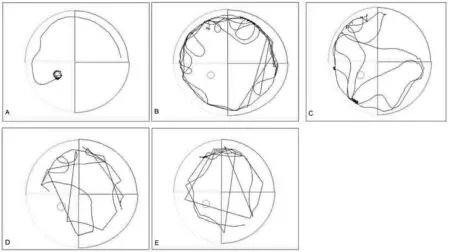
A:正常对照组;B:模型组;C:脑还丹低剂量组;D:脑还丹高剂量组;E:多奈哌齐组
2.2 各组小鼠空间探索实验结果比较 平台撤去后,第6天进行空间探索实验。记录小鼠在平台象限内停留时间,以测试小鼠对平台的空间记忆能力。正常对照组、脑还丹低剂量组、高剂量组和多奈哌齐组平台象限停留时间较模型组显著延长(P<0.01);且脑还丹高剂量组、多奈哌齐组较低剂量组平台象限内停留时间明显延长(P<0.05);正常对照组、脑还丹低剂量组、高剂量组和多奈哌齐组首次跨越平台时间较模型组缩短(P<0.05或P<0.01),且脑还丹高剂量组、多奈哌齐组较脑还丹低剂量组缩短(P<0.05)。与脑还丹低剂量组比较,脑还丹高剂量组小鼠在定位航行中所用时间较少,平台象限内停留时间较长(P<0.05)。详见表2。
2.3 各组小鼠海马区细胞内[Ca2+]i比较 流式细胞仪检测结果显示(见图4),5组小鼠海马区神经细胞内[Ca2+]i比较,差异有统计学意义(F=122.86,P<0.05);与模型组比较,各组海马区神经细胞内[Ca2+]i浓度明显减少(P<0.01);与脑还丹低剂量组比较,脑还丹高剂量组[Ca2+]i明显减少(P<0.01);多奈哌齐组与脑还丹高剂量组比较,差异无统计学意义(P>0.05)。详见图5、表3。

表2 各组小鼠空间探索实验结果比较(±s) s

图4 各组小鼠海马细胞[Ca2+]i比较

与模型组比较,*P<0.05,#P<0.01

表3 各组小鼠海马细胞[Ca2+]i比较(±s) nmol/L
3 讨 论
有研究表明,在AD发生发展过程中伴有钙离子稳态失调。正常情况下钙离子在细胞内外分布受细胞膜和质膜的屏障作用及细胞膜钙通道调节。Ca2+通道是镶嵌膜上有孔道的蛋白质,其对钙离子的通透性受电压、受体及胞内钙量等调控。生理条件下,由于质膜上和胞膜上Ca2+-ATP酶(钙泵)的存在,细胞内钙离子保持低浓度状态,仅为细胞外的1/20 000。作为细胞内第二信使,钙离子参与神经细胞的发育分化、递质的释放、突触的传递、激素的放大效应、酶的激活等多种生理过程。质膜受损或钙泵供能障碍,可发生钙离子内流,引起钙离子稳态失调而导致钙超载的发生;细胞内过多的游离Ca2+可激活Ca2+调节的核酸内切酶、CaM等多种酶,进而引起一系列基因、蛋白的表达异常,从而导致细胞功能障碍甚至死亡[8]。在AD的发生、发展过程中Aβ及活性氧自由基通过引起神经元钙超载而产生神经毒性作用的。Ca2+稳态失调导致的钙超载在AD发病过程中的作用已经得到人们的重视。已有学者研究发现,通过减少细胞内的[Ca2+]i可有效改善痴呆动物模型的学习记忆功能[9]。
APP/PS1双转基因小鼠是以APP单转基因小鼠与PS1单转基因小鼠进行杂交,或运用DNA重组技术将APP和PS1两种外源突变基因同时传染、整合到小鼠的基因组中而得到。实验研究表明,APP/PS1双转基因小鼠在4.5月龄时,大脑皮层即出现淀粉样沉积和SP,且随着月龄增加,大脑皮层SP数量面积明显增大[10];至9月~12月龄时,可出现与AD病人相似的SP[11]。行为学方面研究发现,3个月龄时APP/PS1双转基因小鼠已出现明显的学习记忆功能障碍。这一结果表明APP/PS1双转基因小鼠表现与AD病人相似的发病进程,是研究AD较理想的动物模型。
本研究结果显示,与模型组比较多奈哌齐组和脑还丹干预组小鼠在隐蔽平台试验中所用时间明显缩短,而空间探索试验中在原平台象限停留时间明显增加,提示脑还丹、多奈哌齐均可明显改善APP/PS1双转基因小鼠的学习、记忆功能。海马区[Ca2+]i检测提示,模型组较正常对照组海马细胞[Ca2+]i明显增高(P<0.01);脑还丹干预组及多奈哌齐组[Ca2+]i较模型组明显降低(P<0.01)。
钙离子稳态失调与学习记忆功能的关系推断可能有以下几方面原因:①机体老化时伴随全身脏器、组织和细胞的老化;②机体老化只是外在表象,其实质是细胞生物膜的受损;③细胞膜损伤导致各离子通道的功能异常,其中Ca2+通道所受影响尤为明显,导致Ca2+内流增加,使Ca2+在胞内聚积,激活细胞内质网、线粒体钙库释放,使细胞内Ca2+浓度进一步升高,加剧细胞老化;④细胞老化,导致线粒体功能障碍,细胞供能障碍,钙泵失常,进一步导致细胞内Ca2+潴留;⑤细胞老化与Ca2+稳态失调,形成恶性循环,进而导致突触丢失、细胞凋亡等一系列病理变化,导致APP/PS1双转基因小鼠的学习记忆功能障碍。这可能是APP/PS1双转基因小鼠学习记忆能力明显低于C57BL/6J小鼠的原因之一,而脑还丹和多奈哌齐可通过稳定细胞内[Ca2+]i,减轻下游的细胞功能损害,保护神经细胞功能,进而改善APP/PS1双转基因小鼠的学习记忆功能。
综上所述,脑还丹可显著改善APP/PS1双转基因小鼠的学习记忆功能,其机制可能与其稳定细胞内[Ca2+]i,降低Ca2+超载,减少自由基产生,保护细胞生物膜有关。脑还丹高剂量组疗效优于低剂量组的原因可能为药物有效成分含量较高,增加血药浓度,改善学习记忆功能。

