1,25-二羟维生素D3减轻幼鼠海水吸入性肺损伤中组织水肿的机制
,,,, ,
(空军军医大学第一附属医院儿科,陕西 西安 710032)
海水淹溺是引起意外性死亡的常见因素之一。据世界卫生组织统计,全世界每年由于淹溺造成的死亡人数为150万左右,其中大部分为海水淹溺[1]。在海水淹溺造成的死亡当中,儿童及少年占了很大比重,这与儿童自救意识和能力差有很大关系。尽管政府及医疗机构对防治儿童淹溺做了大量的宣传,但儿童每年淹溺的人数仍居高不下。在海水淹溺发生后,呼吸及心跳骤停是引起患儿死亡的重要原因,而多数因自救或他救存活下来的患儿会伴随较为严重的急性肺损伤[2-3]。大量关于海水吸入性肺损伤的研究表明,肺组织中难以清除的水肿液是引起机体缺氧、呼吸困难甚至后期肺组织结构改变的重要因素。
研究表明,海水吸入肺组织后,由于肺泡腔内瞬间达到高渗的状态,液体会从血管及组织细胞中转移至肺泡腔内[4-5]。机体后续水肿液的清除主要通过肺泡上皮细胞表面的离子通道及水通道蛋白发挥作用[6]。离子通道方面,肺泡腔一侧的Na+离子通道会将肺泡腔中的Na+离子转运至细胞内,位于细胞基底部的Na+-K+-ATP酶会以主动转运的方式将细胞内高浓度的Na+离子转运至间质及血液中[7];而肺泡腔内的水分则是伴随着Na+离子浓度梯度的改变一起转运至间质及血液中。水通道蛋白(aquaporin,AQP)是转运水分子的专用蛋白通道,研究表明在肺泡细胞中发挥重要作用的蛋白是AQP1和AQP5[8]。在肺泡腔出现水肿液后,位于肺泡细胞表面的水通道蛋白会将水分转运至细胞内,然后再由基底部的水通道蛋白转运至血液或间质中。之前关于海水吸入性肺损伤成年动物模型中,海水刺激后Na+-K+-ATP酶及AQP1、AQP5的表达和活性都受到了不同程度的抑制,从而影响了肺水肿的清除,但幼年动物模型中在该方面的改变尚不清楚。
1,25-二羟维生素D3[1,25-(OH)2VitD3]在钙离子代谢中有至关重要的作用,除此之外,还具有多种方面的功效[9]。在小鼠脂多糖导致的急性肺损伤模型中,1,25-二羟维生素D3有减轻肺组织水肿及炎症细胞浸润的作用[10-11]。在海水吸入性肺损伤中,1,25-二羟维生素D3也具有抑制炎症因子表达和减轻水肿的作用,但其在幼年海水吸入性肺损伤动物模型中对肺水肿的作用及机制尚不清楚。本研究通过构建幼鼠海水吸入性肺损伤模型,探究了1,25-二羟维生素D3在幼鼠海水吸入性肺损伤中对肺组织水肿的作用,并检测了与Na+-K+-ATP酶及水通道蛋白的关系。此外,地塞米松作为临床上公认的治疗各类急性肺损伤的药物,对海水吸入性肺损伤的治疗同样有着显著的效果,因此本研究中将地塞米松作为治疗效果对照。
1材料与方法
1.1药品及试剂
实验中所用1,25-二羟维生素D3和地塞米松试剂均购自Sigma公司,其中1,25-二羟维生素D3用10%甲醇-1‰Triton X-100溶液配制成的混悬液通过灌胃方式进行给药,地塞米松用5‰羧甲基纤维素钠溶液制成混悬液也通过灌胃给药。实验用配方海水(中国海洋局提供)成分包含:NaCl 26.518g/L,MgSO43.305g/L,MgCl22.447g/L,CaCl21.141g/L,NaHCO30.202g/L,KCl 0.725g/L,NaBr 0.083g/L;pH 8.2,相对密度1.05,渗透压1 300mmol/L。β-actin、Na+-K+-ATP酶、AQP1和AQP5抗体均购于Cell Signaling Technology( CST)公司。实验中其他试剂和药物均为国产或进口分析纯。
1.2实验动物及分组
本研究自2016年7月开始,2017年7月终止。21日龄SD(Sprague-Dawley)幼鼠(雄性、44~61g),由空军军医大学(第四军医大学)实验动物中心提供。海水刺激对肺组织湿干比(W/D)、通透性及离子通道改变的研究分组为:海水刺激0h、1h、4h、6h组。1,25-二羟维生素D3对湿干比、通透性及离子通道蛋白的影响部分实验分组为:A空白对照组,B海水吸入6h组,C海水吸入6h+VitD3预处理组,D海水吸入6h+地塞米松预处理组。造模前1h给各组幼鼠通过灌胃的方式给药,A和B组:生理盐水;C组:25μg/kg VitD3;D组:10mg/kg地塞米松。幼鼠海水吸入性肺损伤模型的制备:首先幼鼠腹腔注射3%戊巴比妥钠(1.5mL/kg)进行麻醉,仰卧固定后,颈部正中切口暴露气管,用1mL的注射器插入气管,在4min之内缓慢滴注3mL/kg海水。
1.3实验方法
1.3.1幼鼠肺组织湿干比检测方法
造模完成后取每只幼鼠右侧肺组织,快速擦干肺表面后立即称量即为肺组织湿重,然后将各组肺组织置于70°C烘箱中烘干,72h后进行称重即为干重,用湿重除以干重即为各只实验动物的湿干比。
1.3.2伊文思蓝法检测海水刺激后幼鼠肺组织通透性
造模完成后,将20mg/kg伊文思蓝溶液通过尾静脉注射到实验动物体内,然后迅速处死幼鼠并取出幼鼠心脏和肺组织,将生理盐水注入右心室,反复冲洗幼鼠肺组织,直到左心房流出液转为清亮。然后,将肺组织在烘箱中60°C下烘干,72h后进行称重并放入甲酰胺中(3mL每100mg组织),充分溶解后将上清液离心30min,用分光光度计在620nm波长下检测,通过比对伊文思蓝标准曲线得出各样本中伊文思蓝浓度(μg/g组织)。
1.3.3 Western blot法检测Na+-K+-ATP酶、AQP1和AQP5蛋白的表达情况
首先各组幼鼠取等量的左侧肺组织,加入RIPA裂解液并在冰上进行组织匀浆,离心后收集含有蛋白的上清液,BSA标准曲线法定量,沸水煮15min,SDS-PAGE凝胶电泳,转膜并用脱脂奶粉封闭;加入一抗(1:1 000稀释),4°C过夜,加入羊抗兔二抗(1:5 000稀释),37°C孵育1h,ECL显色并照相,图像做灰度扫描处理。
1.4统计学方法

2结果
2.1海水刺激后幼鼠肺组织湿干比和伊文思蓝通透性的改变
海水刺激后,肺组织湿干比和通透性明显增加(均P<0.001);且在刺激1h后达到高峰,其后随着时间的延长,湿干比和通透性改变略有下降,见图1、表1、表2。

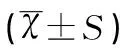

注:伊文思蓝(Evans blue)。
表2不同组间幼鼠肺组织湿干比和伊文思蓝通透性的检测结果对比
Table 2 Comparison of W/D ratio and Evans blue permeability test results among different groups of young rats


注:A为空白对照组,B为海水1h组,C为海水4h组,D为海水6h组,***为与空白对照组比较P<0.001。
图1幼鼠肺组织湿干比和伊文思蓝通透性的检测结果
Fig.1 W/D ratio and Evans blue permeability in lung tissues of young rats
2.2 1,25-二羟维生素D3对海水刺激后幼鼠肺组织湿干比和通透性的影响
海水刺激6h后,肺组织湿干比和通透性均出现了显著的增加(均P<0.001);而VitD3和地塞米松的预处理能够明显降低了湿干比和通透性的改变,且VitD3预处理组效果稍好于地塞米松预处理组,见表3、表4、图2。
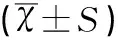


损伤指标ABCDW/D3.13±0.335.45±0.454.20±0.374.50±0.45Evans blue21.00±4.5577.00±8.2053.00±6.9857.00±6.98
表4不同组间幼鼠肺组织湿干比和伊文思蓝通透性检测结果对比
Table 4 Comparison of W/D ratio and Evans blue permeability test results among different groups of young rats


注:A为空白对照组,B为海水6h组,C为海水6h+VitD3预处理组,D为海水6h+地塞米松预处理组;***为与空白对照组比较P<0.001,##为与海水6h组比较P<0.01,#为与海水6h组比较P<0.05。
图2幼鼠肺组织湿干比和伊文思蓝通透性结果
Fig.2 W/D ratio and Evans blue permeability in lung tissues of young rats
2.3海水刺激后幼鼠肺组织中Na+-K+-ATP酶、AQP1和AQP5蛋白表达的改变
海水刺激后幼鼠肺组织中Na+-K+-ATP酶、AQP1和AQP5蛋白表达随刺激时间的延长逐渐减少,见表5、表6、图3。
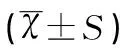


表6不同组间幼鼠肺组织Na+-K+-ATP酶、AQP1和AQP5蛋白表达检测结果对比
Table 6 Comparison of expressions of Na+-K+- ATPase, AQP1 and AQP5 in lung tissues among different groups of young rats


注:A为空白对照组,B为海水1h组,C为海水4h组,D为海水6h组;***为与空白对照组比较P<0.001。
图3幼鼠肺组织Na+-K+-ATP酶、AQP1和AQP5蛋白表达检测结果
Fig.3 Expressions of Na+-K+-ATPase, AQP1 and AQP5 in lung tissues of young rats
2.4 1,25-二羟维生素D3对海水刺激后幼鼠肺组织中Na+-K+-ATP酶、AQP1和AQP5蛋白表达的影响
海水刺激6h后,幼鼠肺组织中Na+-K+-ATP酶、AQP1和AQP5蛋白表达出现了显著的下降(均P<0.001);而VitD3和地塞米松的预处理能够明显提升Na+-K+-ATP酶、AQP1和AQP5蛋白表达,且VitD3预处理组效果稍好于地塞米松预处理组,见表7、表8、图4。
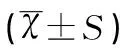
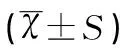

表8不同组间幼鼠肺组织Na+-K+-ATP酶、AQP1和AQP5蛋白表达检测结果对比
Table 8 Comparison of expressions of Na+-K+-ATPase, AQP1 and AQP5 in lung tissues among different groups of young rats


注:A为空白对照组,B为海水6h组,C为海水6h+VitD3预处理组,D为海水6h+地塞米松预处理组;***为与空白对照组比较P<0.001,###为海水6h组比较P<0.001,##为海水6h组比较P<0.01,#为海水6h组比较P<0.05。
图4幼鼠肺组织Na+-K+-ATP酶、AQP1和AQP5蛋白表达检测结果
Fig.4 Expressions of Na+-K+-ATPase, AQP1 and AQP5 in lung tissues of young rats
3讨论
本研究中检测了1,25-二羟维生素D3对幼鼠海水吸入性肺损伤中肺组织水肿的影响。海水刺激后,幼鼠肺组织湿干比、伊文思蓝通透性同时出现了显著的增加,而1,25-二羟维生素D3的预处理则能够显著减轻肺组织湿干比和通透性的改变,即减轻了肺水肿的发生。此外,Na+-K+-ATP酶、AQP1和AQP5蛋白表达的改变参与了幼鼠海水吸入性肺损伤中肺组织水肿的发生和发展。在海水刺激后,Na+-K+-ATP酶、AQP1和AQP5蛋白表达出现了不同程度的减少,影响了对肺泡腔内水肿液的吸收。而1,25-二羟维生素D3的预处理则能够显著促进Na+-K+-ATP酶、AQP1和AQP5蛋白的表达。
3.1海水刺激对肺组织中Na+-K+-ATP酶、AQP1和AQP5表达的影响
海水淹溺是导致儿童意外性死亡的重要原因之一,而淹溺后存活下来的患儿往往都伴随着急性肺损伤的发生,肺水肿是海水吸入性肺损伤最主要的病理改变,因此,减轻肺水肿对于治疗患儿的肺损伤尤为重要[12]。之前关于肺水肿的相关研究中发现,离子通道和水通道蛋白在水肿液的吸收中发挥了重要的作用[7-8]。一方面,肺泡腔一侧的Na+离子通道会将水肿液中的Na+离子转运至细胞内,位于细胞基底部的Na+-K+-ATP酶会以主动转运的方式将细胞内高浓度的Na+离子转运至间质及血液中,而肺泡腔内的水分则会伴随着Na+离子浓度梯度的改变一起转运至间质及血液中。另一方面,在肺泡腔出现水肿液后,位于肺泡细胞表面的水通道蛋白会将水分转运至细胞内,然后再由基底部的水通道蛋白转运至血液或间质中。而有研究表明,肺泡细胞中表达的最主要的水通道蛋白为AQP1和AQP5蛋白。本研究中发现海水刺激后肺组织水肿增加的同时,Na+-K+-ATP酶、AQP1和AQP5蛋白呈现出下降的趋势,正是因为这些蛋白表达下降,使海水刺激后肺水肿的吸收效率出现下降[8]。
3.2 1,25-二羟维生素D3在减轻海水刺激引起肺组织水肿中的作用机制
1,25-二羟维生素D3是维生素D3的活性成分,在很多方面都有重要作用[13]。在小鼠脂多糖导致的急性肺损伤模型中,1,25-二羟维生素D3有减轻肺组织水肿及炎症细胞浸润的作用。在海水吸入性肺损伤中,1,25-二羟维生素D3也具有抑制炎症因子表达和减轻水肿的作用。本研究中,1,25-二羟维生素D3明显的减轻了肺组织水肿,同时使Na+-K+-ATP酶、AQP1和AQP5蛋白的表达出现了回调。正是因为上调了这些蛋白的表达,才使得药物增加了肺水肿的清除效率。这些结果证实了1,25-二羟维生素D3减轻幼鼠海水肺损伤中肺组织水肿是通过上调Na+-K+-ATP酶、AQP1和AQP5蛋白达成的,也为1,25-二羟维生素D3治疗幼儿海水吸入性肺损伤提供了基础和依据。

