耐有机溶剂蛋白酶产生菌MSP05的筛选、鉴定及酶学性质研究
, ,,,,,,,,,*
(1.淮海工学院海洋生命与水产学院,江苏连云港 222005) (2.江苏省海洋资源开发研究院,江苏连云港 222005)
蛋白酶是目前工业化应用最成功的酶类,占据了酶制剂市场的65%以上[1]。蛋白酶在水相催化中可以将蛋白分解为蛋白胨、多肽及游离氨基酸[2]。在有高浓度有机溶剂的体系中,酶催化反应会快速向氨基酸脱水缩合形成肽键方向进行,选择性地催化肽键与酯键的形成,可以被应用于一些重要中间体的合成及手性药物的拆分[3]。但大多数蛋白酶在高浓度的有机溶剂中稳定性差,而通过生物催化工程对酶进行化学修饰、酶固定化等改造又有成本高、操作复杂,且常常以降低酶活为代价的缺点[4-5],这极大地限制了蛋白酶有机相催化的产业化应用。
耐有机溶剂蛋白酶是一类新颖的极端酶,它们在有机溶剂中具有稳定的天然特性,是非水酶学发展的新资源。耐有机溶剂蛋白酶通常由耐有机溶剂极端微生物产生,筛选耐有机溶剂极端微生物成为获得天然耐受有机溶剂蛋白酶的主要手段。目前已经有假单胞菌[6]、蜡状芽孢杆菌[7]及沙雷氏菌[8]等产耐有机溶剂蛋白酶的报道。已报道的耐有机溶剂蛋白酶一般对疏水性具有耐受性,对亲水性有机溶剂耐受性较弱,且对pH变化较为敏感,在非最佳pH的反应体系中活力显著降低。因此,筛选到具有良好性质的耐有机溶剂蛋白酶,可以丰富耐有机溶剂蛋白酶的种类,促进该类酶的应用,并为进一步研究耐有机溶剂酶的耐受机制奠定基础。
本研究通过富集培养,从连云港燕尾港海域海水样品筛选得到有机溶剂耐受菌株25株,并从中筛选获得了一株高产有机溶剂稳定性蛋白酶产生菌MSP05,对菌株MSP05进行形态学、生理生化及分子生物学鉴定,并对该菌株及其产生的有机溶剂稳定性蛋白酶的耐有机溶剂特性进行了初步研究。
1 材料与方法
1.1 材料与仪器
海泥样品 取自连云港燕尾港受污染海域(34°29′0″N,119°47′0″E);酪蛋白 上海阿拉丁试剂;酵母粉(Yeast extract)、蛋白胨(Tryptone) 分析纯,英国Oxoid公司;微生物裂解液(Lysis Buffer for Microorganism to Direct PCR)、Premix Taq Version 2.0 Takara公司;脱脂奶粉 完达山乳业股份有限公司;豆粕粉、D-果糖、MgSO4等试剂 均为分析纯,上海博微微生物科技有限公司;初筛培养基(g/L)脱脂奶粉10.0,酵母粉5.0,MgSO40.4,添加10%甲苯(V/V),海水配制,pH自然;复筛培养基(g/L)脱脂奶粉10.0,酵母粉5.0,琼脂20.0,50%海水配制,pH自然;发酵产酶培养基(g/L)豆粕粉10.0,D-果糖6.0,MgSO40.6,蒸馏水配制,pH自然。
680 ELX-800酶标仪 美国BIO-TEK公司;170-6701 PCR仪、GelDoc 2000凝胶成像系统 美国BIO-RAD公司;DYCP-31DN电泳仪 北京六一仪器厂。
1.2 实验方法
1.2.1 菌株的筛选
1.2.1.1 耐有机溶剂菌株的筛选 将海泥样品加入50 mL含有20%(V/V)甲苯的初筛培养基中,25 ℃、180 r/min培养72 h后转接到同种培养基中,重复三次。培养液稀释105后,吸取20 μL涂布于LB培养基。28 ℃培养48 h,挑取菌落形态不同的菌株,划线纯化至纯种后保藏备用。
1.2.2.2 耐有机溶剂蛋白酶产生菌的筛选 将1.2.1获得微生物(MSR02、MSR03、MSP05、MSP06、MSP07)点种于复筛培养基平板,28 ℃培养48 h,测定菌落直径与透明圈直径,选出透明圈直径与菌落直径比值大的菌株接种到发酵产酶培养基,28 ℃、180 r/min培养48 h后,4 ℃、13400×g离心15 min,上清液用于测定蛋白酶活力。取上清液1 mL加入1 mL的甲苯,在30 ℃、180 r/min振荡处理4 h后,检测蛋白酶活力,选择剩余酶活力高的菌株进行下一步研究。
1.2.2 菌种的鉴定 对菌株MSP05进行革兰氏染色、形态学观察并进行部分生理生化特征鉴定[9-10]。进一步对菌株16S rDNA进行扩增[11],序列测定后提交GeneBank,BlastN搜索同源序列并构建系统发育树。
1.2.3 耐有机溶剂蛋白酶酶学性质的研究
1.2.3.1 粗酶液的制备 将保存的菌种接种到LB培养基,28 ℃、180 r/min培养24 h后,以3%的接种量接种到发酵产酶培养基,8 ℃,180 r/min培养36 h,4 ℃条件下13400×g离心15 min,上清液即为粗酶液。
1.2.3.2 蛋白酶活力测定 采用Folin法测定蛋白酶活力[11],使用1%酪蛋白溶液作为底物。
每1单位(U)蛋白酶活力定义为在测定条件下,每毫升粗酶液每分钟催化产生1 μg酪氨酸的酶量(μg/mL·min)。
1.2.3.3 温度对酶活力及稳定性的影响 取1 mL粗酶液和1 mL底物在pH9.0分别于0、20、30、40、50、60、70 ℃下反应30 min后,测定蛋白酶酶活力,确定最适反应温度。酶液分别在20、30、40、50、60 ℃下保温30、60、90、120、150 min后测定蛋白酶酶活,确定蛋白酶的热稳定性。
1.2.3.4 pH对酶活力的影响 分别取1 mL粗酶液与1 mL pH为5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0、13.0和14.0的底物,在50 ℃下反应10 min后测定蛋白酶酶活力。
1.2.3.5 金属离子对酶活力的影响 在1.2.3.2中的测定体系中分别添加CaCl2、CuSO4、FeSO4、MgSO4、ZnSO4、KCl、NaCl金属离子溶液,使金属离子终浓度分别为5.0 mmol/L和10.0 mmol/L,测定蛋白酶酶活力,确定金属离子对酶活力的影响。
1.2.3.6 有机溶剂对蛋白酶酶活力的影响 将20 mL复筛培养基倒入直径90 mm的培养皿中,在复筛培养基平板上均匀打孔,孔直径10 mm。对Gock报道的方法[4]稍作修改,粗酶液中加入相同体积的环己烷、乙醇、乙酸乙酯、甲苯、正己醇、甲醇、正庚烷、二甲苯,使有机溶剂浓度达到50%(V/V),25 ℃、140 r/min,分别振荡24 h和72 h。每个孔中分别加入处理后的酶液150 μL,30 ℃静置3 h,观察透明圈形成状况,对剩余酶活力进行初步判断。以不加有机溶剂处理的酶液为对照,分别对处理后酶的剩余酶活力进行测定,确定蛋白酶MSP05对不同有机溶剂的耐受性。
1.3 数据处理
将数据进行整理,并用Origin 8.0软件进行曲线图的绘制。
2 结果与分析
2.1 产耐有机溶剂蛋白酶菌株的筛选
从燕尾港海域的样品中分离得到耐有机溶剂极端微生物25株,复筛获得蛋白酶产生菌7株,选取透明圈直径与菌落直径比值最大的5株菌发酵制粗酶液,用甲苯处理粗酶液,测定剩余酶活力,结果见表1。菌株MSP06的透明圈直径与菌落直径比值大于MSP05,表明菌株MSP06所产蛋白酶活力高于MSP05,但处理后的MSP05保持高达97.8%的剩余酶活力,表明菌株MSP05所产蛋白酶具有更好的有机溶剂耐受特性,因此选择菌株MSP05进行下一步研究。

表1 耐有机溶剂蛋白酶产生菌的初筛Table 1 A primary screen for organic solvent tolerant protease producing bacteria
2.2 菌种鉴定
如图1所示,菌株MSP05为革兰氏阳性菌。该菌在LB培养基培养48 h后,菌落白色,半透明,光滑湿润状、中心稍突起(图2)。菌株MSP05的部分生理生化特性研究结果见表2,该菌株发酵葡萄糖产气、产吲哚、柠檬酸盐利用和苯丙氨酸脱氢酶阴性、V.P.反应阳性、甲基红反应阴性、硫化氢产生阳性,过氧化氢酶、淀粉酶阳性、明胶酶弱阳性,卵磷脂酶、酪蛋白酶、脲酶阳性,O/F反应葡萄糖为氧化型,D-半乳糖、麦芽糖、乳糖、棉籽糖、蔗糖和蕈糖为F型。通过菌落形态和生理生化性质,将菌株MSP05初步鉴定为芽孢杆菌属。
图1 菌株MSP05形态(400×)Fig.1 Morphology of the strain MSP05(400×)

图2 菌株MSP05菌落形态Fig.2 Colony morphologyof strain MSP05

表2 菌株MSP05的生理生化试验结果Table 2 Characterzations of physiological and biochemistry experiments of strain MSP05
PCR扩增获得的MSP05的16S rDNA长度为1,431 bp,将序列提交GenBank,获得登陆号:KY378894。将序列进行BLAST序列同源性分析,结果表明MSP05与BacillusamyloliquefaciensY14(CP017953.1)相似度最高,达99%。选取相似度最高的部分序列,利用MEGA 7.0软件采用邻接法(Neighbor-Joining method)构建系统发育树,结果如图3,菌株MSP05与解淀粉芽孢杆菌B.amyloliquefaciensY14聚于一支。结合菌株形态特征及生理生化特性,最终将菌株MSP05鉴定为芽孢杆菌属的解淀粉芽孢杆菌(B.amyloliquefaciens)。
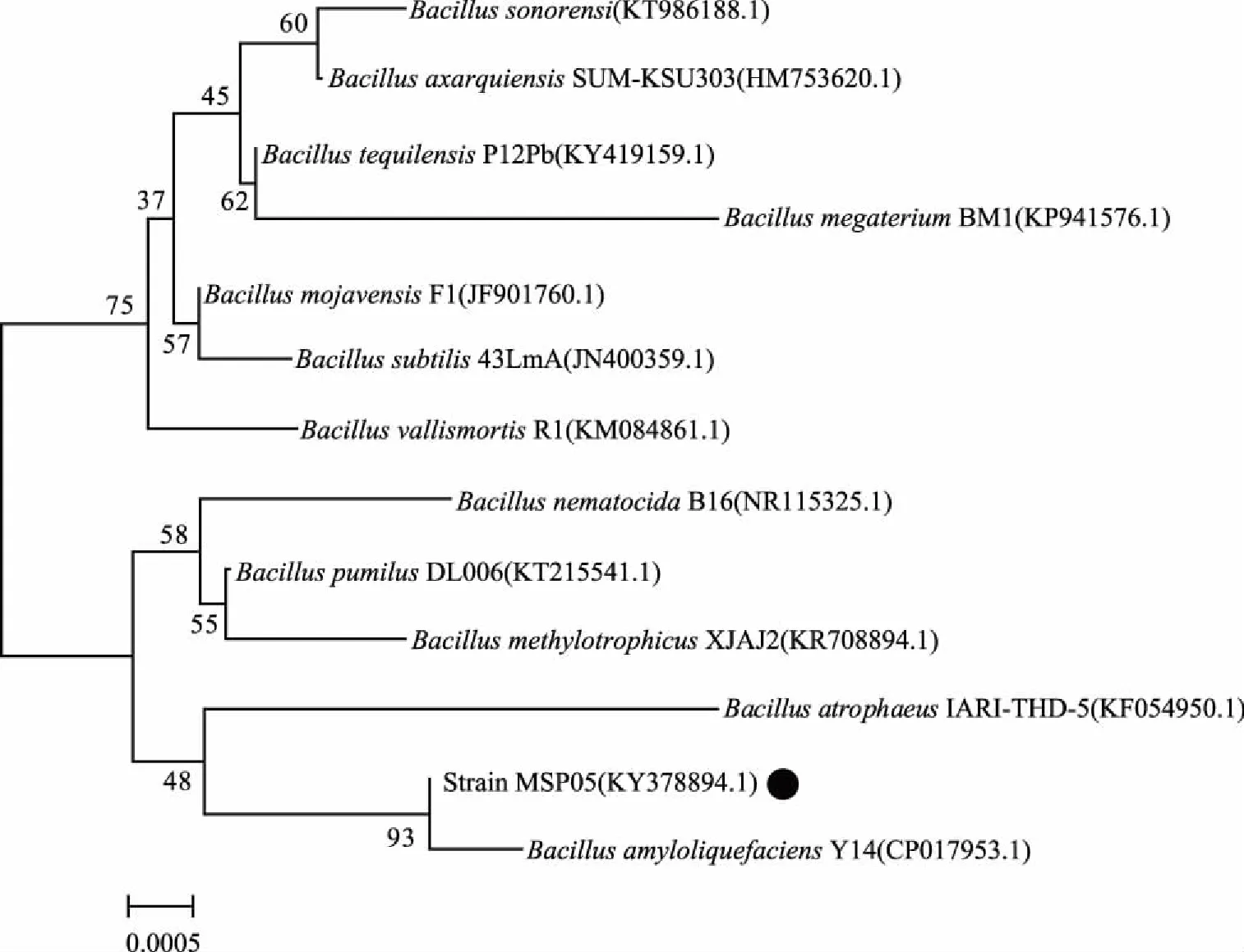
图3 基于菌株MSP05 16S rDNA序列构建的系统进化树Fig.3 Rooted phylogenetic tree of isolate MSP05 to other Bacillus species
2.3 耐有机溶剂蛋白酶MSP05的酶学性质
2.3.1 温度对酶活力及稳定性的影响 如图4所示,该蛋白酶在50 ℃时活力最高,在20~60 ℃的范围内保持50%以上的酶活力,当孵育温度为70 ℃、孵育时间30 min时,剩余酶活力为43.2%。蛋白酶MSP05的热稳定性如图5所示,低温(≤40 ℃)对蛋白酶MSP05的稳定性影响较小,在40 ℃孵育150 min之后,蛋白酶的仍保持60%以上的剩余酶活。当孵育温度达到60 ℃、孵育时间30 min时,剩余酶活力仅为7%。高温环境能够很快改变蛋白酶的空间结构,进而影响蛋白酶的活力。

图4 温度对酶活力的影响Fig.4 Effect of temperature on the activity of the protease
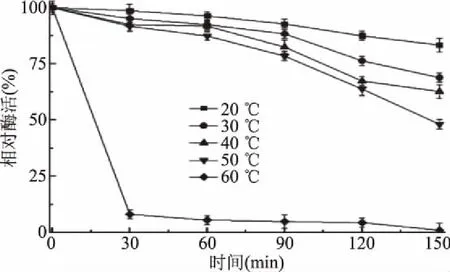
图5 温度对蛋白酶稳定性的影响Fig.5 Effect of temperature on the stability of the protease
2.3.2 pH对酶活力的影响 蛋白酶MSP05对弱酸或弱碱反应环境不敏感,对强酸和强碱环境较为敏感。如图6所示,在pH6.0~13.0的范围内,蛋白酶都能保持70%以上的酶活力,在pH10.0的条件下,蛋白酶的酶活力达到最高,当pH小于6.0或大于13.0时,蛋白酶的酶活力迅速降低至40%以下。过酸或过碱的环境会使酶蛋白变性失活,从而降低酶活力。
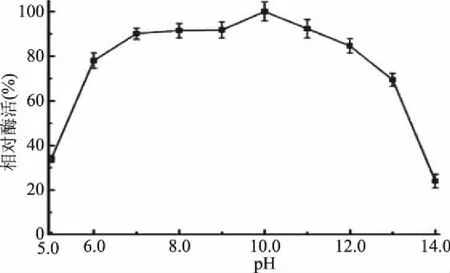
图6 pH对酶活力的影响Fig.6 Effect of pH on the activity of the protease
2.3.3 金属离子对酶活力的影响 表3显示了9种不同金属离子在2种浓度(5和10 mmol/L)下对蛋白酶活力的影响。由表3可知,在5和10 mmol/L,Fe3+、Mg2+和Ba2+对蛋白酶MSP05的活里具有明显的抑制作用;Mn2+和Cu2+对该酶的酶活具有明显的激活作用;其余的金属离子对该酶的活力具有不同程度的抑制作用。Mn2+、Cu2+在两种浓度下都对酶能起到明显的激活作用,可能是因为这些金属离子可以和碱基等形成稳定的簇聚离子,从而起到激活酶活的作用。
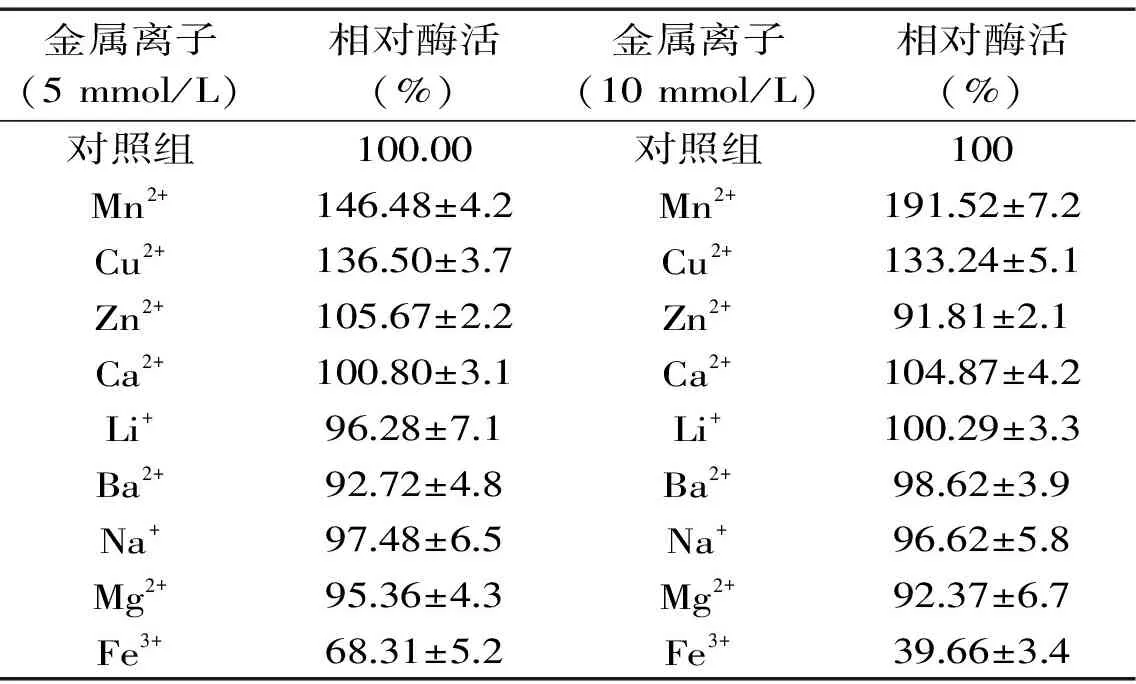
表3 金属离子对酶活力的影响Table 3 Effect of metal ions on the activity of the protease
2.3.4 有机溶剂对蛋白酶活力的影响 图7(a、b)分别显示了有机溶剂处理蛋白酶24 h和72 h后在复筛培养基上透明圈形成的情况。处理后的蛋白酶透明圈没有明显缩小,蛋白酶MSP05能够耐受有机溶剂。初步判定蛋白酶MSP05具有有机溶剂耐受性。
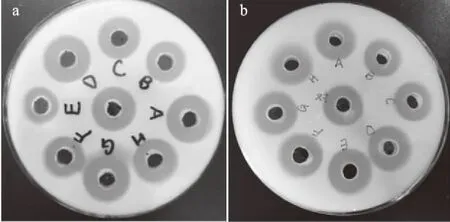
图7 有机溶剂处理后蛋白酶透明圈形成情况Fig.7 Transparent loop of protease after treated with different organic solvents注:A:环己烷;B:乙醇;C:乙酸乙酯;D:甲苯; E:正己醇;F:甲醇;G:正庚烷;a:24 h,b:72 h。
8种不同的有机溶剂分别处理24 h和72 h后蛋白酶的剩余酶活力见表4。甲苯、环己烷、正庚烷、二甲苯中的剩余酶活力较对照组更高。甲苯处理72 h后蛋白酶MSP05剩余酶活力甚至高达125.92%。乙酸乙酯、甲醇、乙醇会抑制酶活力,乙醇处理72 h后,剩余酶活力仅为51.23%。
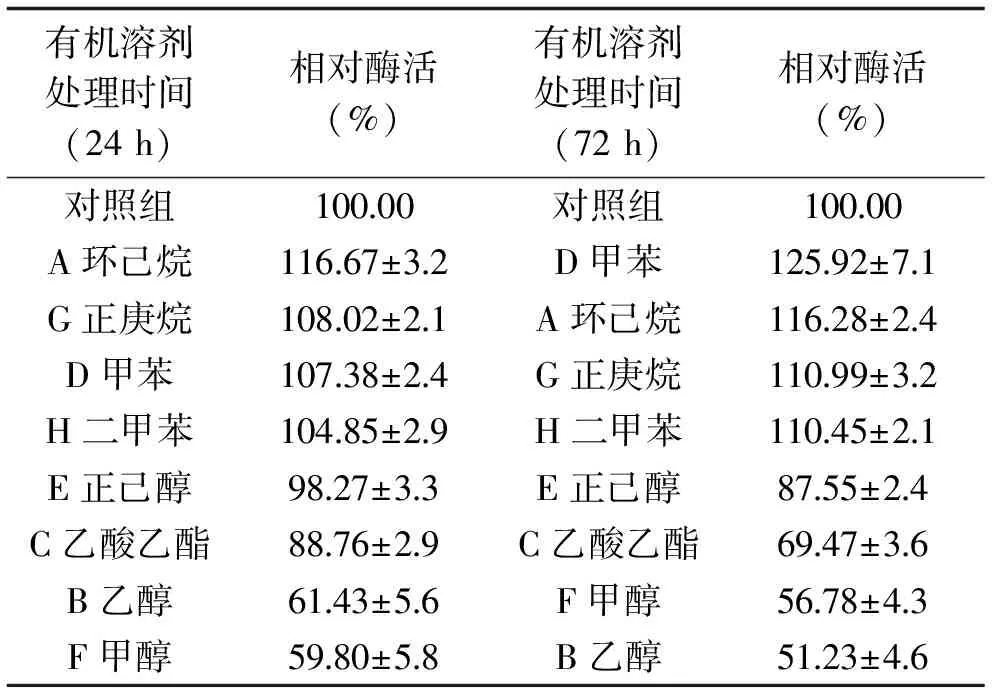
表4 有机溶剂对酶活力的影响Table 4 Effect of different organic solvents on protease activity
3 讨论与结论
目前已报道的耐有机溶剂蛋白酶主要来自陆源,多是从污水处理厂[12]、石油污染的土壤[7]中筛选得到,也有来从湖泊水样中筛选到的报道[13]。来自于海洋的耐有机溶剂蛋白酶的报道很少,仅有从原油污染的海底沉积物筛选的的枯草芽孢杆菌[14]等。解淀粉芽孢杆菌是抗菌防病领域的研究热点,对解淀粉芽孢杆菌产生抗菌物质的报道较多,但其产生耐有机溶剂蛋白酶在国内尚未见诸报端。
本研究从长期受化工污染的海域中分离获得的一株产耐有机溶剂蛋白酶的菌株MSP05为革兰氏阳性菌,鉴定为解淀粉芽孢杆菌。已报道的耐有机溶剂蛋白酶对有机溶剂的耐受性一般不强,当有机溶剂浓度达到20%后,蛋白酶的活力会有显著降低[15-16]。因为亲水性的有机介质会与酶争夺微量水,破坏酶的天然构象,影响酶活力,已报道蛋白酶对亲水性有机溶剂的耐受性也较弱,在经过亲水性有机溶剂处理后,酶活力通常会出现显著降低,在10%浓度的甲醇处理后,通常残留50%的酶活力[15]。而蛋白酶MSP05在经过50%(V/V)乙醇处理72 h后仍能保持51.23%酶活力。已报道的耐有机溶剂蛋白酶通常对温度和pH条件敏感,一般仅在中温、碱性的条件下(60 ℃,pH8.0)具有较高酶活力[16-18]。菌株MSP05产蛋白酶对pH和温度具有较好的适应性。
本研究分离获得的耐有机溶剂蛋白酶产生菌MSP05及其蛋白酶具有较好的耐有机溶剂特性。该酶的最适反应温度和pH分别为50 ℃和10.0,Cu2+、Mn2+对酶有激活作用,Mg2+、Fe3+和Ba2+对酶具有抑制作用。在50%甲苯处理72 h后蛋白酶MSP05剩余酶活力达125.92%。这种新颖的耐有机溶剂蛋白酶为有机相中蛋白酶催化合成反应提供了酶类资源,具有潜在的工业应用价值。

