苯酚-硫酸法与蒽酮-硫酸法测定麦冬中麦冬多糖含量的比较研究
◎ 张 妍,刘太林
(天津天狮学院,天津 301700)
麦冬 [Ophiopogon japonicas (Thunb.) Ker-Gawl]为百合科沿阶草属多年生植物麦冬的干燥肉质块茎,主要分布于四川、浙江及江苏一带[1-3]。《本草汇言》中记载:麦门冬,味甘、微苦,性微寒,归心、肺、胃经,可为清心润肺之药,常与其他中药配伍,用于治疗肺燥干咳、津伤口渴,心烦失眠、内热消渴以及肠燥便秘等[4]。麦冬的有效成分包括甾体皂苷、多糖、异黄酮和氨基酸等,其中麦冬多糖含量较高,其药理作用主要表现为抗肿瘤、抗心肌缺血、抗氧化、抗过敏、降低血糖、增强机体免疫、润肺平喘并保护外分泌腺等[5-8]。植物多糖的测定方法主要包括苯酚-硫酸法[9-11]、蒽酮-硫酸法[12-14]、还原糖测定法[15-16]、高效液相色谱法[17-18]、酶法[19-20]等,当前文献报道植物多糖测定方法以苯酚-硫酸法和蒽酮-硫酸法较为多见。本文分别采用苯酚-硫酸法和蒽酮-硫酸法测定麦冬中麦冬多糖含量,并对测定方法进行比较分析,为确定合理的麦冬多糖含量测定方法提供依据。
1 试验材料
麦冬为市售药材;无水葡萄糖标准品:上海源叶生物科技有限公司(纯度≥98%);蒽酮:上海国药试剂集团;苯酚、浓硫酸:天津市大茂化学试剂厂(分析纯);无水乙醇(分析纯):天津市汇杭化工科技有限公司。
UV-2500型紫外可见分光光度计:岛津仪器有限公司;100~1 000 μL、1 000~5 000 μL移液器:大龙兴创实验仪器有限公司;BSA124S型精密分析天平:赛多利斯科学仪器有限公司;WE-1型水浴恒温振荡器:天津市欧诺仪器仪表有限公司;RE-52AA型旋转蒸发仪:上海亚荣生化仪器厂;DH-101-3BS型电热恒温鼓风干燥箱:天津市中环实验电炉有限公司;TD5K-Ⅲ型低速离心机:长沙东旺实验仪器有限公司。
2 试验方法
2.1 试验溶液的配制
2.1.1 麦冬多糖溶液的制备
麦冬干燥后粉碎过80目筛,精密称取2 g麦冬粉末并加入50倍量纯化水,于70 ℃、振荡频率100 r/min条件下水浴振荡提取2 h,过滤除去药渣后减压浓缩至浓稠,加入8倍量冷无水乙醇静置过夜,离心取下层多糖稠膏,加入适量水溶出并定容至100 mL摇匀,再稀释250倍后摇匀得到麦冬多糖溶液。
2.1.2 葡萄糖标准溶液的制备
精密称取葡萄糖标准品5 mg,用蒸馏水定容至50 mL中,得到0.1 mg/mL标准溶液贮备液。分别量取0.1、0.2、0.3、0.4、0.8 mL和1.0 mL标准溶液贮备液置于10 mL容量瓶中稀释至刻度线,摇匀,即为浓度10、20、30、40、80 μg/mL和100 μg/mL的葡萄糖标准溶液。
2.1.3 苯酚溶液的制备
称取苯酚100 g,加0.1 g铝片和0.05 g碳酸氢钠常压蒸馏,收集(180±2)℃馏分[13]。精密称取馏分10 g,加蒸馏水定容至100 mL摇匀置于棕色试剂瓶中冰箱保存。
2.1.4 蒽酮-硫酸溶液的制备
精密称取0.5 g蒽酮,溶解于100 mL浓硫酸中,置于棕色试剂瓶中冰箱保存(临用现配)。
2.2 苯酚-硫酸法测定多糖含量
2.2.1 反应产物最大吸收波长的确定
分别精密量取葡萄糖标准溶液与麦冬多糖溶液2 mL置于比色管中,室温下分别加入6%苯酚溶液1 mL摇匀,缓慢加入浓硫酸5 mL,混匀后置于50 ℃条件下水浴显色20 min,流水冷却至室温,在400~700 nm波长区域扫描吸收曲线。
2.2.2 苯酚质量分数的确定
取样品溶液2 mL置于比色管中,以2 mL蒸馏水作为空白对照,室温下加入浓度分别为3%、4%、5%、6%和8%苯酚溶液1 mL摇匀,缓慢加入浓硫酸5 mL,混匀后置于50 ℃水浴显色20 min,流水冷却至室温,在490 nm处测定其吸光值,计算多糖含量。
2.2.3 浓硫酸用量的确定
取样品溶液2 mL置于比色管中,以2 mL蒸馏水作为空白对照,室温下加入6%苯酚溶液1 mL摇匀,分别缓慢加入浓硫酸4、5、6、8 mL和10 mL,混匀后置于50 ℃条件下水浴显色20 min,流水冷却至室温,在490 nm处测定其吸光值,计算多糖含量。
2.2.4 反应温度的确定
取样品溶液2 mL置于比色管中,以2 mL蒸馏水作为空白对照,室温下加入6%苯酚溶液1 mL摇匀,缓慢加入浓硫酸5 mL,混匀后分别置于30、40、50、60 ℃和70 ℃条件下水浴显色20 min,流水冷却至室温,在490 nm处测定其吸光值,计算多糖含量。
2.2.5 反应时间的确定
取样品溶液2 mL置于比色管中,以2 mL蒸馏水作为空白对照,室温下加入6%苯酚溶液1 mL摇匀,分别缓慢加入浓硫酸5 mL,混匀后置于50 ℃条件下水浴分别显色10、15、20、25 min和30 min,流水冷却至室温,在490 nm处测定其吸光值,计算多糖含量。
2.2.6 标准曲线的绘制
分别取各浓度的葡萄糖标准溶液2 mL置于比色管中,以2 mL蒸馏水作为空白对照,按照上述试验优化得到的最佳试验条件参数,在490 nm处分别依次测定吸光值,绘制标准曲线。
2.2.7 方法学指标的考察
取麦冬多糖溶液,按照上述试验优化得到的最佳试验条件参数,分别依次进行该方法的精密度、稳定性、重现性以及加样回收率的考察。
2.2.8 麦冬多糖含量的测定
取麦冬多糖溶液,按照上述试验优化得到的最佳试验条件参数,测定其吸光值,通过线性回归方程计算麦冬多糖含量。
2.3 蒽酮-硫酸法测定多糖含量
2.3.1 反应产物最大吸收波长的确定
分别精密量取葡萄糖标准溶液与麦冬多糖溶液2 mL置于比色管中,冰水浴中加入0.5%蒽酮-硫酸溶液4 mL摇匀,混匀后沸水浴中显色15 min,迅速置于冰水中冷却,在400~700 nm波长区域扫描吸收曲线。
2.3.2 蒽酮-硫酸溶液用量的确定
取样品溶液2 mL置于比色管中,以2 mL蒸馏水作为空白,冰水浴中加入0.5%蒽酮-硫酸溶液2、3、4、5 mL和6 mL摇匀,混匀后沸水浴中显色15 min,迅速置于冰水中冷却,在620 nm处测定其吸光值,计算多糖含量。
2.3.3 反应温度的确定
取样品溶液2 mL置于比色管中,以2mL蒸馏水作为空白,冰水浴中加入0.5%蒽酮-硫酸溶液4 mL摇匀,混匀后分别置于60、70、80、90 ℃和100 ℃水浴中显色15 min,迅速置于冰水中冷却,在620 nm处测定其吸光值,计算多糖含量。
2.3.4 反应时间的确定
取样品溶液2 mL置于比色管中,以2 mL蒸馏水作为空白,冰水浴中加入0.5%蒽酮-硫酸溶液4 mL摇匀,混匀后沸水浴中分别显色10、15、20、25 min和30 min,迅速置于冰水中冷却,在620 nm处测定其吸光值,计算多糖含量。
2.3.5 标准曲线的绘制
分别取各浓度的葡萄糖标准溶液2 mL置于比色管中,以2 mL蒸馏水作为空白对照,按照上述试验优化得到的最佳试验条件参数,在620 nm处分别测定吸光值,绘制标准曲线。
2.3.6 方法学指标的考察
取麦冬多糖溶液,按照上述试验优化得到的最佳试验条件参数,分别进行该方法的精密度、稳定性、重现性以及加样回收率考察。
2.3.7 麦冬多糖含量的测定
取麦冬多糖溶液,按照上述试验优化得到的最佳试验条件参数,测定其吸光值,通过线性回归方程计算麦冬多糖含量。
3 结果与分析
3.1 苯酚-硫酸法与蒽酮-硫酸法最大吸收波长的比较
采用两种方法分别对葡萄糖标准溶液和麦冬多糖溶液进行处理,经UV-2500紫外可见分光光度计扫描其在波长400~700 nm区域的最大吸收波长,其波长曲线如图1、图2所示。A曲线表示苯酚-硫酸法,B曲线表示蒽酮-硫酸法。
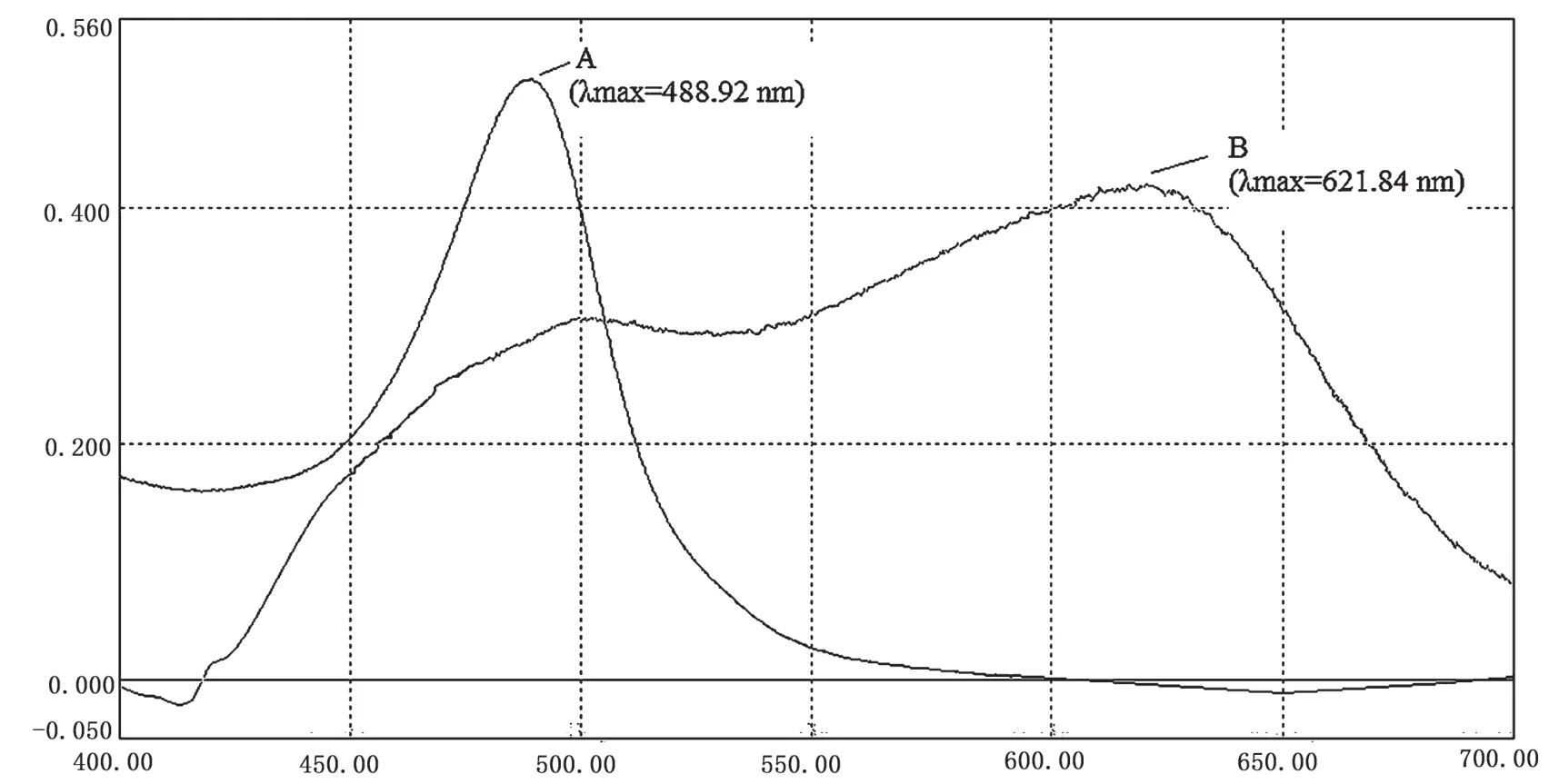
图1 葡萄糖溶液吸收波长比较图
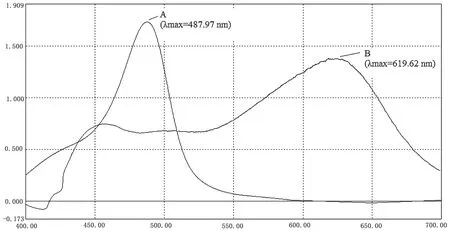
图2 麦冬多糖溶液吸收波长比较图
由图1和图2可见,采用苯酚-硫酸法测定时,葡萄糖和麦冬多糖在488 nm波长处有明显的最大吸收峰,其余波段无干扰峰,表明麦冬多糖在苯酚-硫酸作用下生成络合衍生物组分单一,显色效果良好。采用蒽酮-硫酸法测定时,葡萄糖和麦冬多糖在400~700 nm波长范围内吸收波长变化较大,在620 nm波长处出现较大吸收峰,但与苯酚-硫酸法相比,最大吸收峰稳定性较差,且存在干扰峰,测定方法准确性不高。
3.2 苯酚-硫酸法与蒽酮-硫酸法最佳条件的确定
3.2.1 苯酚-硫酸法最佳条件的确定
苯酚质量分数、浓硫酸用量、反应温度和反应时间对麦冬多糖吸光度值的影响如图3所示。综合考虑,苯酚-硫酸法测定麦冬多糖含量最佳条件为苯酚质量分数 6%、硫酸用量5 mL、反应温度50 ℃、反应时间20 min。
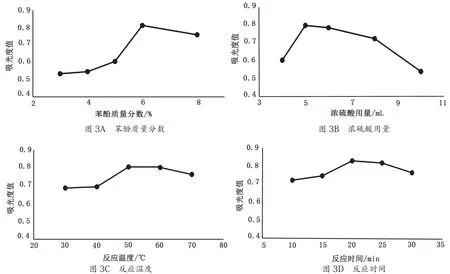
图3 4种因素对吸光度值的影响图
3.2.2 蒽酮-硫酸法最佳条件的确定
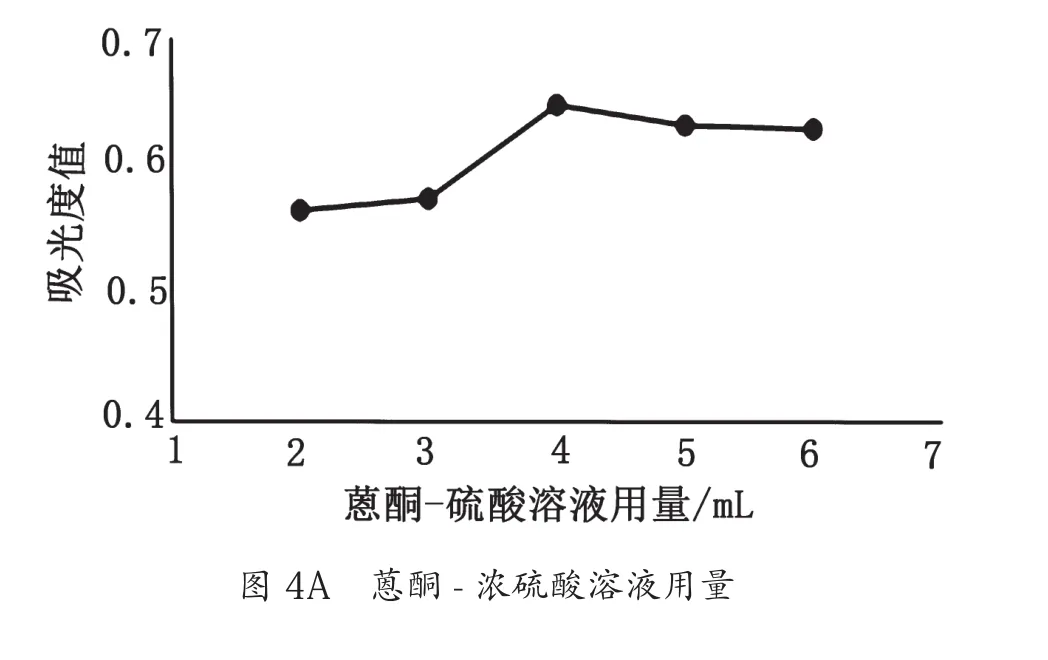
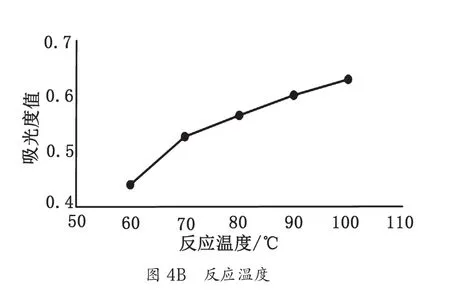
蒽酮-浓硫酸溶液用量、反应温度、反应时间对麦冬多糖吸光度值的影响如图4所示。综合考虑,蒽酮-硫酸法测定麦冬多糖含量最佳条件为蒽酮-硫酸用量4 mL、反应温度100 ℃、反应时间15 min。
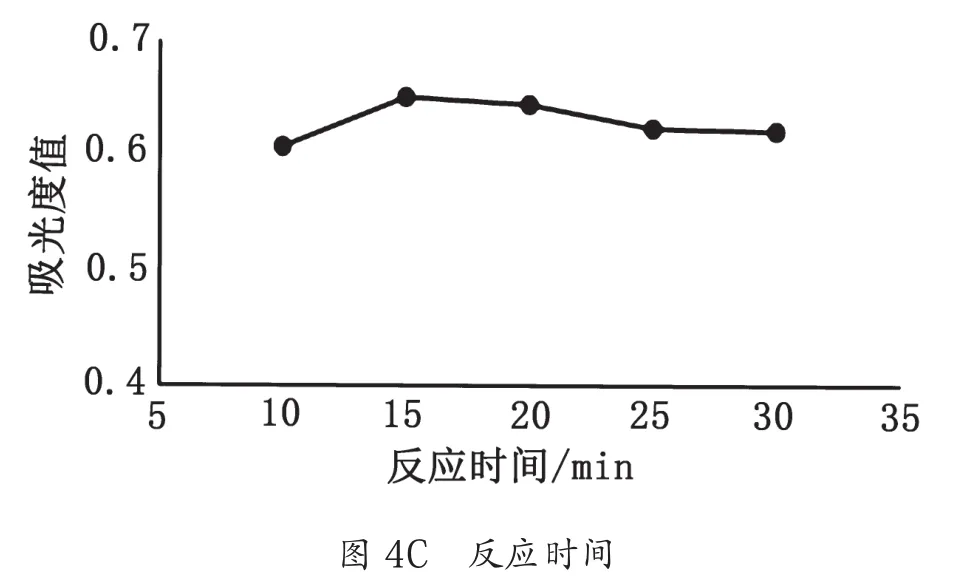
图4 3种因素对吸光度值的影响图
3.3 苯酚-硫酸法与蒽酮-硫酸法标准曲线线性的比较
以葡萄糖标准溶液浓度为横坐标,对应的吸光度值为纵坐标绘制标准曲线,如图5所示。采用苯酚-硫酸法所得回归方程为y=27.011x-0.0964(R2=0.999 1),在10~100 μg/mL浓度范围内线性关系良好,而采用蒽酮-硫酸法所得回归方程为y=22.929x-0.0513(R2=0.996 4),与苯酚-硫酸法相比,在10~100 μg/mL浓度范围内线性较差。

图5 两种方法测定葡萄糖标准曲线的比较图
3.4 苯酚-硫酸法与蒽酮-硫酸法方法学指标的比较
3.4.1 苯酚-硫酸法与蒽酮-硫酸法精密度的比较
如表1所示,苯酚-硫酸法测定麦冬多糖的精密度相对标准偏差为1.58%,小于蒽酮-硫酸法的测定结果1.96%,故苯酚-硫酸法的精密度略优于蒽酮-硫酸法。
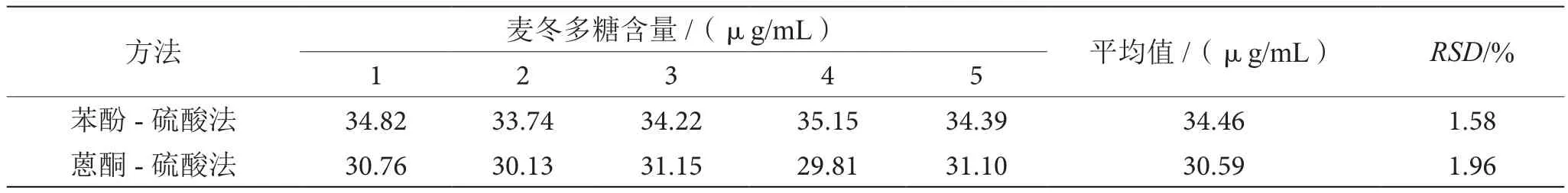
表1 两种方法测定麦冬多糖精密度的比较表
3.4.2 苯酚-硫酸法与蒽酮-硫酸法重复性的比较
如表2所示,苯酚-硫酸法测定麦冬多糖的重复性相对标准偏差为1.90%,明显小于蒽酮-硫酸法的测定结果3.53%,故苯酚-硫酸法的重复性优于蒽酮-硫酸法。
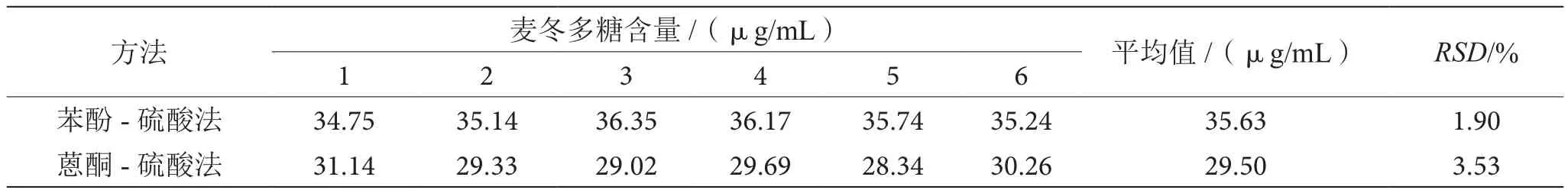
表2 两种方法测定麦冬多糖重复性的比较表
3.4.3 苯酚-硫酸法与蒽酮-硫酸法稳定性的比较
如表3所示,在0~120 min内,苯酚-硫酸法测定麦冬多糖的稳定性相对标准偏差为0.46%,略大于蒽酮-硫酸法的测定结果0.34%,故蒽酮-硫酸法稳定性略优于苯酚-硫酸法。
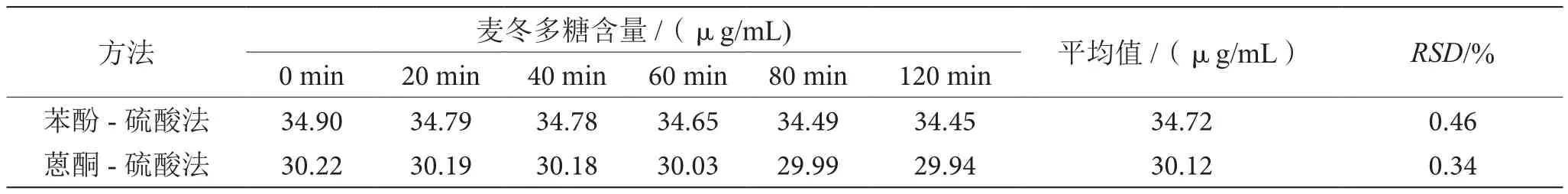
表3 两种方法测定麦冬多糖稳定性的比较表
3.4.4 苯酚-硫酸法与蒽酮-硫酸法加样回收率的比较
如表4所示,苯酚-硫酸法测定麦冬多糖的加样回收率为100.63%,优于蒽酮-硫酸法的测定加样回收率101.67%,且其RSD亦优于蒽酮-硫酸法,故苯酚-硫酸法加样回收率优于蒽酮-硫酸法。
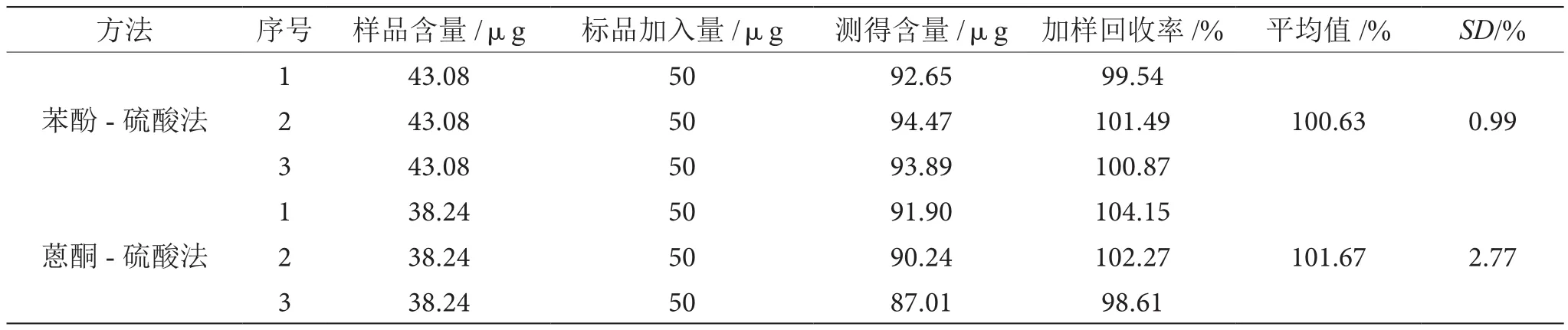
表4 两种方法测定麦冬多糖加样回收率的比较表
3.5 苯酚-硫酸法与蒽酮-硫酸法测定麦冬多糖含量的比较
如表5所示,苯酚-硫酸法测定麦冬多糖含量为42.96%,其相对标准偏差为1.73%,蒽酮-硫酸法测定麦冬多糖含量为38.56%,其相对标准偏差为3.40%。由此看出,苯酚-硫酸法测定多糖含量高于蒽酮-硫酸法,且相对标准偏差也较小,故苯酚-硫酸法优于蒽酮-硫酸法。
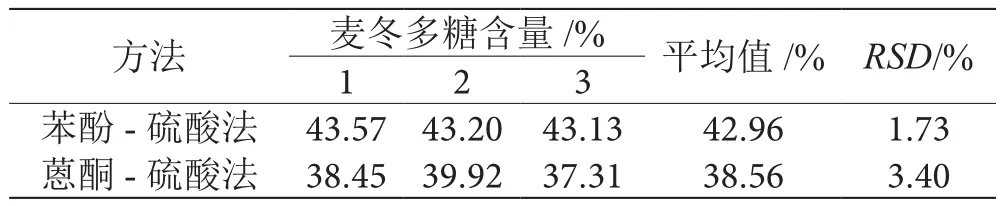
表5 两种方法测定麦冬多糖含量的比较表
4 结论
本研究以麦冬多糖作为研究对象,研究比较两种检测方法对其测定结果的影响,并对两种方法的检测条件进行了优化。苯酚-硫酸法测定麦冬多糖含量最佳条件为苯酚质量分数6%、硫酸用量5 mL、反应温度50 ℃、反应时间20 min,测得麦冬多糖含量为42.96%。蒽酮-硫酸法测定麦冬多糖含量最佳条件为蒽酮-硫酸用量4 mL、反应温度100 ℃、反应时间15 min,测得麦冬多糖含量为38.56%。在葡萄糖浓度10~100 μg/mL范围内,苯酚-硫酸法测定葡萄糖所得标准曲线相关系数(R2=0.999 1)大于蒽酮-硫酸法标准曲线相关系数(R2=0.996 4),说明苯酚-硫酸法制作标准曲线线性关系较好。苯酚-硫酸法测定麦冬多糖精密度RSD为1.58%、重复性RSD为1.90%、0~120 min内稳定性RSD为0.46%、加样回收率为100.63%。蒽酮-硫酸法测定麦冬多糖精密度RSD为1.96%、重复性RSD为3.53%、0~120 min内稳定性RSD为0.34%、加样回收率为101.67%。
结果表明:两种方法均具备操作简单、快速、准确和条件易于控制等优点,均适用于麦冬多糖成分的测定。综合上述实验结果考虑,相对于蒽酮-硫酸法,苯酚-硫酸法更加适用于麦冬多糖含量的测定,且与苯酚-硫酸法相比,蒽酮-硫酸法最大吸收峰稳定性较差,且存在干扰峰,测定方法准确性较差,故在麦冬中麦冬多糖含量测定时可优先考虑苯酚-硫酸法。

