血管壁面剪切应力的测量及其临床研究进展
杜宜纲 刘德杰 沈莹莹 朱 磊 何绪金 陈思平
1(深圳迈瑞生物医疗电子股份有限公司,广东 深圳 518057)2(深圳大学医学部生物医学工程学院,广东省医学信息检测与超声成像重点实验室,医学超声关键技术国家地方联合工程实验室,广东 深圳 518060)
心血管疾病一直居死亡率高的疾病之首[1]。根据《中国心血管病报告 2016》[2],2015年我国农村和城市居民的心血管病致死人数分别占总死亡原因的45.01%和42.61%,远高于死因排名第二位的肿瘤(农村和城市分别占22.02%和26.44%)。心血管病包括了心脏、肺部、脑部、肾脏和外周动脉相关的血管病变,其中危险系数最高的是心脏病和脑血管相关疾病。根据美国心脏病协会最新的统计[3],心脏病单独占据美国死亡率榜首,在美国1/7的死因是由冠心病引起的。如果将脑卒中也单独开列出来,其死亡率在美国可排第五。该统计还指出,脑卒中的死亡率在世界范围内排在了第二位,且致残率极高[3]。脑卒中经常是在毫无征兆的情况下发生[4],因此心血管疾病的预防至关重要。笔者将重点阐述一个与心脑血管疾病极其相关的重要参数,即血管壁面剪切应力(wall shear stress,WSS)。很多医学专家已证实,WSS对于研究动脉粥样硬化、内膜的增厚、斑块的形成与脱落、脑卒中都有重要的临床意义[5-13]。动脉硬化的形成需要长期的发展过程,WSS的最大临床价值在于它对血管未来是否发生病变具有一定的预判和调节能力[9,11-12,14-20],从而有可能对心血管病起到提前预防的作用[9,11,13,15,18,20-22]。当前WSS的计算主要基于各种医学影像技术,不同方法的计算结果偏差较大且难以验证。下面针对WSS现有的计算方法及其优劣势做综述性的阐述,结合WSS各种不同的临床应用研究结果做进一步的分析,并对未来WSS的临床价值给出更加深入的讨论和展望。
1 血管壁面剪切应力的计算
血管壁面剪切应力(wall shear stress,WSS)是血液在血管中流动时形成的作用于血管壁表面单位面积上的剪切力,它的物理单位为Pa,可记作N/m2,也有采用dynes/cm2,1 Pa=1 N/m2=10 dyne/cm2,有一些研究将其称为内皮的剪切应力(endothelial shear stress, ESS)[11,17-18,23]。这些实际上都是指血流与血管内壁(或内中膜)接触面上的剪切应力,因此WSS和ESS指的是同一个参数,只是叫法不同,本研究统一称为WSS。假设血管是圆柱形的,如图1(a)所示,WSS的计算公式[24-28]如下:
(1)
式中:用τ表示WSS,其中μ是血液黏滞系数(也称血黏度);v是与血管壁面测量点的切面平行的血流速度;R为血管内径,r代表血管横截面上任意点到圆心的距离,r=R表达了WSS的测量点,如图1(b)、(c)所示。
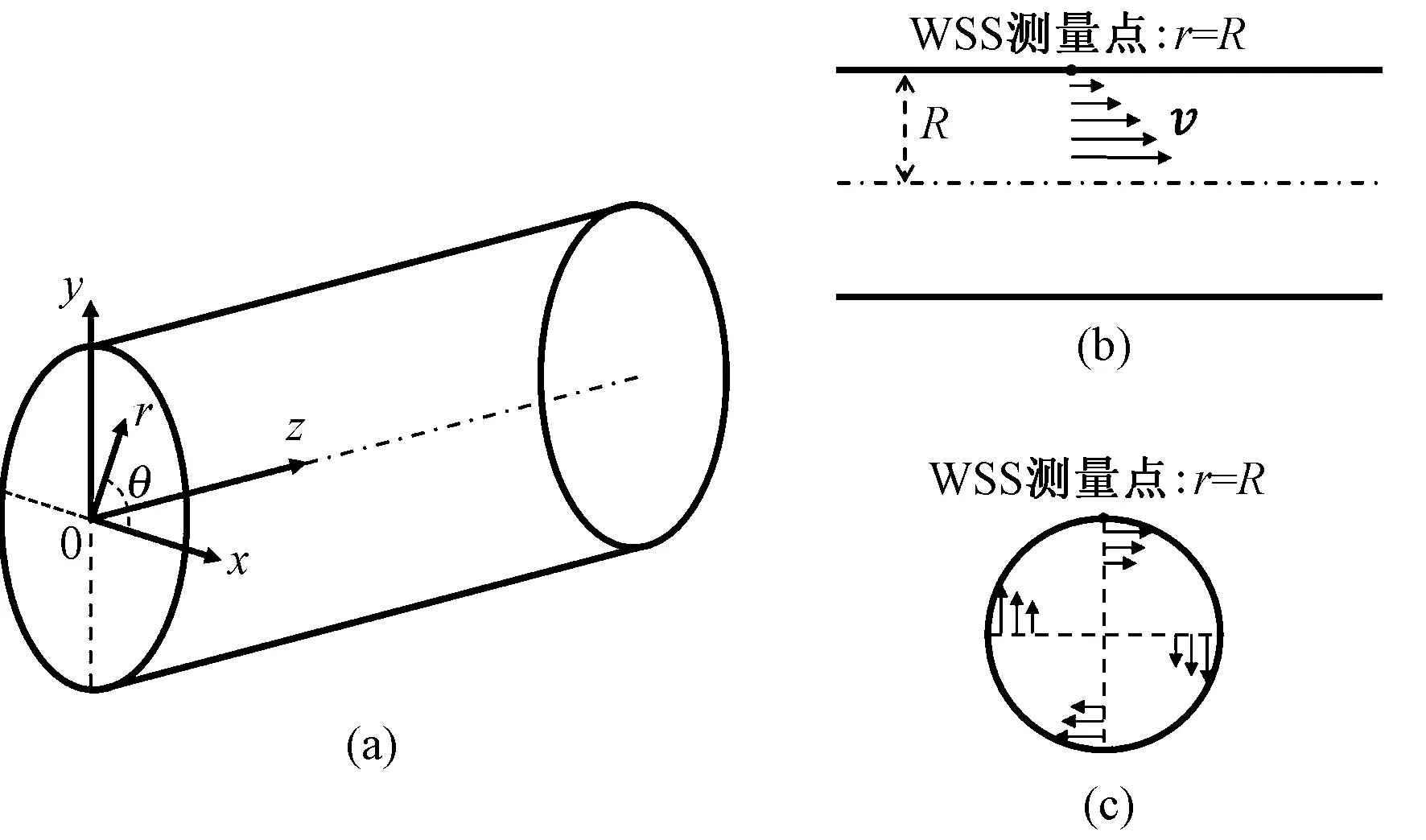
图1 圆柱形血管的WSS计算示意。(a)圆柱形血管;(b)血管纵截面;(c)血管横截面Fig.1 A diagram for calculating WSS for cylindrical vessel. (a) Cylindrical vessel; (b) Longitudinal section of vessel; (c) Cross section of vessel
血液在向前流动的同时,局部还可能存在周向的血流,如图1(c)所示。因此,在血管中,不仅存在轴向(纵向)的WSS,还有可能存在周向的WSS。
表1建立在牛顿流体假设基础上的血黏度值及对应的参考文献
Tab.1ConstantbloodviscositybasedonNewtonianfluidandthecorrespondingreferences

计算部位血黏度/cP对应参考文献颈动脉主动脉和颈动脉4.34Oyre等,文献[29]Potters等,文献[30]主动脉和颈动脉3.2Potters等,文献[31]人造血管的吻合动脉和静脉3.4Misra等,文献[33]颈动脉3.5Han等,文献[35]颈动脉3.5Mynard等,文献[36]颈动脉4Stokholm等,文献[37]肱动脉和股动脉3.4Silber等,文献[38]
血黏度可以通过体外测量得到,它是一个与血浆黏度、红细胞比容(压积)、WSR等参数相关的综合性指数,又称全血黏度(whole blood viscosity, WBV)。有研究指出,对于无血液疾病者,血黏度导致的WSS变化是可以忽略不计的[30,34,39]。还有研究[38,40]表明,当WSR的变化范围在20~1 580 s-1时,对应的血黏度为3.2~3.6 cP,由此也可以看出血黏度受WSR的影响并不是很大。但是,如果想要更加准确地研究血黏度和WSR的关系以及最终对WSS测值的影响,还需建立精确的数学模型。Weaver等提出了全血黏度的计算公式[41-43],有
lg(WBV)=lg(η)+[0.03-
0.0076lg(MWSR)]×Ht×100
(2)
式中:η为血浆黏度;Ht是红细胞比容(压积),正常值,男0.4~0.5,女0.37~0.48(注:Ht正常值范围根据不同实验条件可略有不同);MWSR为平均血管壁剪切率。
通过测量η和Ht,并根据血流速度梯度计算得到MWSR,这样就可以通过式(2)计算出WBV的值。下面再介绍一些有关血黏度计算方面的研究[43-45]。
Mutsaerts等采用了如下的计算公式[46-47],有
(3)
其目的在于精确地计算出一个心动周期内不同时相的WSS,包括了舒张早期、中期和晚期以及收缩期峰值的WSS[44]。Samijo等根据式(2),测量了111例健康人的全血黏度,56例男性的平均值为3.2 cP,55例女性的平均值为2.79 cP,发现血黏度会随年龄的增长而逐渐升高[43]。还有研究提出了只和红细胞比容相关的血黏度计算公式[45,48],有
μ=1.417 5+5.878 Ht-12.98Ht2+31.964Ht3
(4)
根据Casson模型,还可以通过血流量计算血黏度[45,49],有
(5)
或根据Casson模型的两个常数τy和k[45],计算血黏度,有
(6)
计算WSS除了式(1)之外,还有多种不同的估算方法[30,33,50-52],以下几种计算公式都是建立在层流血流且血管横截面为正圆的基础上的,有
(7)
(8)
(9)
(10)
式中:vmax是血管中心的最大血流速度,vmean是通过血管横截面的平均血流速度(这里所指的都是空间上的最大或平均速度);D和R分别为血管直径和半径。
对于圆形横截面的血管,D=2R,因此式(7)和(8)、式(9)和(10)实际上分别为两组相同的公式。此外,还可以根据血流量Q计算WSS(Hagen-Poiseuille equation[12,24,29,53]),根据Poiseuille′s Law可得到平均WSS,有
(11)
Misra等指出,WSS基于圆形横截面血管的计算只适用于动脉,而静脉的横截面通常是椭圆形的,如果计算动静脉的WSS,上述几种计算方法(式(7)~(11))存在一定的缺陷[33]。Efstathopoulos等分别采用了式(1)、(7)、(9)和(11)共4种方法计算WSS,通过比较发现,根据通用公式式(1)得到的WSS测值较小,而根据血管中心的最大速度式(9)得到的测值较大,20组测量结果的平均值对应式(1)、(7)、(9)和(11)分别为0.352、0.417、0.424和0.401 Pa[26]。注意,该研究的测量结果是升主动脉收缩期峰值的WSS,计算时基于的是收缩期峰值的即时速度和流量。此外,还有研究根据Womersley理论[36,54-55],将血流的脉动特点考虑进去,WSS随时间的变化可以通过以下公式计算出来,有
(12)
式中,τ(t)为即时WSS,vmax(t)是即时血流速度,ζk是Womersley number,J0和J1是一阶贝塞尔函数的第一和第二类,详细描述请见参考文献[36,54-55]。
Mynard等指出,基于空间最大血流速度的WSS计算是无法得到周向WSS的[36]。不仅如此,还有基于空间平均速度以及血流量的WSS计算同样也不能得到周向的WSS。此外,实际血管壁可能是不规则的非圆柱面,如图2所示,曲面上任意点的WSS可以用公式[30-31,56]表示为

(13)
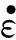
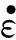
(14)

图2 曲面上的WSS测量Fig.2 Measurement of WSS on a curved surface
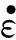

(15)
式中,×表示向量积(外积)。
相比式(13),式(15)从公式上直接确保了计算结果是与测量点相切的[56]。这是完整的三维空间向量WSS计算公式。
很多研究在测量WSS时,引入了另一个参数——振荡剪切指数(oscillatory shear index, OSI),其计算公式[60-61]为
(16)
OSI表达的是一段时间内(通常是一个心动周期T内)WSS方向的变化程度,是一个在0~0.5范围变化的值[62-63]。如果在T时间内,WSS的方向没有变化,则OSI为0;如果WSS方向变化频繁,极端的情况下其时间平均值可为0,这时OSI达到最大值0.5。
一些研究基于WSS和OSI的值,还引入了另一个参数——相对滞留时间(relative residence time,RRT)[64],有
(17)
式中,TAWSS(time-averaged WSS)为一个心动周期内的时间平均WSS,其计算公式为
(18)
此外,还有研究对横向WSS(transWSS)[65]进行了定义,有
(19)
以上介绍了WSS及其相关几个临床参数的计算公式。在WSS计算公式中,血流速度和血管空间信息一般通过医学影像技术测量得到。
2 不同医学影像技术对于WSS的测量
2.1 基于磁共振血管成像的WSS测量
基于磁共振(magnetic resonance imaging, MRI)血管成像测量的血流速度,再根据前面所述的公式计算WSS,是目前常用的、可靠性较好的一种人体血管WSS测量方法[66]。MRI血管成像,从实现技术上主要分为时间飞跃法(time of flight, TOF)和相位对比法(phase contrast, PC)。相位对比法对于血管背景抑制和血流速度方向的获取具有一定优势[67-69]。近年来绝大多数研究都采用了相位对比法(PC-MRI)进行WSS的测量[26,31-33,57,66,70],只有极少数的研究采用了TOF[35]。前面提到的Efstathopoulos等对比4种计算方法(式(1)、(8)、(10)和(12))[26],其原始数据血流速度都是采用PC-MRI测量得到的。PC-MRI计算血流速度的主要弊端是测量时间较长,并且由于磁共振的空间分辨率有限,在结构复杂的血管中,尤其是靠近血管壁的血流受到空间分辨率的影响,难以得到精确的速度信息。而计算WSS对靠近血管壁的血流速度精度要求很高,因此很多研究者采用了建立计算流体动力学(computational fluid dynamics,CFD)模型的方式,间接测量结构较为复杂的血管WSS。下面具体描述一下这种方法:首先,血管形状由磁共振成像得到,采用PC-MRI在直管处测量血流速度,作为CFD计算的边界条件(输入条件);然后,根据边界条件和血管的三维模型,通过CFD模拟出三维血流速度场;最后,再根据三维速度场及血管形状,计算出WSS。基于CFD的WSS计算[71-73],可以提高空间分辨率并得到复杂位置上的WSS分布。Papathanasopoulou等对比了采用CFD和PC-MRI计算分别得到的WSS测值[57],对于直管两者相差15%左右,而对于分叉血管,由于颈动脉窦部的血流比较混乱,PC-MRI对于窦部的WSS测量效果较差,而CFD在窦部模拟得到的WSS结果显然更加可靠一些。Cheng等采用了拉格朗日插值函数,使WSS的计算不受血管形状的限制[32],进一步提高了测量的稳定性。Han等做了CFD和TOF的对比实验,二者计算结果的Pearson相关系数大于0.8,P值小于0.001[35]。Potters等强调了3D血流速度计算问题,并基于PC-MRI阐述了三维的WSS计算方法[30-31]。
有研究指出,如果PC-MRI的空间分辨率无法达到0.5~1 mm[74-75],则血液与血管的分界线不容易被确定[20,66]。此外,也有研究指出,一般MRI的帧率也就是30~40 Hz[66,74-75],因此时间分辨率也会影响到WSS的计算。只有相对直的血管,基于PC-MRI的WSS计算才准确[74]。Cibis等也指出了PC-MRI的时间和空间分辨率较低的问题[70],他们对比了PC-MRI不同时间和空间分辨率的情况所得到的WSS值:平均流量和平均WSS与时间分辨率无关,最大流量和OSI与空间时间分辨率都有关;然而,平均和最大流量、WSS和OSI及它们的空间分布,并不是非常依赖空间时间分辨率[70]。此外,还有很多研究通过注入对比剂,实现增强磁共振血管造影成像(contrast enhanced magnetic resonance angiography, CE-MRA)[34,76-77],可以进一步提高速度测量精度,从而提高WSS的计算精度。
2.2 基于其他技术的WSS测量
除了MRI,还有一些基于其他医学影像技术的WSS测量方法。这些影像技术主要有计算机断层扫描(CT)和超声成像等,其中超声技术包括传统的多普勒超声成像、血管内超声(IVUS)和超声粒子流(UIV),下面将逐一介绍并阐述这些方法各自的优劣。
Han等采用了CT血管造影术(CTA)建立冠状动脉的3D模型,血流通过解Navier-Stokes方程仿真得到[6]。WSS则根据CFD模型计算得到[78],其边界条件来自CTA的结果。基于CT的WSS测量相比MRI少之又少,这与CT存在较大辐射不无关系。这类WSS的实际临床应用尚不明朗,因此基于无创且无辐射MRI的WSS测量是当前做临床研究的首选。
Wentzel等采用血管内超声(intravascular ultrasound, IVUS)进行WSS的测量[14],研究采用fusion of angiography and IVUS(ANGUS)技术得到3D冠状动脉[79],然后再根据CFD模型计算WSS的值。类似地,Schrauwen等通过仿体实验,对这类方法的计算速度和WSS的精度进行了分析[80]。IVUS的优势在于它具有超高的空间分辨率,非常适合对冠状动脉这种相对细一些的重要血管(相比主动脉和颈动脉)进行成像;但劣势也是显而易见的,它需要将导管式探头插入血管内,是有创的/微创的。
传统超声成像技术具有方便、无创、无辐射、快捷、实时和成本低的优势,但一般仅限于二维成像,因此基于传统超声通常测量的也是二维平面内的WSS。早期WSS计算基于超声多普勒原理测量的血流速度,是根据最大速度公式——式(9)或式(10)计算得到[31,51-52]。式中的最大速度值,是通过脉冲多普勒(PW)测量得到。基于超声的WSS和WSR的测量也非常之多[41,43,81-83],WSS和WSR是平行于血管壁的血流速度对血管壁产生的剪切作用。传统超声基于多普勒原理只能得到沿超声传播方向的血流速度分量,沿血管壁方向的血流速度只有在层流时才能计算出来。超声向量血流成像技术[84-88]可以得到血流速度的大小与方向,即向量速度,无论它是涡流、湍流还是其他复杂流动[86,89-90],这样就可以实现湍流、涡流等非层流对应位置的WSS测量。迈瑞公司实现了超声向量血流成像技术的产品化[86,91-92],将向量速度结合二维空间成像信息,得到速度梯度再乘上对应血黏度的值,也就是根据式(1)计算便可得到不同位置的WSS测值。
为了进一步提高WSS的测量精度,近年来还出现了基于超声粒子成像技术(ultrasound imaging velocimetry,UIV;或称为particle image velocimetry, PIV)的WSS测量方法[93-94]。Poelma等采用这种方法,致力于提高血管壁附近的血流速度精度,从而提高WSS测量的精度[93]。朱懿恒等基于PIV,测量了大鼠动脉模型的WSS[94]。上述研究都通过注入造影剂增强回波信号作为实现PIV的基础,以提高灵敏度和测量精度为目的,但这些都不是基于人体的研究结果。
2.3 WSS测量方法的优劣比较
以MRI为基础实现WSS的测量,是当前主流的WSS测量方法。通过文献调研可以看到,在绝大多数与WSS相关的临床研究中,WSS是利用MRI相关技术测量得到的。基于传统超声的WSS测量相比MRI更加简便、快捷且成本较低,也是做临床研究时常用的WSS测量方法之一。血管内超声是有创的且操作不便,主要应用于较细的血管,如冠状动脉。由于高频探头和造影剂的使用,血管内超声的空间分辨率优势是MRI无法取代的。利用超声粒子成像技术测量WSS的研究相对较少,加之造影剂的使用也会带来不便,目前还处于对其测量方法精度的研究中。超声向量血流成像几乎继承了传统超声的所有优势,它还可以得到相对准确的速度方向信息,因此可以应用到涡流处的WSS测量。表2比较了笔者所述的这几种方法对于测量WSS的各种优劣。
表2WSS测量方法的优劣对比
Tab.2ComparisonforthemeasurementofWSSusingdifferentimagingmethods

方法辐射创伤精度空间维度成本便捷速度MRI/MRA无无创或造影剂中三维高中慢CTA有造影剂中三维高低慢血管内超声无微创+造影剂高三维高低慢传统超声成像无无创低一维低高快超声向量血流无无创中二维低高快超声粒子成像无造影剂高二维中低快
CTA对于测量WSS的效果与MRA类似,但由于辐射量很大以及含碘造影剂的危害,所以不常用于WSS的测量,一般是在做CTA检查时顺便测量WSS。此外,CFD也是WSS测量的重要辅助工具,广泛应用在基于MRI的WSS测量中,可以有效地提高MRI测量WSS的可靠性。表2列举的几种三维成像(MRI、CT和血管内超声),如果能够结合CFD,WSS的测量精度则可进一步提高。但CFD是一个非常耗时的计算过程,它会消耗大量的计算资源,如果模拟的过多,很有可能引入许多新的误差。WSS测量的可靠性一直以来都是难以完全保证的,即使采用了同一种影像技术,不同计算方法得到的WSS值差别也很大[26]。但是,这并不意味着未来无法实现稳定、可靠和精确的WSS测量。靠近血管壁附近的血流是决定WSS的重要因素之一,而这部分血流速度相对较低,所以需要血流灵敏度达到一定要求。计算WSS时需要血流速度信息,包括其大小和方向,因此还要求高精度的速度定量测量。此外,在计算速度梯度时,空间分辨率也决定了WSS的计算精度。因此,只有影像技术的血流灵敏度、精度和空间分辨率的不断提高,才能保证WSS测量达到更加稳定和可靠的程度。
3 WSS的临床研究进展
下面将对现有的根据WSS测值所做的临床研究及结论进行综述性的归纳,介绍不同研究者根据WSS测值所得到的相应临床结论。根据不同的研究部位,将WSS相关的主要动脉血管研究分为4个部分,即颈动脉、主动脉、冠状动脉和其他动脉,逐一讨论现有的研究成果。
3.1 颈动脉相关的临床研究
颈动脉对于脑部供血至关重要。颈动脉的病变主要包括动脉粥样硬化、内膜增厚、斑块形成以及动脉瘤等,最后都会导致血管狭窄,造成脑供血不足。斑块一旦发生脱落,会随血流进入大脑,导致远端小血管阻塞,发生脑梗死,对人类健康造成极大的伤害[28]。然而,内膜增厚和斑块形成都需要一个长期的发展过程,所谓“冰冻三尺非一日之寒”。此外,增厚和生长斑块的位置也是可以追根溯源的。内膜增厚一般都是不均匀地发生在血管壁各个位置上的,现有的研究已指出,颈动脉窦处是颈动脉最容易生长斑块的位置[12,66,95-98],这与其管腔结构复杂不无关系。WSS计算公式如前所述,是与血流形态、速度大小和方向相关的。不同管腔结构造成血流形态的变化,同时也会得到不同的WSS测值。血管内皮细胞功能会受到WSS的影响[16,99],大量的研究数据表明“内膜增厚与较低的WSS有关”[8,52,74,97-98,100-101],笔者将此列为WSS研究的结论Ⅰ,以方便之后的论述。颈动脉窦处由于管腔形状的改变,导致血流形态的变化,通常在血流通过弯曲部位后产生较低的WSS,因此根据结论Ⅰ,这里是颈动脉最容易生长斑块的部位。Irace等发现,较低的WSS是颈动脉粥样硬化病情发展的一个主要因素[9]。Samijo等测量了111例健康人颈动脉的WSS值,结果显示WSS随年龄的增加而逐渐减小[43],这样建立在结论Ⅰ成立的基础上,与老年人更倾向于发生内膜增厚的事实也是相符的。此外,当血管变狭窄后,根据流体力学原理,狭窄处的血流速度会明显升高[98],从而可能引起速度梯度的增加,间接导致WSS的升高。随斑块的发展,原先低WSS的环境会随之改变,在斑块的肩部产生高WSS[11]。有研究指出,斑块肩部上游WSS较高,并有破裂倾向[102-103]。Harloff等比较了颈动脉内膜剥脱术前后的WSS和OSI值,发现狭窄处进行手术后,WSS和OSI的值均有所下降,尤其是在斑块下游[76]。通过这些文献可以归纳出第二个结论,即“当动脉发生较为严重的狭窄且未完全闭塞时,对应位置的WSS会升高”,笔者将此列为WSS研究的结论Ⅱ。Gnasso等发现,有斑块的动脉血管WSS低于无斑块的动脉血管WSS[100],注意这与结论Ⅱ并不矛盾,因为结论Ⅱ是指同一位置在不同狭窄程度时的WSS变化情况,而Gnasso等的阐述是基于不同位置的WSS[100],它实际上再次肯定了结论Ⅰ,之所以有斑块,可能正是因为此处的WSS偏低,而此时的斑块还未造成非常严重的狭窄。Xing等通过外科手术在小鼠右颈总动脉放置锥形套将血管逐渐套紧,通过人为干预建立颈动脉狭窄模型;经过9周后,发现靠近锥形套的位置存在大斑块,且WSS相对较高[104],这与结论Ⅱ是相符的。Lee等和Zhang等对健康人颈动脉分叉血管做了WSS、OSI和RRT的测量[105-106],前者研究发现RRT较高时,WSS较低且OSI较高。因此,推荐使用RRT作为一个单独的参数,可直接衡量测值较低且高震荡的WSS。根据文献[76,105-106]对OSI和RRT测值的临床研究结果分析,再结合结论Ⅰ,得到的新结论是“内膜增厚与较高的OSI和较高的RRT有关”,笔者将此列为WSS研究的结论Ⅲ。Markl等测量了颈动脉WSS的绝对值和周向WSS,发现周向WSS平均占WSS绝对值的31%[107]。这说明,在颈动脉窦存在螺旋状的血流;此时如果只考虑轴向WSS,那么实际的WSS可能被严重低估,会影响到临床风险评估的准确性。该研究还发现,比起正常人或已经做过外科手术再通后的血管,颈内动脉狭窄患者的血流经过狭窄处后会在远端呈现更多的螺旋状流动特点,而在远端位置,患者呈现较低的WSS和较高的OSI[107]。
3.2 主动脉相关的临床研究
主动脉是血液循环中直径最大的动脉血管。血液流出心脏后经历升主动脉、主动脉弓、降主动脉,然后到腹主动脉。主动脉弓处分出3根重要血管,尤其是负责大脑供血的两根颈总动脉。降主动脉和腹主动脉的分支血管,负责了脏腑各个重要器官的供血。因此,主动脉一旦发生病变,对身体各个部位的供血都有可能造成极其不利的影响。主动脉上WSS的测值相比颈动脉要低一些[30],根据Potters等对于志愿者的测量,主动脉平均WSS为0.4 Pa,而颈动脉达0.9 Pa[30]。目前多数对于主动脉WSS的测量和研究是以志愿者和健康人为主[26,30-31,108-112],并且研究对象以腹主动脉为主[108-113]。Oshinski等测量并研究了8个样本后,发现肾上腹主动脉心动周期内的平均WSS远高于肾下腹主动脉的平均WSS,对应的前壁和后壁分别为1.04和0.86 Pa(肾上)、0.47和0.61 Pa(肾下);最大WSS亦是如此,分别为4.8和5.4 Pa(肾上)、3.3和3Pa(肾下)[109]。实践证明,肾下动脉比肾上动脉更易发生动脉粥样硬化,也就是WSS相对较低的位置更易发生动脉硬化,这与前面所述的结论Ⅰ不谋而合。Taylor等对11例健康年轻人做下肢运动时的主动脉WSS变化做了测量,其中:腹腔干上方的主动脉做运动后,平均WSS由0.35 Pa提高到0.62 Pa;肾下腹主动脉做运动后,平均WSS由0.13 Pa提高到0.52 Pa[110]。Pedersen等通过测量8例年轻志愿者的腹主动脉WSS,用数据证实了较低和振荡的WSS是内膜增厚及早期粥样硬化发展的局部因素[111]。Oyre等测量腹主动脉后发现,最低的-平均和最高WSS以及最高的OSI均位于最容易发生动脉粥样硬化的位置,即肾下腹主动脉的后壁[112],再次证实了前面所述的结论Ⅰ和Ⅲ。Malek等通过体外实验,将牛的主动脉内皮细胞持续24 h暴露在低WSS(τ<0.4 Pa)环境中,发现内皮细胞会产生病变,并更易发生动脉粥样硬化[12]。Mahadevia等针对先天性二叶式主动脉瓣(BAV)疾病测量了WSS,发现BAV会使血流形态发生改变,并导致WSS的变化[114]。Meierhofer等发现,BAV患者的周向WSS是相对升高的[115]。Frydrychowicz等发现,主动脉瘤上的WSS是降低的,但周向WSS仍然较高[116]。Wentzel等研究了胸主动脉的WSS,除得到结论Ⅰ外,还发现通过降脂干预,局部WSS对于调节并使斑块减小所起的作用不大[117]。Peiffer等计算了兔子主动脉的TAWSS、OSI、RRT和transWSS[65],值得注意的是,最后这个参数得到了与前3个参数截然不同的分布图。由于transWSS是近年来新定义的参数,其相关性还有待进一步的临床研究。
3.3 冠状动脉相关的临床研究
冠状动脉的粥样硬化发病率很高,由于血管较细(相对主动脉和颈动脉),发生狭窄后影响心脏心肌供血,从而引发冠心病。2017年,美国心脏病协会将冠心病列为致死率最高的疾病,达到总死因的1/7[3]。寻找其发病原因、研究冠心病的发展机理和做提前预防,目前仍是人类探索的内容。与主动脉和颈动脉的影响机制相似,WSS对于冠状动脉粥样硬化也是具有结论I所述的特点,即WSS较低的区域会促进动脉粥样硬化,而高WSS会阻止粥样硬化[17]。Stone等对来自8个病人的12根冠状动脉血管(其中6根有放支架)做了6个月的随访研究:对于未放支架的血管,观察到WSS与斑块增厚成反比,即斑块在WSS较低的区域更易增厚;而对于支架内再狭窄的血管,则未发现与WSS的联系[18]。WSS对于动脉粥样硬化的影响,Wentzel等进行了更加深入的总结,指出在动脉硬化斑块生长过程中,WSS以不同的方式影响着血管的形状尺寸和血管壁的成分[11](注:他们将WSS称为ESS,两者表达的意思相同)。在持续的低剪切力环境中,斑块会变得脆弱和易损[11]。WSS在预测和研究冠状动脉粥样硬化的自然发展过程中,扮演着一个非常重要的角色[11, 118]。
3.4 其他血管相关的临床研究
一些研究测量了肱动脉和股(浅)动脉的WSR或WSS的值,并与颈总动脉的测量结果做了对比[38,42,55,119-120],如表3所示。其中,Dammers等采用的是变血黏度计算WSS[42],血黏度根据WSR通过式(2)计算得到;其余研究者则采用常数血黏度。在表3所列文献中,如只计算了WSR,则采用常数血黏度μ=3.5cP乘上WSR得到相应的WSS。根据表3所列结果可以看出,股(浅)动脉和肱动脉的WSS,其最大值通常小于颈总动脉的WSS(除文献[42]外),而平均值则均远小于颈总动脉的WSS。Ene-Iordache等测量了动静脉瘘的transWSS,发现它在结构较复杂的瘘口分叉处的值较大[121]。Misra等以动物为研究主体,测量了连接动静脉的人造血管附近的WSS值,发现吻合动脉与吻合静脉的WSS值相比对照组的动脉和静脉均有所提高[33]。此外,还有一些对血管的研究。Miura等提出,低WSS与大脑中动脉瘤的破裂是极其相关的[7]。陈鹤鸣等研究了支架参数对WSS的影响,并据此提出了支架设计方案[122],其目的在于尽量减少低WSS区域的面积。还有研究指出,了解WSS和心血管内皮细胞的相互作用,有助于支架形状的设计[13]。但Stone等在研究冠状动脉时,并未发现支架再狭窄与WSS有什么明确的关系[18]。
表3不同动脉各参考文献的WSS测值
Tab.3MeasuredresultsofWSSofdifferentarteriesfromdifferentreferences

计算部位WSS测值/Pa最大值平均值对应参考文献颈动脉5.741.41Stroev等,文献[55]肱动脉3.180.30Stroev等,文献[55]股动脉4.380.47Stroev等,文献[55]颈动脉3.321.17Wu等,文献[119]肱动脉3.200.68Wu等,文献[119]股浅动脉2.580.46Wu等,文献[119]颈动脉2.060.58Schmidt-Trucksäss等,文献[120]股动脉1.250.13Schmidt-Trucksäss等,文献[120]颈动脉3.41.15Dammers等,文献[42]肱动脉3.90.48Dammers等,文献[42]股动脉1.3—Silber等,文献[38]肱动脉1.2—Silber等,文献[38]
4 总结和展望
血管WSS的临床研究几乎已经有半个世纪了,早期的研究甚至可以追溯到上世纪60、70年代[123-128]。最近20年,随着医学影像技术的不断发展,使WSS更容易被测量,因此相关的临床研究也明显增多。笔者通过总结现有100多篇WSS相关的参考文献,列举了WSS对血管研究的3个临床上比较认可的结论:结论Ⅰ,内膜增厚与较低的WSS有关;结论Ⅱ,当动脉发生较为严重的狭窄且未完全闭塞时,对应位置的WSS会升高;结论Ⅲ,内膜增厚与较高的OSI和较高的RRT有关。
血管WSS的研究已日趋成熟,无论测量哪个部位,绝大多数的研究结论基本都可以归结到以上3点内容。然而,目前对于血管各种疾病的诊断,WSS这个临床参数仍未写入评价指南。这主要与两点因素有关。首先,WSS测量的准确性还有待提高。不同技术测量的结果有时差别很大[57,129-130],同一种影像技术采用不同计算公式得到的WSS测值也不够稳定[26],而WSS的测量结果难以通过体内实验进行验证。其次,WSS仍然处于基础性的研究,应用尚不普及;其结论对于疾病的预防作用大于诊断作用,对于已发生的疾病该值的具体临床应用价值仍然不够明确,只能在诊断中对其他标准起到一个辅助和佐证的作用。
未来,WSS需要在测量技术上有更大的提升,以满足不同部位的测量要求。磁共振可以实现三维向量血流,是目前计算WSS最常用的方法之一,这主要归根于它的几点优势,即无辐射、无创和三维空间成像;但由于空间分辨率不足,无法应对较细的血管,如冠状动脉。基于超声的WSS测量是最方便和最简单的WSS获取方法,但二维超声成像只能得到一个成像平面内的测值,且传统多普勒只能得到速度分量,因此测量的可靠性和可重复性都相对较差。随着超声向量血流成像技术的产品化,目前至少可以解决二维平面内速度矢量的测量,在一定程度上提高了WSS测量的可靠性和可重复性。未来,还需要三维超声向量血流成像技术,以便彻底解决这种测量缺陷。只有WSS测量的稳定性、可重复性、准确性和易获性都可以基本满足,其更多的临床价值才能被发现。

