冠脉重叠支架虚拟置入的有限元分析
潘连强 吴广辉 刘玉倩 舒丽霞 蔺嫦燕 蔡克强
(首都医科大学附属北京安贞医院 北京市心肺血管疾病研究所,北京 100029)
引言
临床上重叠支架已广泛应用到冠脉弥漫长病变的治疗中,国内外研究者进行了大量研究。国内的王辛等归纳了近年来冠脉内重叠支架置入术的相关研究,并对4种药物洗脱支架(drug-eluting stent, DES)重叠置入临床疗效进行对比,得出由于支架所负载的药物不同,其抗血管内皮细胞增殖的机制以及药代动力学等也各不相同[1]。肖瑞等研究62例重叠DES治疗冠脉弥漫长病变表明,重叠DES支架治疗冠脉弥漫长病能显著改善心脏功能及缓解临床症状[2]。
国外的Blachutzik等[3]、Ortega-Paz等[4]与Tarantini等[5]比较重叠与非重叠的生物可吸收支架(Bioresorbable scaffolds, BRS)治疗患者的临床结果,其中Blachutzik等所进行的回顾性研究共收录38个病例,对15例置入2枚BRS与23例置入1枚BRS进行比较;光学相干断层成像(optical coherence tomography, OCT)结果显示,虽然重叠BRS断裂发生率稍高,但总体发病率较低,并且支架段管腔截面积无差异,BRS的力学性能不受重叠置入的影响。在Nakazawa等进行的51例支架断裂病例研究中,重叠支架占45%,非重叠支架占22%,这与Blachutzik等的研究结论相同[6]。Ortega-Paz等共观察的1 477例患者中320例接受重叠BRS治疗,1 157例接受非重叠BRS治疗,发现一个月后支架内血栓无差异,一年后两组面向患者的复合终点(patient-oriented composite endpoint, POCE)也没有差异;Tarantini等共筛选1 384例患者,其中377例与1 007例分别接受重叠与非重叠BRS治疗。重叠组患者的多支病变患病率更高,SYNTAX评分更高,需要更为频繁地使用血管内成像,在368天的中位随访时间中,重叠和非重叠组在相关复合终点方面没有观察到差异。这些临床数据表明,重叠与非重叠BRS对临床结果没有太大的影响,重叠支架具有较高的断裂风险。
临床研究却不能直观地看出支架与血管之间的相互作用。通过数值模拟可以很好地解决这一问题。Xu等使用球囊扩张钴合金支架的理想模型进行有限元分析,研究得出支架重叠部分多为支架梁的棱棱相交,这是导致重叠支架断裂和支架内再狭窄的主要原因[7]。Rikhtegar等研究6例重叠支架与5例非重叠支架置入猪的左冠状动脉:使用腐蚀铸型技术,通过微型计算机断层扫描获得血管置入支架后的几何模型;通过计算流体动力学(computational fluid dynamic, CFD)获得血管壁面剪切应力(wall shear stress, WSS)的分布;研究结果表明,支架重叠区域具有较低的WSS(WSS<0.5 Pa),而重叠支架中支架梁轴向相同与支架梁交叉相比会导致较大区域的低WSS,重叠支架有可能对临床结果造成不利影响[8]。Rigatelli等使用CFD,通过对比研究BRS在重叠置入与边对边置入对血管内流体流变学的影响进行评估,得出重叠支架比边对边双支架具有较低WSS的结论[9]。在不考虑支架降解的情况下,边对边双支架技术优于重叠支架技术。
但是,在真实冠脉模型下,重叠支架置入是什么样的,支架之间、支架与血管之间的形态变化和应力变化是什么样的,这些对于临床研究有着很大的参考意义。因此,本研究使用患者冠脉模型进行重叠支架的虚拟置入,完整复制支架置入过程,并对支架与血管形态和应力情况的改变进行分析。为临床研究提供重要指导作用,给患者带来精准治疗。
1 仿真模型材料
1.1 个体化冠脉模型重建
本研究选择1例冠心病患者。患者冠脉支架置入前计算机断层扫描血管造影(CTA)提示,右冠状动脉(RCA)中段与远端呈弥漫性非钙化病变狭窄,置入2枚3.0 mm×30 mm的Resolute DES支架,支架串联,支架重叠部分为3 mm。对该病例进行有限元分析,以下仿真条件的设置和虚拟置入都基于临床操作步骤。
根据CTA影像DICOM数据,采用Spencer等[10]的方法,使用Mimics软件来重建个体化血管的血流区域模型,而血流域表面也等同于血管壁内表面;并生成血管内壁中心线,以0.2 mm的分辨率进行分割(见图1(a)),其中深色箭头指出管腔最狭窄处。由于从CT图像上难以获得RCA的外壁边界,所以借鉴Torii的方法[11],运用类似虚拟去除斑块的方式,建立不均匀壁厚血管壁模型。首先,假定血管内表面是沿中心线平滑变化的,祛除狭窄部分并修复血管内壁,从而创建出不狭窄的血管内壁;然后,使用血管内超声波探头测量血管壁厚度为0.5 mm,将新建的不狭窄的血管内壁外扩0.5 mm,便得到血管外壁(见图1(b))。

图1 冠状动脉三维几何模型的重建。(a)带有中心线的冠脉管腔模型;(b)不均匀壁厚的冠脉模型Fig.1 Reconstruction of 3D geometric model of coronary artery. (a)Coronary lumen model with centerline; (b) Coronary artery model with uneven wall thickness
采用Holzapfel等确立的表征冠状动脉壁材料性能的各向同性超弹性本构关系[12],基于六阶减缩多项式应变能本构模型,应变能密度函数(strain energy density function,SEDF)表达式为

表1动脉壁应变能密度函数系数
Tab.1Coefficientsofstrainenergydensityfunctionforthearterialwall
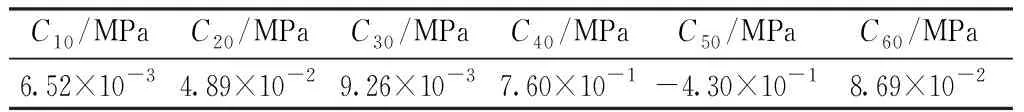
C10 /MPaC20 /MPaC30 /MPaC40 /MPaC50 /MPaC60 /MPa6.52×10-34.89×10-29.26×10-37.60×10-1-4.30×10-18.69×10-2
使用ANSYS ICEM CFD划分血管模型,采用高精度的六面体单元进行离散,单元类型为C3D8R,根据网格依赖性分析,最大尺寸不超过0.075 mm,网格单元数为610 606,节点数为521 010。在血管壁径向上生成为6层网格,单元大小由外向里成指数递减关系。图2中展示的是血管部分网格。

图2 部分血管离散化后的网格Fig.2 Schematic diagram ofpartial vascular discretization grid
1.2 支架和球囊模型
本研究采用SolidWorks,建立该患者所使用的Resolute冠脉支架和球囊模型。根据何玉娜等的研究结果,相对于无褶皱球囊,多褶皱球囊在血管预扩张和支架膨胀过程中具有更佳的性能[13]。这里采用具有6个褶皱的带有锥形末端的球囊结构。
Resolute支架由生物相容性良好的钴铬(CoCr)合金制成,这里设定该支架为各向同性弹塑性材料。参考Poncin的研究数据[14],Resolute支架材料的物理参数设定如下:杨氏模量为233 GPa,泊松系数为0.35,屈服应力为414 MPa,断裂应力为933 MPa,断裂应变为44.5%,材料密度为8.5×10-3g/mm3。为了保证可靠的求解精度,支架采用8节点线性减缩积分单元C3D8R。在支架厚度方向,布置4层单元。球囊采用热塑性聚酯材料,球囊弹性性能参数[15]如下:杨氏模量为1 455 MPa,泊松比为0.3,密度为1.256×10-3g/mm3。球囊被定义为膜材料,厚度为0.03 mm。本研究采用Abaqus,自带网格划分工具,对球囊模型进行网格划分。选择单元类型为4节点缩减积分膜单元(R3D4R),单元最大尺寸为0.02 mm时,满足网格依赖性要求。
2 支架虚拟置入方法
球囊扩张支架的完整变形过程包括:支架置入前压握收缩与弯曲输送到病变位置、支架置入过程中球囊膨胀带动支架扩张、球囊压力卸载后支架回弹几个阶段,同时具有几何非线性和边界条件非线性特征。
2.1 边界条件赋值
研究采用Abaqus/Explicit准静态模拟分析求解。设置罚函数摩擦系数为0.2,接触类型为通用自接触。考虑到球囊、支架和血管之间复杂的相互作用,仿真过程主要分为两个分析:球囊预扩张和支架置入。每个分析又分为扩张(1 ms)和回弹(0.5 ms)两个时间步。在仿真过程中,约束血管两端节点的环周向和径向自由度;将球囊的锥形末端与导管间进行刚体约束,保证两者间无滑移;支架模型不直接施加任何边界条件,力学行为完全由球囊扩张和血管相互作用来决定。整个受力过程为:球囊内表面受力膨胀,对支架内表面施压,使得支架扩张,支架外表面与血管内壁接触,并对血管内壁施压。为了确保仿真分析时准静态,监控动能和内能的比值(ALLKE/ALLIE)低于5%。
2.2 支架虚拟置入

图3 冠脉血管在支架虚拟置入过程中的形态学变化。(a)预扩张球囊到达病变处;(b)预扩张球囊扩张;(c)远端球囊与支架系统置入狭窄处;(d)远端支架扩张与回弹;(e)近端球囊与支架系统置入狭窄处;(f)近端支架扩张与回弹Fig.3 Changes to the lumen of the stenotic region during stenting procedures. (a) The pre expanded balloon arrived at the lesion; (b) Angioplasty balloon inflation; (c) Distal balloon stent system placement stenosis; (d) Dilatation and rebound of the distal stent; (e) Proximal balloon stent system placement stenosis; (f) Dilatation and rebound of the proximal stent
为了方便模拟与分析,根据实际情况,将整个重叠支架置入过程分为6个步骤。血管、球囊、支架等模型经过每一个步骤后都会维持一个特定的几何结构和应力状态。通过Abaqus软件的预定义场(predefined fields)功能,实现不同分析、不同模型之间的结果传递,使得仿真的准确性更高,具体模拟分析如下:
步骤1,支架的压握与弯曲输送。
为了仿真冠脉支架真实的压握收缩过程,创建一个包裹在支架模型外表面的刚性圆柱壳。通过控制圆柱壳的径向位移,使支架外径逐渐减小。圆柱壳与支架间采用硬接触摩擦,切向摩擦系数为0.3。在压握过程中,支架径向可以自由伸缩。
对支架进行弯曲输送处理,借鉴工业上管材弯曲的方法(即推弯法)进行弯曲输送仿真。沿血管中心线推送法准确性高,定位更加精确,是一种理想支架弯曲输送方法。沿血管中心线建立引导圆柱,刚性属性,不能穿透,支架弯曲输送过程中完全固定,始终不变形。在支架内边面里建立比支架前段稍长且长于支架后端40 mm的圆柱管,其外表面所有节点与支架内表面所有节点建立Tie绑定约束关系,通过给圆柱管一定的位移,使得其带动支架达到目标位置。
步骤2,球囊的预扩张。
球囊按照图1中的中心线弯曲达到狭窄位置(见图3(a)),对冠脉进行预扩张。在球囊预扩张分析中,对球囊内表面施加0.8 MPa的压力载荷,球囊直径增大,并带动狭窄血管管腔增大(见图3(b)),球囊压力卸载后撤出,血管会发生不同程度的线性回弹。提取中心线,用于远端支架的输送。
步骤3,远端支架的置入。
使用步骤2中提取的中心线,按照步骤1中的方法,把远端支架输送到血管狭窄处(见图3(c))。
步骤4,远端支架的扩张与回弹。
在远端球囊内表面施加1.2 MPa压力,在球囊的作用下支架与血管达到最大值,接着在球囊压力卸载后支架和血管发生回弹,撤出远端球囊(见图3(d))。提取变形后的血管中心线,用于近端支架的输送。
步骤5,近端支架的置入。
使用步骤4中提取的中心线,按照步骤1中的方法,把近端支架输送到血管狭窄处(见图3(e))。近端支架与远端支架重叠区域为3 mm。
步骤6,近端支架的扩张与回弹。
在近端球囊内表面施加1.2 MPa压力,在球囊的作用下支架与血管达到最大值,接着在球囊压力卸载后支架和血管发生回弹,撤出近端球囊(见图3(f))。近远端支架在血管中服役。
3 结果
3.1 支架形态的改变与应力分布
支架的压握包括支架的压握收缩和线性回弹两个过程:支架外径从2.75 mm减小至1.0 mm,并回弹到1.1 mm,冯米塞斯应力(VMS)分布非常对称,并且在U形弯曲区域出现峰值局部应力,如图4所示。因为发生了高塑性应变,支架可以保持压握收缩后的形态。最大塑性应变主要集中在钢梁的弯曲处,而支架梁直段较小。

图4 压握收缩过程中支架两个单元纵向(左)和径向(右)的直径与VMS的变化。(a)初始状态;(b)完全压握收缩;(c)弹性恢复后Fig.4 Longitudinal (left) and radial (right) views of two struts of the stent model with diameters and VMS changes in the process of grip contraction. (a) Initial state; (b) At full crimping; (c) After elastic recovery
远端支架与近段支架沿着不同的血管中心线进行弯曲输送,可以精确地定位到弯曲的冠脉病变位置。在支架输送过程中,支架应力发生改变。近端支架的输送过程如图5所示,很明显在弯曲较大的地方,应力达到最大值,而在其他位置应力变化不明显。达到病变部位后,球囊-支架系统如图6所示。

图5 压握收缩后的支架沿血管中心线弯曲输送过程Fig.5 Process of the bending analysis along the vascular centerline

图6 球囊-支架系统示意Fig.6 Schematic diagram of balloon stent system
近端支架置入过程特殊时刻的截面受力云图如图7所示。其中,(b)(c)展示支架回弹过程,支架应力减小,当球囊的内表面压力卸载模拟扩张回弹时,支架的应力大幅减小,其中极值应力只是扩张状态时的70%,应力分布情况比较类似,说明在扩张过程中支架发生大变形,并且大部分发生了塑性变形,正是这个塑性变形起到了对血管的支撑作用。
3.2 冠脉形态的改变与应力分布
在本研究中,重叠支架置入过程中冠脉形态变化如图3所示。首先,球囊预扩张过程可以部分缓解病变狭窄程度,增加管腔直径,有利于后续支架的顺利输送与扩张;其次,冠脉跟随球囊或支架的膨胀扩张而逐渐变形,在球囊压力卸载后,支架和血管在收缩作用下发生一定程度的回弹,进而达到最终配置。总之,支架的置入使弥漫性狭窄冠脉管腔得到恢复,血流得以通畅。
为了定量评估不同时刻管腔几何形态的变化,取图3中的4个特殊时刻用于后续结果分析:冠脉初始状态(a)为T0,initial state;球囊预扩张分析结束后(c)为T1,pre expansion;远端支架扩张回弹后(d)为T2,distal stent deployment;近端支架扩张回弹后(f)为T3,proximal stent deployment。将各时刻管腔沿中心线每隔0.2 mm进行切片,然后测量截面的最佳拟合直径、面积和环周距离,其中管腔截面积如图8所示,可以看出狭窄血管由于支架的置入获得了明显改善。狭窄程度最严重的地方位于冠脉长度53 mm处,而在59 mm处值陡然增大,这是血管分叉几何结构导致的计算结果。

图7 不同时刻冠脉(左)与支架(右)横截面。(a)近端支架置入;(b)近端支架扩张最大时刻;(c)近端支架回弹服役Fig.7 Coronary artery(left)and stent(right)cross-sectional force nephogram at different times. (a) Proximal stent placement; (b) The maximum time of proximal stent expansion; (c) The proximal stent rebounded and then served

图8 支架置入过程中不同时刻冠脉管腔截面面积大小Fig.8 Computed area profile of the coronary artery at four specific stages of stenting
从图8可以看出,T0初始时刻,冠脉管腔截面积平均为1.4 mm2,符合临床上重度弥漫性狭窄病变诊断结果。其中,管腔截面积小于1.7 mm2的占支架段冠脉总长的68%,而最狭窄处的狭窄率达到90%。T1预扩张后,管腔狭窄处截面积达到2.6 mm2左右,说明球囊预扩张可以显著增加支架段血管管腔面积。T2远端支架置入后,远端支架段血管达到6.5 mm2左右,管腔最狭窄处达到了4.3 mm2,对分叉部位的影响不是很大。T3近端支架置入后,近端支架段管腔截面积也达到6.5 mm2左右,在支架重叠处管腔截面比周围处略大。管腔截面积与环周距离呈现相同规律。
重叠支架置入后冠脉壁最大主应力的分布云图如图9所示。可以看出,非支架重叠区域血管内壁受力均匀,保持在0.32~0.56 MPa之间;T2远端支架置入后,再进行T3置入近端支架,管腔截面积在支架重叠部位有所增大,用来补偿重叠支架所占有的空间。支架重叠区域受到的应力最大,主要集中在0.64~0.81 MPa之间,其中最大值达到0.976 MPa。

图9 重叠支架置入后冠脉壁最大主应力分布云图Fig.9 Maximal principal stress distribution on the arterial wall following the double stenting procedure
4 讨论
使用有限元模型,通过计算机仿真模拟来预测和解释临床问题已得到广泛应用。与大部分的研究使用理想模型相比,本研究从CTA中重建出患者冠脉病变区域3D几何模型,支架建模参数来源于临床数据,并且根据支架工业制作流程,在模拟中对支架进行了压握处理,使仿真结果更加精确地接近真实情况。根据实际临床步骤,模拟了完整的重叠支架虚拟置入过程,取得了较好的效果。
本研究对重叠支架的虚拟置入过程进行了详细的讨论:球囊-支架系统模型和血管模型的建立、支架的压握收缩、支架弯曲输送定位、球囊预扩张、支架扩张回弹服役。对支架置入过程中不同时刻血管和支架形态学以及生物力学性质做了详细的评估,研究证明了重叠支架有限元分析的可行性。
研究表明,球囊预扩张可以对狭窄管腔进行初步的塑形,由于血管具有一定的弧度,使得两支架在置入后成一定的角度。如图10所示,支架大部分位置存在较大应力,其中最大应力分布于支架U形弯曲部位的内侧表面,支架梁的应力相对较小。这由于该结构支架的扩张主要是通过使支架弯曲位置的角度变大来实现的,而支架梁主要起到连接作用。应力最大值为640 MPa,支架在安全工况范围内。其中,最大应力位于远端支架,这是由于为了达到目标直径,位于外层的远端支架过度扩张来补偿空间所致,因此也造成血管在此处受力最大,同时支架对血管造成一定的抻直效果。支架段血管沿轴向最大主应力分布情况如图11所示。可以看出,同一区域的管壁与支架梁所接触区域比非接触区域受力大,造成受力图呈锯齿形。总体上,非重叠区域受力为0.35 MPa左右,支架重叠区域受力达到0.6 MPa左右,在血管最狭窄区域应力达到0.5 MPa左右。所以,在重叠支架置入中,支架的重叠区域应当避开血管弯曲较大的区域。从图8~11可以看出,支架重叠区域管腔通过过度扩张来补足重叠支架所占的空间,使得支架重叠区域血管管腔截面积达到正常值,从而造成血管壁受力较大。Timmins等研究证明支架对动脉壁施加高的应力会导致血管新生内膜增生明显增加,并且会引起更加严重的病理反应[16]。因此,重叠支架段血管在介入治疗中是最受关注的,也是最关键的部分。支架重叠区域应当避开重度狭窄和严重钙化区域,防止对血管造成损伤。在研究中,将斑块看作与血管壁相同的材料属性,因此未出现贴壁的不良现象(见图7)。

图10 支架重叠区域远端支架及其受力最大的U形支柱的应力特写Fig.10 Close-up of the stress of the distal stent and its most stressed U-shaped struts in the overlapping region of the stent.

图11 沿轴向分布的血管壁面应力Fig.11 Stress distribution along the axial direction of vessel wall
本研究为临床的研究提供了一种思路。辅助医师针对个体化患者采取精准医疗,可以节约成本,提高手术质量,具有重要的临床意义,并且可以为后续实验打下研究基础,提供研究方向。例如:可对支架置入后的血管进行流体分析,进行重叠支架置入后血流动力学的研究,进行不同类型的重叠支架虚拟置入的对比研究,也可进行重叠支架的疲劳寿命和支架断裂风险的评估。
研究尚存在不足,第一,缺少冠脉重叠支架虚拟置入后与实际支架置入后的形态对比;第二,没有进行斑块的分离,把斑块与管壁看作是同一物质;第三,血管的外壁和血管壁厚度没能在真实的影像中获得。
5 结论
研究包括了从支架的压握与输送到扩张服役整个流程,得出如下结论:支架在压握收缩和扩张期间的最大应力位于支架钢梁U形弯曲处,重叠支架可使狭窄血管血流得以通畅,支架重叠区域支架与血管的受力较大。在重叠支架置入中,应当注意支架重叠区域的远端支架和血管壁受力大小,避免重叠区域出现在血管较大弯曲处。

