生长调节剂对东京野茉莉插穗生根及其生理生化的影响
陈 晨,彭 欢,张子晗,喻方圆
(南京林业大学林学院/南方现代林业协同创新中心,江苏南京210037)
东京野茉莉(Styraxtonkinensis)为安息香科安息香属落叶乔木,分布于热带和亚热带海拔100~2 000 m的疏林或林缘,主要分布于江西、福建、湖南、广东、广西和云南等地[1]。东京野茉莉喜湿润疏松土壤,较耐贫瘠和耐旱,在药用、油用、材用和观赏方面均有较高的利用价值[2-4]。东京野茉莉种子大小年现象明显,且存在休眠特性[5],给播种育苗带来一定困难。目前,对东京野茉莉研究主要集中在树种分布[6]、花色成分[7]、繁育系统[8]和木材材性[9]等方面,其中对东京野茉莉种子内油脂成分及含油率已经有了较为深入的研究[10],但对其扦插繁殖研究鲜有报道。
因此开展东京野茉莉扦插繁殖研究十分必要。本试验通过研究不同生长调节剂种类对东京野茉莉硬枝扦插生根率、平均生根数、平均根长等影响,以及生根过程中插穗营养物质含量和相关抗氧化酶活性的变化,探讨其扦插生根机理,试验结果可为东京野茉莉无性系扦插快繁提供科学依据。
1 材料与方法
1.1 试验地概况
试验地位于南京市六合区马集镇中华茉莉谷苗圃基地(32°11′N~32°27′N, 118°34′E~119°03′E)。年平均气温15.1 ℃,平均日照时数2 199.4 h以上,常年平均降雨量1 000 mm左右,属北亚热带季风温湿气候区。扦插池(20 m×1.2 m×0.5 m)中的基质为(蛭石-珍珠岩,V/V=2∶1),使用多菌灵800倍液消毒,翻晒一周后备用。
1.2 插穗的采集与制备
2017年3月24日,选取生长健壮、长势一致、无病虫害、无机械损伤的3年生东京野茉莉的1年生木质化侧枝采穗,插条长度10~12 cm,保留3~4个芽,形态学上端平剪(切口距第一个芽1 cm),下端斜剪(切口位于芽背面,节下方0.5 cm)。
1.3 试验设计
本试验共设4个处理,即将剪好的插穗基部2/3浸没于浓度为200 mg/kg的IBA、NAA和ABT 3种不同的生长调节剂中2 h,以清水浸泡为对照。采用单因素随机区组试验设计,共设置3个区组,每个区组设置4个小区,每个小区随机安排1个处理,每个处理60根插穗。其中30根用于生根情况分析,另30根用于扦插过程中取样测定营养物质含量和相关抗氧化酶活性。将处理好的穗条垂直插入基质中,保留插穗端部1/3于基质外。
1.4 插后管理
扦插后将插穗周围基质压实,随即浇透水,并设置自动间歇喷雾系统:每隔15 min,喷雾15 s;雨天不喷。扦插1个月后加盖遮阳网(遮阳度70%),持续降雨时加盖塑料薄膜。
1.5 插穗营养物质含量和相关抗氧化酶活性变化的测定
从插后当天即开始取样,以后每10 d取样1次,共7次,每个处理每次在重复内随机抽取4根插穗,3个重复共12根,置于干冰桶中带回实验室,切去插穗形态学上端1/3,迅速剥取余下插穗韧皮部,于-70 ℃冰箱保存待测。可溶性糖含量、可溶性蛋白含量及超氧化物歧化酶(SOD)活性采用李合生[11]的方法测定,过氧化物酶(POD)活性、多酚氧化酶(PPO)活性及丙二醛(MDA)含量采用高俊凤[12]的方法测定。
1.6 插穗生根过程观察及生根情况的统计
结合生理生化分析取样,观察不同处理插穗的外部形态变化及不定根的发生情况;扦插60 d后调查统计生根率(%)、平均生根数(条/株)、平均根长(cm)和生根指数。计算方法如下:
生根率=(生根插条总数/总插条数)×100%
(1)
平均生根数=总根数/生根插条总数
(2)
平均根长=根长之和/总根数
(3)
生根指数=生根率×平均生根数×平均根长
(4)
1.7 数据统计与分析
在Microsoft Excel 2007中录入试验数据,计算重复间均值、方差及制作图表。使用SPSS 18.0软件进行单因素方差分析,当P<0.05时进行Duncan多重比较。为使数据在方差分析前符合正态分布,对于方差不齐的数据进行数值转换,其中,对生根率进行平方根反正弦转换,平均生根数、平均根长及生根指数进行平方根转换。
2 结果与分析
2.1 不同生长调节剂处理对东京野茉莉插穗生根的影响
由表1可知,3种生长调节剂处理与对照相比均可显著或极显著提高东京野茉莉插穗生根率、生根数、平均根长及生根指数。各处理中,以200 mg/kg NAA处理插穗生根率、生根数、平均根长及生根指数均最高,且与其它各处理相比差异达显著或极显著水平。200 mg/kg IBA与200 mg/kg ABT相比,插穗生根率、生根数、平均根长及生根指数的差异均不显著。由此可知,东京野茉莉硬枝扦插以选择200 mg/kg NAA浸泡插穗基部2 h效果最佳。

表1 不同生长调节剂处理对东京野茉莉插穗生根的影响
同列数据后不同小写字母表示差异显著,0.01 Different lowercase letters after data in the same column mean significant difference,0.01 东京野茉莉硬枝扦插过程中,可溶性糖含量变化如图1所示。可溶性糖是插条生根的主要营养物质[13]。200 mg/kg ABT和200 mg/kg NAA处理的插穗可溶性糖含量在扦插初期有一个短暂积累的过程,而对照组上升不明显。随后可溶性糖含量下降,各处理和对照均在20 d下降到谷值,原因是插穗消耗自身可溶性糖以维持自身生命活动;扦插20 d后,各处理组插穗和对照可溶性糖含量开始上升。此时为愈伤组织诱导期,插穗基部代谢活跃,插穗内的淀粉水解使可溶性糖含量升高,为后期生根储备足够的碳源。扦插30~50 d,经200 mg/kg ABT和200 mg/kg NAA处理的插穗可溶性糖含量呈下降趋势,因为此时期伴随着愈伤组织和不定根的形成,呼吸作用增强,体内可溶性糖消耗量增加,而对照组和200 mg/kg IBA处理的插穗可溶性糖含量继续上升并在40 d达到峰值,可见插穗经200 mg/kg ABT和200 mg/kg NAA处理不定根形成期提前。50 d后,200 mg/kg ABT、200 mg/kg NAA和对照组插穗体内可溶性糖含量则一直呈上升趋势,可能是在扦插过程中由于不定根的发生以及新叶的生成,光合作用生成光合产物,向插穗基部运输减缓了可溶性糖的消耗。而200 mg/kg IBA的可溶性糖含量继续下降,可能由于此时是不定根大量生成期,插穗体内需要消耗可溶性糖含量,以满足能量供应。 东京野茉莉硬枝扦插过程中,可溶性蛋白含量变化如图2所示。在硬枝扦插生根时,可溶性蛋白含量的变化呈现先上升后下降的趋势。扦插后0~10 d,200 mg/kg IBA和200 mg/kg ABT处理均使东京野茉莉插穗韧皮部可溶性蛋白积累。而对照组和200 mg/kg NAA处理的插穗可溶性蛋白含量在10 d后才开始稳步上升。200 mg/kg ABT、200 mg/kg NAA和对照组插穗可溶性蛋白含量在30 d上升到最大值。这段时间可溶性蛋白含量的升高可能主要因为随着愈伤组织的形成以及不定根的发生,需要积累此类物质。可溶性蛋白与植物形态发生联系密切,能调节细胞的生长和分化,在植物生长发育过程中起重要作用。东京野茉莉插穗在40 d后,各处理和对照的可溶性蛋白含量均呈下降趋势,这可能与不定根的伸长仍然需要消耗大量的营养物质有关,可溶性蛋白的消耗将用于新细胞的形成。扦插末期,可溶性蛋白含量趋于平稳,则说明韧皮部可溶性蛋白的积累与损耗趋于稳定。 图1 东京野茉莉硬枝扦插过程中可溶性糖含量的变化Fig.1 The dynamic changes of soluble sugar content within the S.tonkinesis hardwood cuttings 图2 东京野茉莉硬枝扦插过程中可溶性蛋白含量的变化Fig.2 The dynamic changes of soluble protein content within the S.tonkinesis hardwood cuttings 东京野茉莉硬枝扦插过程中,POD活性变化如图3所示。在东京野茉莉硬枝扦插生根过程中,扦插初期各处理及对照POD活性均呈上升趋势。200 mg/kg NAA、200 mg/kg IBA处理和对照组插穗在第10天达到峰值,200 mg/kg ABT处理的插穗在第20天达到峰值,且各处理组POD活性均高于对照组,由此说明生长调节剂处理对扦插初期POD活性的上升有一定的作用,可促进愈伤组织形成。之后POD活性开始下降。在不定根出现期处理组POD活性又出现一个峰值,200 mg/kg NAA处理组第二个峰值出现在第40天,而200 mg/kg IBA和200 mg/kg ABT处理组第二个峰值出现在第50天。对照组POD活性变化不大,而且均低于处理组,说明生长调节剂处理下的插穗POD活性明显增加,有效促进了愈伤组织和不定根的形成。 图3 东京野茉莉硬枝扦插过程中POD活性变化Fig.3 The dynamic changes of POD activity within the S.tonkinesis hardwood cuttings 图4 东京野茉莉硬枝扦插过程中PPO活性变化Fig.4 The dynamic changes of PPO activity within the S.tonkinesis hardwood cuttings 东京野茉莉硬枝扦插过程中,PPO活性变化如图4所示。在东京野茉莉硬枝扦插生根过程中,对照组和处理组插穗PPO活性都出现了两个峰值,分别在20 d和50 d左右,这两个阶段分别是愈伤组织形成期和根系大量生成期,说明PPO的活性能有效的促进插穗愈伤组织的形成、分化以及不定根的生长。处理组插穗在生根后期PPO活性有所下降,而对照组插穗在50 d后继续上升,200 mg/kg IBA和200 mg/kg NAA处理的插穗PPO活性高于对照,说明IBA和NAA处理使根系形成期提前且提高插穗韧皮部PPO活性。 东京野茉莉硬枝扦插过程中,SOD活性变化如图5所示。扦插生根过程中,东京野茉莉韧皮部SOD活性大致呈先上升后下降的趋势。SOD活性在插后40 d左右达到最大值,之后逐渐降低。经生长调节剂处理后插穗的SOD活性均高于对照。扦插40 d后,随着插条不定根的生长,SOD活性逐渐降低。 图5 东京野茉莉硬枝扦插过程中SOD活性变化Fig.5 The dynamic changes of SOD activity within the S.tonkinesis hardwood cuttings 图6 东京野茉莉硬枝扦插过程中MDA含量变化Fig.6 The dynamic changes of MDA content within the S.tonkinesis hardwood cuttings 东京野茉莉硬枝扦插过程中,MDA含量变化如图6所示。扦插开始后,MDA含量开始上升,各处理和对照在20 d左右达最大值,随后MDA含量开始下降。扦插40 d后,各组处理及对照MDA含量变化趋于平稳。 本试验结果表明,3种生长调节剂处理均可显著提高东京野茉莉扦插生根率、生根数、根长及生根指数,其中,以200 mg/kg NAA处理的插穗生根效果最好,生根率、生根数、根长及生根指数均显著高于200 mg/kg ABT和200 mg/kg IBA处理。而在蔷薇扦插生根过程中,200 mg/kg IBA处理的插穗生根效果要优于200 mg/kg NAA[14],可见不同树种扦插生根最适宜生长调节剂种类不同。 碳水化合物尤其是可溶性糖是插穗能量的主要来源,可作为呼吸底物被利用,为插穗的生根及生长提供能量。本试验中,扦插初期经生长调节剂处理后的插穗可溶性糖含量上升,为愈伤组织的诱导奠定物质基础;随着愈伤组织和根原基的形成,体内可溶性糖大量消耗导致其含量降低;扦插20 d后,由于插穗萌芽展叶,叶片光合作用以及贮藏淀粉的水解使穗条中可溶性糖含量增加,但随着插穗不定根的形成,生理代谢活动增强,养分消耗大于积累,可溶性糖含量降低。这一结果与喜树扦插生根过程中插穗内可溶性糖含量变化规律一致[15]。可溶性蛋白含量的变化趋势则是先上升后下降,王政等[16]在研究牡丹试管苗与扦插苗生根过程中营养物质含量变化时也得出了同样的结论。生长调节剂处理能提高可溶性蛋白的积累量。 POD是一种含铁卟啉辅基的保护酶,广泛分布在植物体内并参与多种生化过程[17]。本试验中,东京野茉莉插穗在生根过程中POD和PPO均出现了两个峰值,这与宋金耀等[18]进行的毛白杨(Populustomentosa)嵌合体扦插生根过程中POD活性变化研究结果一致,而榛子(Corylusheterophylla)[19]扦插生根过程中POD活性仅有1个峰值,这可能与插条所受胁迫程度有关。扦插初期POD活性上升消除体内过多的内源IAA[20];同时,POD能够促进木质素的合成以及木栓层的形成,加强细胞壁刚性[21];更重要的是,POD作为抗氧化系统酶之一,能够参与自由基的清除。所以,POD活性的上升不但有利于愈伤组织和根原基的诱导,也增强新生根系的细胞壁强度,降低了插穗在离体环境中的胁迫程度。对照组POD活性较低,说明生长调节剂处理的插穗POD活性明显增加,有效促进根系形成。PPO活性与植物不定根的形成联系密切。酚类物质在不定根形成和发育过程中起到了非常重要的作用,有研究认为,PPO能够催化酚类物质和IAA形成“IAA-酚酸复合物”的生根辅助因子,从而促进不定根的形成[22]。本试验中插穗PPO活性第一个峰值比第二个峰值低,可能的原因是大量生根阶段高活性PPO有助于生根;且处理组较对照组峰值提前,说明PPO的活性能有效促进插穗愈伤组织的形成以及不定根的发生,生长调节剂处理能促进插穗生根。Molnar[23]发现,在绣球(Hydrangeamacrophylla)茎组织不定根发生时,PPO活性显著增高;用多效唑处理菜豆(Phaseolusvulgaris)插条后,其大量生根阶段PPO活性大幅上升[24]。 SOD能清除过量的活性氧,使植物自由基水平保持正常。在愈伤组织和不定根发生期,基部的营养物质和超氧阴离子大量积累,SOD活性增强。本试验中,处理组和对照组插穗SOD活性大致呈现先升后降的趋势,且处理组高于对照组。活性升高的原因可能是细胞代谢旺盛,切口处产生了较多的自由基,导致了SOD活性升高。后期不定根生长到一定数量,以及新叶片逐渐展开,插穗代谢水平趋于稳定,体内自由基含量下降,SOD活性逐渐降低。张鸽香等[25]对紫薇(Lagerstroemiaindica)的扦插试验也证明了此观点。MDA含量可以评价细胞抗氧化能力,反映植物遭受逆境伤害的程度,正常生长的植物体内MDA含量很少,逆境条件下含量升高。本试验中,扦插初期因离体插穗受到逆境伤害MDA含量上升到一个峰值;此后随着SOD活性的上升,MDA含量开始下降;最后插穗生理机能逐渐恢复,生长趋于稳定,MDA含量保持在较低水平。由此可知,MDA含量随着生根进程表现出有规律的变化。2.2 扦插过程中营养物质含量的变化
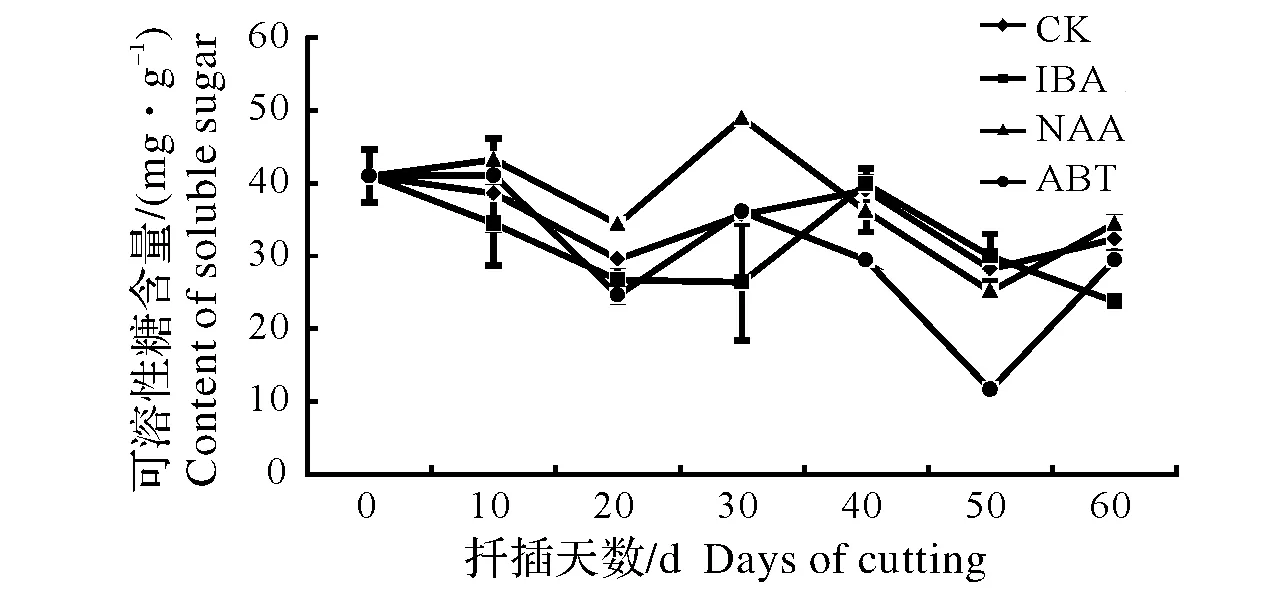
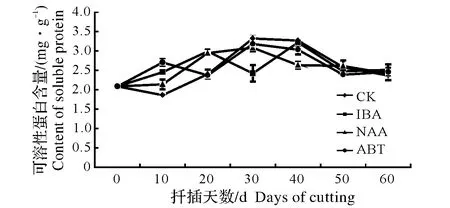
2.3 扦插过程中POD活性变化
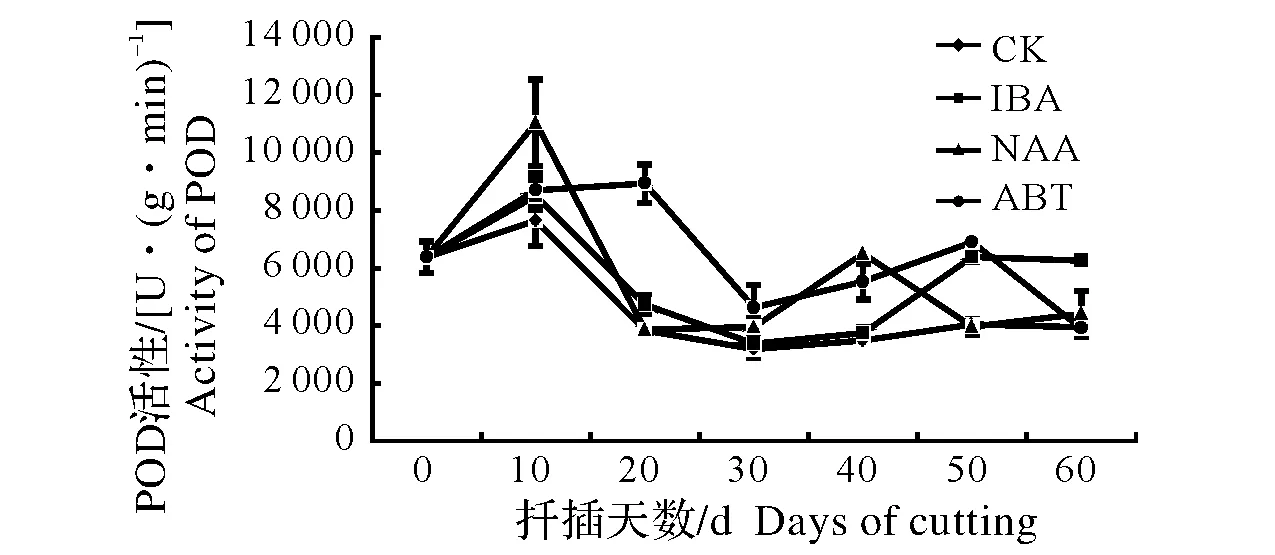

2.4 扦插过程中PPO活性变化
2.5 扦插过程中SOD活性变化
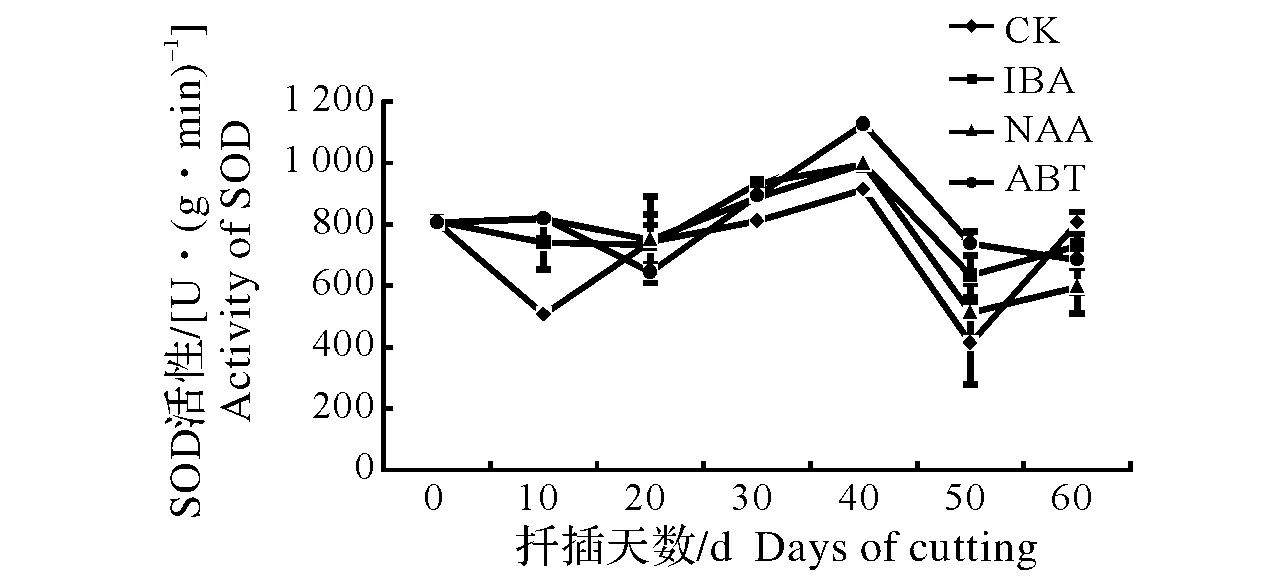
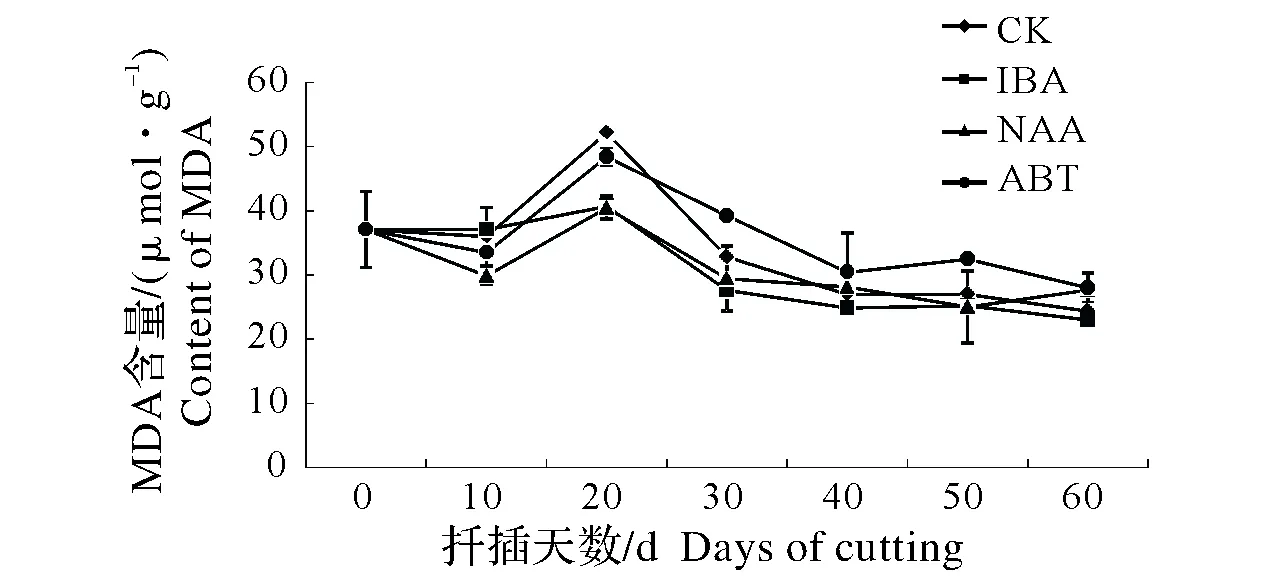
2.6 扦插过程中MDA含量变化
3 讨论

