RCAS1基因与乳腺癌相关性分析
覃新干,党裔武,韦康来,刘金禄,张小彬
(1.广西医科大学第一附属医院胃肠腺体外科,广西 南宁 530021;2.广西医科大学第一附属医院病理科,广西 南宁 530021)
乳腺癌是目前威胁女性健康的主要因素,根据世界卫生组织报道,全球女性新发乳腺癌病例数和乳腺癌死亡病例数均位居各类癌症的首位。我国乳腺癌发病率呈逐年上升趋势,发病高峰在45~60岁,有年轻化的趋势[1]。近年来,我国乳腺癌发病率的增长速度是全球的2倍多,特别在城市地区,像大多数其他国家一样,乳腺癌是我国女性最常见的癌症[2]。研究乳腺癌的发生及预防乳腺癌的发生更显为重要和迫切。随着肿瘤发病机制研究的深入,研究者越来越意识到肿瘤的发生、发展是肿瘤细胞与宿主之间相互对抗和博弈的过程,宿主细胞与肿瘤之间的相互作用对肿瘤的进展、转移及转归具有关键的影响,而宿主的免疫系统和其形成的免疫微环境在肿瘤进展和转移中起至关重要的作用。SiSo细胞上的受体结合肿瘤抗原(receptor-binding cancer antigen expressed on SiSo cells,RCAS1)是一种新的肿瘤相关抗原,具有促进肿瘤细胞逃避免疫监视,影响癌组织间质微环境的作用[3]。那么,RCAS1与乳腺癌的发生是否有关系呢?本文通过免疫组化检测RCAS1基因在乳腺癌组织的表达情况,初步探讨其与乳腺癌发生的关系。
1 资料与方法
1.1 临床资料 收集2013年1月~2015年10月在广西医科大学第一附属医院住院并手术治疗的105例乳腺癌患者的癌组织、癌旁组织及年龄、肿瘤大小、病理组织学分级、淋巴结等临床病理资料。所有患者术前均无化疗、放疗及免疫治疗等,病理学诊断均为浸润性导管癌。全部为女性患者,年龄24~81岁。标本均经10%中性甲醛固定、石蜡包埋、常规切片、HE染色后病理学检查确定。
1.2 主要试剂 RCAS1抗体购自美国SANTA CRUZ生物技术有限公司,SupervisionTM鼠、兔通用二抗检测系统购自上海长岛生物科技有限公司。
1.3 方法 免疫组化染色参照抗体说明书操作,4疫组常规石蜡组织切片65℃烘烤2 h,二甲苯脱蜡,梯度酒精至水。将切片浸入预热至沸腾的柠檬酸钠修复液中,继续加热至高压锅阀门上汽后计时2.5 min,3%H2O2灭活内源性过氧化物酶,PBS浸洗3洗3 min。滴加50加n性过氧化物抗体(1:100),37℃湿盒中孵育90 min,PBS充分浸洗3 min。滴加SupervisionTM鼠/兔通用二抗检测系统室温孵育25 min,PBS充分浸洗3 min。DAB显色,苏木素复染,梯度酒精脱水,二甲苯透明,中性树胶封片。光学显微镜下观察和分析。选用已知阳性的乳腺癌标本作为阳性对照,用PBS液代替一抗作阴性对照。
1.4 结果判定 RCAS1阳性表达细胞为细胞浆或膜着色,呈棕黄色。每例切片随机选取至少5个高倍视野(×高倍视野),计数至少500个细胞,评分参照免疫反应积分法。染色强度分为4级:不显色为0分;浅黄色为1分;棕黄色为2分;棕褐色为3分。阳性细胞百分率分为4级,阴性为0分,≤25%为1分,25%~50%为2分,>50%为3分。两分级相加,0~3分为阴性表达,≥4分为阳性表达。
1.5 统计学方法 应用SPSS 17.0进行统计分析,计数资料组间率(%)的比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 RCAS1蛋白表达情况 RCAS1阳性表达在细胞为细胞浆或膜着色,呈棕黄色。RCAS1在乳腺癌组织、癌旁组织的表达率分别为84%(88/105)、17%(18/105),差异有统计学意义。

表1 RCAS1蛋白在乳腺癌组织及癌旁组织表达情况Table 1 Expression of RCAS1 protein in breast cancer tissue and paracancerous tissue
2.2 RCAS1蛋白的表达与乳腺癌临床病理特征关系 在乳腺癌组织中,RCAS1蛋白的表达在以患者的年龄、肿瘤大小、病理组织学分级、淋巴结转移等方面比较,差异无统计学意义。
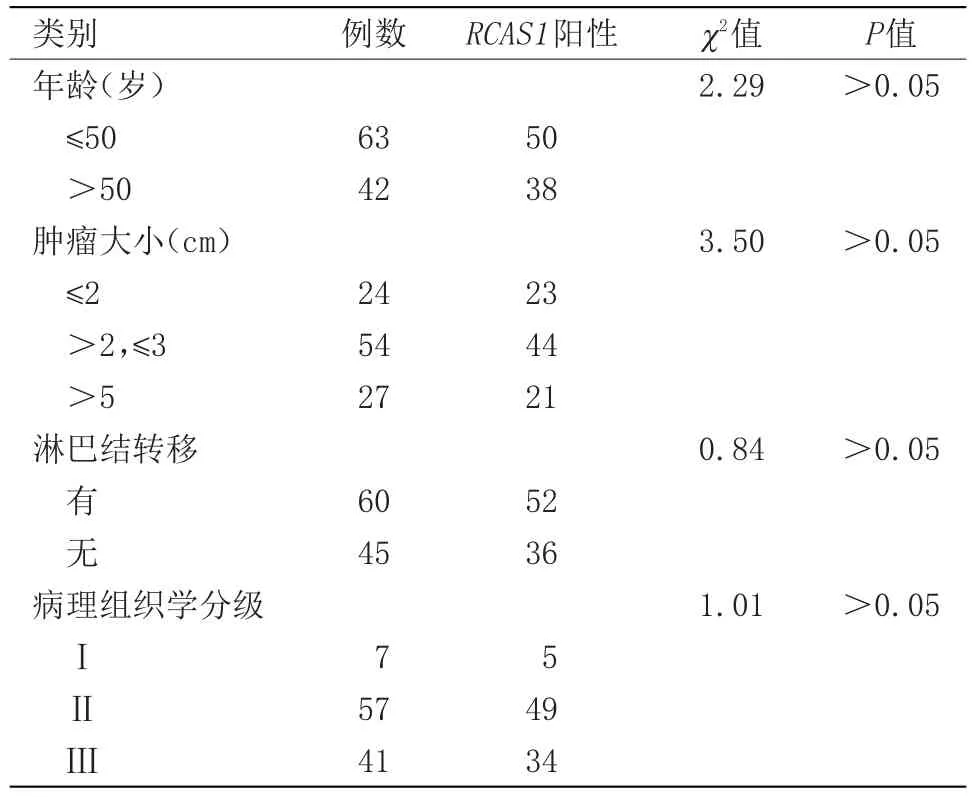
表2 RCAS1蛋白的表达与乳腺癌临床病理特征关系Table 2 Relationship between expression of RCAS1 protein and clinicopathological features of breast cancer
3 讨论
肿瘤细胞为实现其对宿主的免疫逃逸,主要通过修饰肿瘤细胞本身和改变肿瘤微环境以逃逸宿主免疫细胞的识别和攻击。而肿瘤一旦发生其细胞的自身特点就决定其逃逸能力。肿瘤微环境由肿瘤细胞外基质、肿瘤浸润免疫细胞以及细胞因子等组成,是机体免疫系统与肿瘤细胞进行博弈的场所,因而,肿瘤微环境上的机体免疫细胞识别与攻击肿瘤细胞的强弱在很大程度上决定了肿瘤细胞能否成功实现免疫逃逸。
人RCAS1/EBAG9基因即SiSo细胞上/雌激素受体结合片段相关基因9表达的受体结合肿瘤抗原,定位于人类染色体8q23.2,是一种雌激素转录蛋白。RCAS1蛋白是通过其C末端卷曲螺旋结构形成同型寡聚体的Ⅱ型膜蛋白,在多种人类癌细胞上有表达,如子宫、卵巢、前列腺癌、肝细胞癌、肺癌细胞等。研究表明,RCAS1蛋白作为存在于各种人类细胞中的推定受体的配体,包括正常的外周淋巴细胞,如T,B和天然杀伤(NK)细胞,不仅存在于肿瘤细胞中,而且还存在于正常组织的细胞中,并且控制免疫应答。在体外和体内RCAS1蛋白抑制受体表达的细胞生长,并通过caspase-3的活化和线粒体跨膜电位的崩解诱导凋亡的细胞死亡,RCAS1蛋白可能通过抑制T淋巴细胞生长又促进其凋亡而在肿瘤细胞免疫逃逸中发挥作用,如RCAS1诱导活化的TILs凋亡而使肿瘤细胞逃避宿主的免疫监视。RCAS1蛋白的高表达与肿瘤进展和多种癌症患者的不良预后显著相关[4-8]。
本文采用免疫组化检查发现RCAS1蛋白在乳腺癌组织及癌旁组织中的表达率分别为84%(88/105)、17%(18/105),与Suzuki T等在乳腺浸润性导管癌中,用免疫组化等方法研究发现RCAS1表达阳性率为90.1%(82/91)相似[9]。乳腺癌组织与癌旁组织中RCAS1蛋白的表达有差异,差异有统计学意义。同时,我们发现在乳腺癌组织中,RCAS1蛋白的表达在以病人的年龄、肿瘤大小、病理组织学分级、淋巴结转移等方面作为比较,差异无统计学意义。RCAS1基因在乳腺癌组织中高表达,癌旁组织中呈低表达,而这种高表达在以年龄、肿瘤大小、病理组织学分级及淋巴结转移与否等方面作为比较的癌组织中表达没有差异,提示RCAS1基因表达可能与乳腺癌发生密切相关,与年龄、肿瘤大小、病理组织学分级、淋巴结转移等方面关系不密切,这可能是RCAS1蛋白可能通过抑制T淋巴细胞生长又促进其凋亡而在肿瘤细胞免疫逃逸中发挥作用有关。文献报道,RCAS1蛋白质参与调节肿瘤微环境及其免疫反应,使肿瘤细胞实现免疫逃逸[10]。
本文采用免疫组织化学方法检测105例乳腺浸润性导管癌组织及相应癌旁组织的RCAS1基因表达,发现RCAS1基因与乳腺浸润性导管癌密切相关,值得进一步研究。

