体外培育牛黄对慢阻肺大鼠IL-17及Caspase-3的干预作用研究
刘 灵,王钟秀,邢爱萍
(山西省中西医结合医院,山西太原030013)
慢性阻塞性肺疾病(慢阻肺,COPD)是由免疫反应引起的、不完全可逆性气流受限的慢性炎症性疾病。慢阻肺的发生发展与气道炎症、氧化应激、肺泡上皮细胞凋亡相关[1-2]。目前研究提示IL-17在慢阻肺病人炎症反应中不但起到介导作用,还能发挥调控作用[3-4]。Caspase-3是多种凋亡途径的必经之路,是细胞凋亡的执行者[5]。体外培育牛黄的性状、成分、药效与天然牛黄一致,可显著抑制急性炎症的渗出和白细胞趋化,降低相关炎性因子的释放以及炎症的瀑布效应等[6]。本研究采用ELISA法测定大鼠血清及肺泡灌洗液IL-17的含量及免疫组化技术检测Caspase-3表达情况,了解体外培育牛黄对慢阻肺的干预作用及可能机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 体质量(200±30)g的清洁级健康雄性Wistar大鼠50只,购于山西医科大学动物实验中心(许可证号晋SCXK 2015-0001),各组动物的饲养条件相同。
1.1.2 实验药物 1.5 g体外培育牛黄溶解于6 mL蒸馏水中,配成浓度为250 mg/mL的溶液(武汉健民大鹏药业有限公司)。10 mg脂多糖溶解于5 mL生理盐水中,制成2 mg/mL的脂多糖溶液(索莱宝科技有限公司)。IL-17 ELISA试剂盒、兔抗鼠Caspase-3单克隆抗体购于博士德生物有限公司。
1.2 方法
1.2.1 模型制备与给药 Wistar大鼠50只按随机数字表法分为正常对照组(A),慢阻肺模型组(B)、牛黄干预组(C)、布地奈德干预组(D)、牛黄+布地奈德干预组(E),各组动物的饲养条件相同。B、C、D、E 组以烟熏联合脂多糖制备慢阻肺模型[7]。4组大鼠分别于第1天、第15天于气道内注入细菌内毒素脂多糖(LPS)溶液,被动吸烟每天2次,每次间隔2 h,每次燃12支香烟。正常对照组(A组):第1天、第15天在大鼠气道内注入0.1 mL生理盐水。牛黄干预组(C组):在每次烟熏前1 h给予体外培育牛黄灌胃(800 mg/kg);激素干预组(D组):在每次烟熏前1 h给予雾化吸入布地奈德1 mg/d。牛黄+激素干预组(E组):在每次烟熏前1 h给予体外培育牛黄灌胃(800 mg/kg)和雾化吸入布地奈德1 mg/d。4 w后用10%水合氯醛(3 mL/kg)腹腔注射麻醉大鼠。
1.2.2 标本采集与制备 ①将成功麻醉的大鼠固定于解剖台上,打开胸腔,分离气管,取肺泡灌洗液;心脏取血5 mL,离心分离血清,至-20℃冰箱中保存。采用ELISA法测定肺泡灌洗液及血清中IL-17的含量,按照ELISA试剂盒说明书操作。②取右肺上叶约1 cm×1 cm×0.2 cm标本,用0.9%氯化钠注射液冲洗干净,置于中性甲醛液中固定24 h,常规石蜡包埋,备HE染色及免疫组化检测Caspase-3表达情况。
1.2.3 肺组织切片免疫组化法检测 Caspase-3严格按照说明书完成实验步骤。结果分析:染色后的切片阳性蛋白在普通显微镜下观察呈黄棕色或黄褐色。以APERIO全自动数字病理切片扫描仪扫描分析Caspese-3蛋白的表达,每个切片随机取5个高倍视野(400倍),用系统中的 Scanscope数字分析软件分析统计阳性表达的平均灰度值,灰度值越低,Caspase-3的表达越高,凋亡率也越高。
1.3 统计学方法
采用SPSS16.0统计软件进行数据统计,计数资料以均数±标准差(±s)表示,多组资料进行方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 动物的一般情况
正常对照组大鼠活泼好动,食量正常;呼吸平稳,呼吸道无分泌物,未闻及痰鸣音。模型组大鼠逐渐出现蜷伏少动,撮毛,食量减少,毛发黄、易脱落,体重较正常组减轻;呼吸急促,呼吸道有分泌物从口鼻流出,偶可闻及咳嗽及气道痰鸣音,随着造模时间的延长,上述症状逐渐加重。
2.2 大鼠肺组织病理切片观察
正常对照组(A):肺泡结构正常。慢阻肺模型组(B):可见支气管纤毛部分脱落,大量炎性细胞浸润,肺泡腔扩大,肺大泡。牛黄干预组(C):局部肺泡扩张、融合,可见少量炎性细胞浸润,但肺泡融合程度、炎性细胞浸润和肺泡间隔断裂等方面较B组减轻,与D组比较不明显。布地奈德干预组(D):局部肺泡扩张、融合,可见少量炎性细胞浸润,但是肺泡融合程度、炎性细胞浸润和肺泡间隔断裂等方面较B组减轻,与C组比较不明显。牛黄+布地奈德干预组(E):少量炎性细胞浸润,肺泡间隔断裂及肺大泡的形成比B、C、D组大鼠明显减轻。结果见图1。
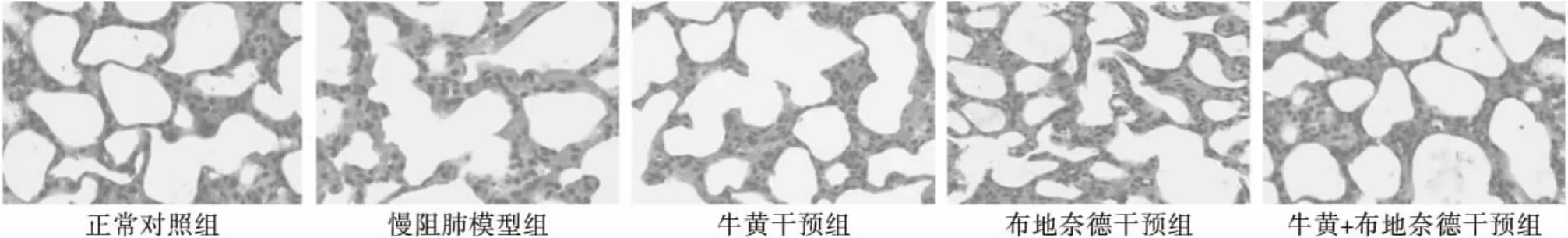
图1 大鼠肺组织切片各组HE染色比较(×200)
2.3 各组大鼠血清及肺泡灌洗液IL-17含量比较
ELSIA法检测大鼠血清及肺泡灌洗液中IL-17含量,与正常对照组比较,慢阻肺模型组IL-17含量显著升高,差异有统计学意义(P<0.05);5 组大鼠IL-17含量多重比较,除C组和D组尚不能认为组间差异有统计学意义(P>0.05),其余各组比较组间差异有统计学意义(P<0.05)。大鼠IL-17含量由高到低顺序为:B组>C组>D组>E组>A组,结果见表1。

图2 各组大鼠免疫组化Caspase-3表达结果(×400)
表1 各组大鼠血清及肺泡灌洗液IL-17含量比较 (Pg/mL±s)
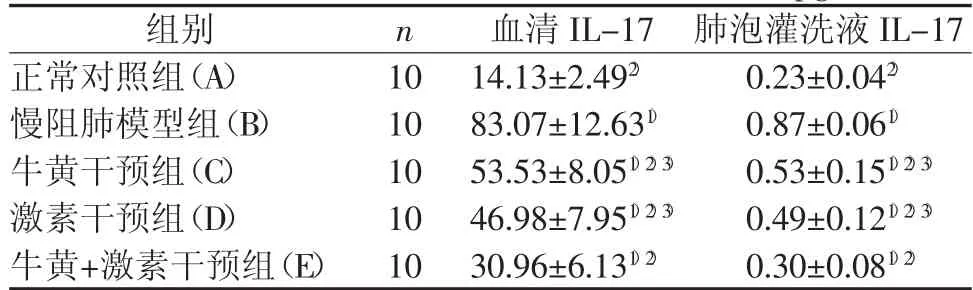
表1 各组大鼠血清及肺泡灌洗液IL-17含量比较 (Pg/mL±s)
注:与 A 组比较,1)P<0.01;与 B 组比较,2)P<0.01;与 E 组比较,3)P<0.01
组别 n 血清IL-17 肺泡灌洗液IL-17正常对照组(A) 10 14.13±2.492) 0.23±0.042)慢阻肺模型组(B) 10 83.07±12.631) 0.87±0.061)牛黄干预组(C) 10 53.53±8.051)2)3) 0.53±0.151)2)3)激素干预组(D) 10 46.98±7.951)2)3) 0.49±0.121)2)3)牛黄+激素干预组(E) 10 30.96±6.131)2) 0.30±0.081)2)
2.4 免疫组化法检测Caspase-3结果比较
染色后的切片Caspase-3阳性蛋白在普通显微镜下观察呈棕黄色或黄褐色(见图2)。与正常对照组比较,慢阻肺模型组肺组织灰度值明显降低,差异有统计学意义(P<0.05);5 组大鼠灰度值多重比较差异均有统计学意义(P<0.05)。灰度值由高到低依次是A组>E组>D组>C组>B组,即Caspase-3在各组中的表达由高到低为B组>C组>D组>E组>A组,结果见表2。
表2 各组大鼠免疫组化Caspase-3表达灰度值比较 (±s)

表2 各组大鼠免疫组化Caspase-3表达灰度值比较 (±s)
注:与 A 组比较,1)P<0.01;与 B 组比较,2)P<0.05;与 C 组比较,3)P<0.01;与 D 组比较,4)P<0.01
?
3 讨论
气道慢性非特异性炎症是慢阻肺主要的病理基础,IL-17是近年新发现的导致T淋巴细胞诱导和促进炎症发生的一种很重要的炎症微调因子,可通过多种途径促进多种趋化性因子的释放,从而使炎症反应得以放大。目前越来越多的研究表明IL-17在慢性阻塞性肺疾病的发病机制中起着重要的促炎作用[8-10]。病理学研究证实COPD患者存在着不同程度的肺组织细胞凋亡及结构重建,提示COPD肺组织细胞增殖和凋亡处于一种失衡状态。Caspase-3是多种凋亡途径的必经之路,是细胞凋亡的执行者。糖皮质激素在呼吸系统疾病的治疗中应用广泛,除了其强大的抗炎、抗过敏及免疫抑制作用外,地塞米松可以有效抑制大鼠AECⅡ凋亡[11]。体外培育牛黄是目前非天然牛黄中理想的天然牛黄替代品,多项体外培育牛黄研究证实了它可显著抑制急性炎症的渗出和白细胞的趋化,有耐缺氧作用;可促进机体清除自由基、稳定内环境平衡,可抑制细胞凋亡[12-13]。梅慧奇等[14-15]研究发现,体外培育牛黄可以对抗氧化应激失衡,抑制肺组织中HIF-1ɑ 、NF-κBP65的表达,发挥肺保护作用。
本研究结果中COPD模型组的IL-17显著升高,5组大鼠血清及肺泡灌洗液中的IL-17含量多重比较,除C组和D组尚不能认为组间差异有统计学意义外(P>0.05),其余各组比较组间差异有统计学意义(P<0.05),提示牛黄可以降低慢阻肺的炎症反应并减轻肺组织的病理损害。本实验用全自动数字病理切片扫描仪分析Caspese-3蛋白的表达,统计分析阳性蛋白表达的平均灰度值,灰度值越低,Caspase-3的表达越高,凋亡率也越高。在各实验组中,模型组的灰度值明显低于其他各组,支持COPD的发病与肺泡细胞过度凋亡密切相关。本研究显示激素、体外培育牛黄均可以抑制肺泡上皮的凋亡,体外培育牛黄联合吸入糖皮质激素可以显著降低模型组大鼠Ⅱ型肺泡上皮细胞凋亡,两者联合可以发挥协同作用,延缓COPD的持续进展。但激素联合体外培育牛黄作用的具体靶点尚不清楚,其在慢阻肺患者中的疗效仍需大规模临床试验证实。

