2型糖尿病合并代谢综合征患者血清趋化素水平变化及其与白细胞介素6的相关性
马俊花,陆建灿,王 星,朱鸿玲,顾明君
海军军医大学附属公利医院内分泌科,上海 200135
代谢综合征(MS)包括肥胖、高血糖(糖调节受损或糖尿病)、高血压、血脂代谢紊乱等,是多种心血管危险因素的集合。2型糖尿病患者代谢综合征的发病率逐年升高[1]。慢性低度亚临床炎症参与了2型糖尿病及MS的发生[2]。研究[2-3]表明,白细胞介素6(IL-6)与2型糖尿病、MS的关系密切。趋化素是一种与炎症反应、糖代谢异常及MS发生相关的脂肪因子[4-6]。而在2型糖尿病合并MS患者中,趋化素与IL-6的关系鲜见报道。本研究拟通过检测2型糖尿病合并MS患者血清趋化素水平的变化,并分析趋化素与MS组分及IL-6的关系,探讨趋化素在2型糖尿病MS发生中的作用。
1 资料与方法
1.1 一般资料 选取2015年12月至2017年6月我科收治的108例初诊2型糖尿病患者,其中合并MS者58例、未合并MS者50例。2型糖尿病符合1999年世界卫生组织制定的糖尿病诊断标准[7];MS符合2013年中华医学会糖尿病分会制定的诊断标准[8]。排除标准:(1)1型糖尿病及其他特殊类型糖尿病患者;(2)存在糖尿病急性并发症患者;(3)有恶性肿瘤病史者;(4)严重的肝肾功能不全者;(5)合并其他内分泌疾病者;(6)合并自身免疫性疾病者等。选取年龄、性别匹配的40 例健康体检者作为对照组。本研究获得医院伦理委员会批准,所有受试对象均知情同意并签署知情同意书。
1.2 标本采集及检测 各组受试者均空腹10 h后于第2天清晨抽取外周静脉血5 mL,分离血清,高压液相分离法测定糖化血红蛋白(HbAlc)水平;酶化学法测定三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)水平;葡萄糖氧化酶法测定空腹血糖(FBG)水平;化学发光法测定空腹胰岛素(FINS)水平;计算稳态模型胰岛素抵抗指数(HOMA-IR)=[FBG(mmol/L)×FINS(mU/L)]/22.5。另留取血清,用酶联免疫吸附法检测趋化素及IL-6水平。
1.3 体格检查 同时测量患者血压、身高、体质量、腰围及臀围。血压取安静状态下,坐位右上臂血压的3次测量值的平均值;腰围为平静呼吸时最低肋弓下缘与髂嵴最高点连线中点的水平周径;BMI =体质量/身高2,腰臀比=腰围/臀围。
2 结 果
2.1 各组一般临床资料和生化指标的比较 3组间性别构成比、年龄和LDL-C水平差异均无统计学意义。与对照组相比,MS组收缩压、舒张压、BMI、腰围、WHR、FBG、FINS、HOMA-IR、HbA1c、TG、TC水平均显著升高(P<0.05),HDL-C水平降低(P<0.05);非MS组FBG、HOMA-IR、HbA1c水平均升高(P<0.01)。与非MS组相比,MS组收缩压、舒张压、BMI、腰围、WHR、FINS、HOMA-IR、TG、TC水平均显著升高(P<0.05),HDL-C水平降低(P<0.05,表1)。
2.2 各组间血清趋化素和IL-6水平的比较 MS组血清趋化素水平显著高于对照组(P<0.01)及非MS组(P<0.05),非MS组趋化素水平高于对照组 (P<0.05)。MS组血清IL-6水平明显高于对照组和非MS组(均P<0.01);非MS组IL-6水平高于对照组(P<0.05,表1)。
2.3 血清趋化素与各代谢指标及IL-6的相关性分析 以趋化素为因变量,Pearson相关分析结果显示:在2型糖尿病合并MS的患者中,趋化素与收缩压、BMI、腰围、WHR、HOMA-IR、TG、IL-6均正相关(r值分别为0.605、0.426、0.384、0.362、0.463、0.427、0.587,P<0.05),与HDL-C负相关(r=-0.375,P<0.01)。
3 讨 论
MS是集肥胖、高血压、糖耐量异常或糖尿病、高TG血症、低高密度脂蛋白血症等心血管危险因素于一体的病理状态。2型糖尿病患者肥胖、高血压、高血脂等代谢紊乱的发生率升高,容易发生MS。本研究发现,2型糖尿病合并MS患者收缩压、舒张压、BMI、腰围、WHR、FINS、HOMA-IR、TG、TC水平均明显高于非MS组,而HDL-C明显低于非MS组,与文献[9]结果相似。
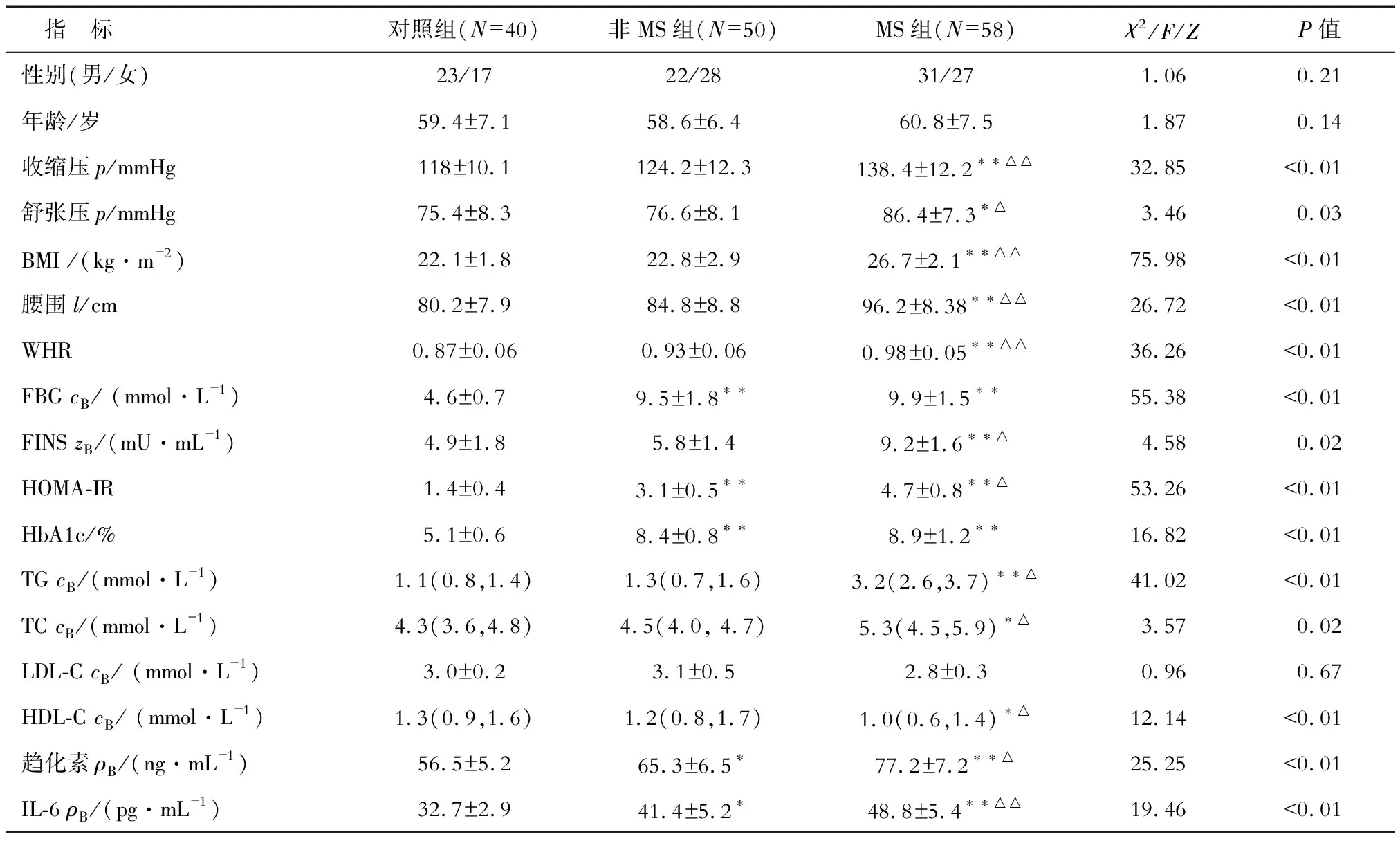
表1 3组患者临床指标及趋化素、IL-6的比较
*P<0.05,**P<0.01与对照组比;△P<0.05,△△P<0.01与非MS组比
趋化素是由Goralski等[10]首次报道的主要表达于白色脂肪组织的脂肪因子,在糖代谢、炎症反应及脂肪分化等过程发挥重要作用[4-5,10]。研究[11]发现,MS患者血清趋化素水平升高;趋化素水平与MS组分相关,且是MS的独立标志物,在MS发生过程中发挥重要作用。在2型糖尿病患者中,趋化素水平的变化尚存在争议。本研究发现,2型糖尿病患者血清趋化素水平升高,与El-Mesallamy等[12]的报道一致;而Bozaoglu等[6]发现,2型糖尿病患者血清趋化素水平无明显变化。造成这种差异的原因可能为入组患者不同:本研究入组患者均为初诊的2型糖尿病患者,未经过任何药物治疗,Bozaoglu等[6]研究中未排除经药物治疗的2型糖尿病患者。而趋化素基因是过氧化物酶增殖体激活受体γ (PPAR-γ)的目的基因[13],噻唑烷二酮类药物及二甲双胍可以使血清趋化素的浓度降低[14]。
与未合并MS的2型糖尿病患者相比,合并MS的2型糖尿病患者发生心血管疾病的危险性增加,且严重程度加重。本研究发现,2型糖尿病合并MS患者血清趋化素的水平较未合并MS患者明显上升,与袁国跃等[9]报道一致,提示趋化素可能与2型糖尿病患者发生MS密切相关;进一步发现,趋化素与收缩压、BMI、腰围、WHR、HOMA-IR、TG正相关,与HDL-C负相关。
高TG、低高密度脂蛋白血症与MS的发生密切相关。本研究提示,趋化素与脂质代谢紊乱存在相关性,与Cheon等[15]的研究结果一致。趋化素与其受体ChemR23结合后能诱导钙离子释放,促进细胞内钙离子的动员[16];趋化素还可以通过MEK-ERK1/2通路增加血管对缩血管物质的敏感性[17]。研究[16-17]提示,趋化素可能参与了血压调节过程。趋化素通过促进脂肪细胞分化、抑制脂解及参与炎症免疫反应等过程,在肥胖的发生中发挥重要作用[10,18]。
胰岛素抵抗是MS发生的核心环节。目前对于趋化素水平升高是促进胰岛素抵抗形成的原因还是胰岛素抵抗的结局仍存在争议。Sell等[19]发现,在骨骼肌细胞中,趋化素能呈剂量依赖性地降低胰岛素刺激的Akt磷酸化水平,从而导致胰岛素抵抗。但也有研究[20]表明,在2型糖尿病合并肥胖的患者中,血清趋化素水平与HOMA-IR正相关;使用增加胰岛素敏感性的降糖药后,血清趋化素水平下降,提示趋化素水平的升高可能继发于胰岛素抵抗。本研究结果显示,在2型糖尿病合并MS患者趋化素与HOMA-IR正相关。但由于本研究为横断面研究,无法阐明在2型糖尿病合并MS患者中,趋化素水平升高与胰岛素抵抗孰因孰果,尚有待进一步研究证实。
MS患者存在慢性系统性亚临床型炎症,其发生通常伴随炎症因子水平的升高[21]。IL-6是一种炎症因子,其水平与胰岛素抵抗水平正相关[22],在MS患者中表达升高[23]。 本研究显示,2型糖尿病合并MS患者血清IL-6水平高于未合并MS组,与Weiss等[24]报道的结果一致,提示2型糖尿病合并MS患者体内存在更高程度的炎症反应。
趋化素通过与其受体CMKLR1的结合促进巨噬细胞和未成熟树突细胞的趋化,发挥促炎作用[25]。Lehrke等[26]在稳定型心绞痛患者中发现,趋化素水平与肿瘤坏死因子α(TNF-α)、C反应蛋白(CRP)、IL-6等炎症因子的水平正相关。张晓雪等[27]研究发现,在高糖刺激下,趋化素与其受体ChemR23结合后,通过活化p38MAPK通路促进肾小球内皮细胞IL-6及TNF-α的表达,从而促进肾小球内皮细胞的炎性反应。本研究结果显示血清趋化素水平与IL-6正相关,提示炎症可能是趋化素、2型糖尿病和MS间联系的桥梁,趋化素可能通过作用于IL-6发挥促炎作用,参与2型糖尿病MS的发生。
综上所述,本研究发现2型糖尿病合并MS患者血清趋化素水平升高,且其水平与MS组分及IL-6正相关,提示趋化素可能在2型糖尿病MS的发生中发挥一定作用,为深入阐明2型糖尿病MS的发病机制提供新的思路。但由于本研究存在一定的局限性,如为横断面研究,样本量较小,尚须大样本的前瞻性研究进行进一步的验证。

