2型糖尿病周围神经病变的危险因素及神经元特异性烯醇化酶的相关性
李苗苗,刘 军,丁和远,吴跃跃,黄新梅,孙田歌,杨 敏,张 瑞,于志艳,臧淑妃,李 悦
复旦大学附属上海市第五人民医院内分泌科,上海 200240
糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是2型糖尿病(type 2 diabetes mellitus,T2DM)常见的慢性并发症之一,具有起病缓慢、隐匿性强、症状逐渐加重、不易逆转、预后差的特点。神经元特异性烯醇化酶(neuron-specific enolase,NSE)作为一种广泛存在于神经组织中的酸性蛋白,被公认为神经组织损伤的特征性标志物[1]。但NSE水平可能与DPN相关仍有争议[2]。本研究进一步分析了DPN患者血清中NSE水平的变化及其与DPN发生的关系,旨在探讨NSE能否作为DPN的标志物。
1 资料与方法
1.1 一般资料 选择2014年1月至2016年12月在本院住院的T2DM患者736例,分为单纯T2DM组(SDM组)和T2DM周围神经病变组(DPN组)。SDM组286例,其中男性148 例,女性138例,年龄21~88岁,平均(56.89±11.63)岁;DPN组450例,其中男性238例,女性212例,年龄29~89岁,平均(68.11±10.40)岁。T2DM及DPN诊断均符合2013年中国T2DM防治指南标准[3]。本研究经医院伦理委员会审核批准,患者知情同意并签署知情同意书。
1.2 DPN纳入和排除标准 纳入标准:(1)T2DM发病时或随后出现周围神经病变;(2)T2DM患者有肢体麻木、疼痛等临床症状时,跟腱反射、针刺反应、震动觉、压力觉、温度觉中的1项存在异常,或无相关临床症状而上述指标中有2项存在异常。排除标准:脊神经或周围神经脱髓鞘疾病、颈腰椎病变、脑血管意外、外周动静脉血管病变、严重肝肾功能不全患者;外伤、感染及化疗等造成神经损伤者。
1.3 检测指标 记录住院患者的一般资料,包括性别、年龄、T2DM病程和有无高血压病史。测量患者住院当天的收缩压(SBP)、舒张压(DBP)、身高、体质量,计算体质指数(BMI) = 体质量/身高2。
清晨抽取患者空腹静脉血,使用美国Roche Cobas C702全自动生化分析仪(葡萄糖氧化酶法)测定空腹血糖(FBG);采用美国VARIAN DS202液相色谱仪(高压液相色谱法方法)测定糖化血红蛋白( HbA1c);采用美国Roche Cobas E601全自动电化学发光仪(化学发光法方法)测定NSE。
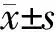
2 结 果
2.1 两组患者临床及生化指标比较 结果(表1)表明:与SDM组相比,DPN组病程较长、年龄较大、高血压合并率较高(P<0.05) 。两组FBG、 HbA1c、NSE水平差异无统计学意义。
2.2 DPN发生的危险因素logistic回归分析 以DPN为因变量,T2DM病程、有无高血压病史、性别、年龄、BMI、SBP、DBP、FBG、HbA1c、NSE为自变量进行logistic回归分析。结果(表2)表明:T2DM病程、高龄、HbA1c升高是DPN发生的独立危险因素(P<0.05) 。

表1 两组临床资料及生化指标的比较
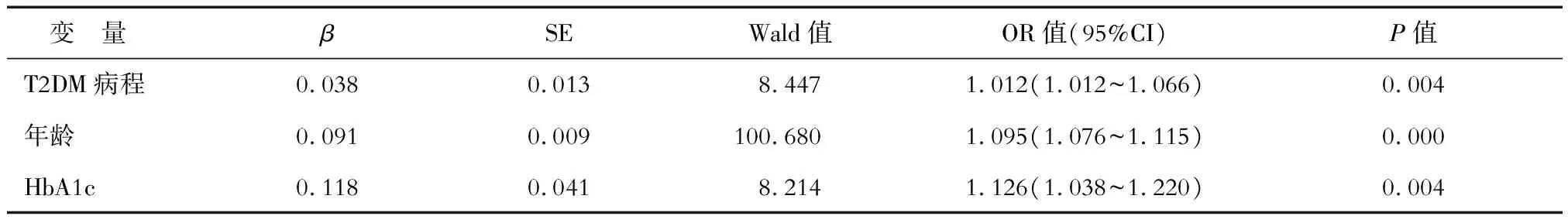
表2 DPN影响因素的logistic回归分析
2.3 NSE影响因素的多重线性回归分析 以NSE为因变量,T2DM病程、有无高血压病史、性别、年龄、BMI、SBP、DBP、FBG、HbA1c为自变量,进行多重线性回归分析。结果(表3)显示:DBP与NSE水平独立正相关(P<0.05),BMI与NSE水平独立负相关(P<0.05)。

表3 多重线性回归模型分析影响NSE水平的因素
3 讨 论
T2DM病程长于10年的患者中超过50%合并T2DM神经病变,其中以DPN最常见[4]。DPN在T2DM总人群中占40%~60%[5]。本研究中,DPN患者平均病程10年,发病率为61.1%,与文献相似。而本研究中DPN组合并高血压的患者比例明显高于SDM组,说明高血压可增加DPN的发生风险。其主要机制可能为长期的压力刺激可影响内皮对血管的保护作用,血管内皮功能削弱使神经组织的血液供应减少,出现灌注异常(低灌注和超灌注),进而使神经组织受损;而高血压与T2DM在发病机制上密切联系、相互影响,两者同时存在时,内皮功能损伤更加明显,因此,DPN发生率更高[6]。
NSE是一种参与糖酵解途径的烯醇化酶,主要存在于神经组织和神经内分泌细胞中,在脑组织细胞中含量最高。NSE是公认的神经元损伤的特征性标志物。当神经组织发生缺血、缺氧、低灌注损伤时[7-8],细胞膜通透性改变,NSE从胞内进入外周血,因此,通过测定血清NSE水平可以评估周围神经病变。然而,目前对于NSE与DPN之间关系的报道不一致[9-10]。Sandhu等[11]研究中,NSE是DPN的独立危险因素;另有研究[12]认为,两者之间可能无相关性。DPN主要病理改变为脱髓鞘、轴突变性及末梢神经炎等慢性结构性损伤,其是否更易导致NSE进入外周血目前也不确定。本研究中,DPN组血清NSE浓度与SDM组差异无统计学意义,推测NSE可能不是DPN潜在的生物学标志物。但是,Li等[13]报道NSE的水平与神经病变的程度密切相关,而本研究中未对神经病变进行程度分级。此外,本研究多重线性回归分析显示,DBP与NSE正相关,可能因为随着DBP升高,神经组织的血液供应减少,进而引起神经元损伤并释放NSE[8]。BMI与NSE负相关,暗示体质量减小可能对神经组织有一定的保护作用,但目前鲜见体质量与NSE关系的相关报道,有待进一步探讨。
本研究logistic回归分析显示,T2DM病程长、高龄为DPN发生的独立危险因素(P<0.05)。国内外相关文献[14-15]报道,随着T2DM患者病程延长、年龄增长,神经纤维长期处于高血糖及缺血、缺氧状态,神经组织传导速度异常率明显升高,DPN发生率也随之升高。HbA1c主要反映2个月内血糖变化情况,本研究中HbA1c升高是DPN发生的独立危险因素。慢性高血糖可以增加肌醇消耗,增加非酶糖基化终末产物,升高血液黏度,激活多元醇等通路,导致血管内皮组织损伤和神经结构受损,促进DPN的发展[16]。DPN患者应积极控制血糖,以延缓DPN进展[17]。近年来,有研究[18-19]报道,空腹血糖变异系数(FBG-CV)与DPN之间有一定的关系,说明血糖波动影响DPN的发生发展。
综上所述,NSE可能不是DPN潜在的生物学标志物;T2DM病程、年龄、HbA1c是DPN的独立影响因素,因此临床中须严格控制患者血糖,减少血糖波动,并密切随访,及时诊治。本研究中还存在一些不足:未纳入健康对照;未分析吸烟、饮酒、血糖波动性、胰岛功能、血脂、氧化应激、炎症介质等对DPN的影响[20]。

