海拔变化对凤阳山针阔混交林地土壤微生物群落的影响
孟苗婧,郭晓平,张金池,*,赵友朋,吴家森,叶立新,瞿承伟,刘胜龙
1 南方现代林业协同创新中心,江苏省水土保持与生态修复重点实验室,南京林业大学林学院,南京 210037 2 环保部南京环境科学研究所,南京 210042 3 浙江农林大学资源与环境学院,临安 311300 4 凤阳山-百山祖国家级自然保护区凤阳山管理处,龙泉 323700
土壤微生物是土壤的重要组成部分,对土壤肥力的形成和转化起着积极作用,是土壤质量评价不可缺少的土壤生物学指标[1- 3],同时,土壤微生物群落结构被认为是土壤生态系统的预警及敏感指标之一[4],它在调节土壤养分和生态系统过程中起着重要的作用,是植物生长和维持的关键[5-6]。土壤细菌对土壤微生态系统中的物质和能量的转化作用显著[7],土壤真菌及放线菌可以在土壤颗粒间形成菌丝桥[8],从而影响土壤团粒结构[9]。真菌主导的土壤微生物类群对改善土壤有机碳稳定性比细菌更加重要[10],因此土壤真菌与细菌的相对丰度也对土壤生态的可持续发展有着作用[11]。
然而,微生物类群对植被及生境的选择有明显的对应性[12],所以群落的组成和多样性在很大程度上受土壤环境条件,特别是土壤理化因子的影响[13-14]。森林土壤的养分积累和平衡状况存在差异[15],其空间变异主要受海拔、地形、植被等因素的影响[16-17]。海拔梯度是检验地球物理影响下植物群落生态进化反应的最有力的“自然实验”[18]。海拔梯度的变化意味着短距离内气候因子的急剧变化[19],如温度,降水等[20]。近年来温室效应加剧,高海拔地区的生态环境也随之改变[21],研究典型植被类型对海拔变化的响应可以解释植物对环境的适应[22],研究微生物多样性对海拔梯度的响应也为帮助我们更好的理解微生物对气候变化的响应[23]。
凤阳山自然保护区是森林生态类型自然保护区,原始植被类型为亚热带常绿阔叶林[24],这也是亚洲东部的主要自然植被类型之一[25]。20世纪60—70年代,凤阳山自然保护区进行了间伐等措施,对森林进行管理。后又补植了黄山松、杉木、柳杉等针叶树种,形成了了杉木纯林、柳杉纯林、竹林及针阔混交林等植被类型[26]。作为我国东部亚热带山地有代表性的针叶树种之一[27],黄山松在高山植被恢复、固碳、水源涵养及应对全球气候变化方面比其他松科植物更为重要的价值[28]。黄山松为重要组成树种的黄山松阔叶混交林主要分布在800—1800 m,有关黄山松的研究较少,且多集中在黄山松的分类、群落、生长特性及遗传分化等方面[29- 32],但有关黄山松为重要组成部分的高海拔针阔混交林对气候变化的响应研究仍有欠缺。磷脂脂肪酸(PLFA) 技术作为一类较为常见并且快捷、准确的微生物生物标记法[33],目前已在国内外土壤微生物群落组成和种群变化方面得到广泛应用。本文主要利用PLFA方法研究了凤阳山不同海拔黄山松林土壤微生物群落结构,为黄山松的利用、保护及其对气候变化的响应提供理论依据。
1 材料与方法
1.1 研究区概况
研究区位于浙江省龙泉市南部凤阳山—百山祖国家级自然保护区(119°06′—119°15′E,27°46′—27°58′N),保护区现有管理面积15171 hm2,凤阳山保护区主峰为黄茅尖,海拔1929 m,是江浙第一高峰。保护区所处位置属中亚热带温暖湿润气候区,年均降水量达2400 mm,年均气温12.3℃,四季分明,雨量充沛。保护区内森林植被类型丰富,有11个植被类型,其中主要植被型有5个,分别为针叶林(800—1600 m)、针阔混交林(1200—1800 m)、常绿落叶阔叶混交林(1200—1650 m)、常绿阔叶林(1300—1700 m)、山顶矮曲林(1400 m以上)。以黄山松(Pinustaiwanensis)为重要建群种的黄山松阔叶混交林是保护区内针阔混交林中的典型群系,分布在海拔800—1800 m,其中阔叶树种主要为木荷 (Schimasuperba)、青冈(Cyclobalanopsisglauca)、柃木(Euryajaponica)等。
1.2 样品采集
选取凤阳山主峰黄茅尖海拔800—1800 m范围内的黄山松针阔混交林为研究对象。2016年8月,在此范围内设置5个海拔梯度(900、1100、1300、1500、1700 m),在每个海拔梯度的阳坡内选取排水较好、坡度较缓、长势适中的3个样方,每个样方20 m×20 m。由于海拔差异较大,黄山松针阔混交林内阔叶林组成不同,因此我们在每个样方内用蛇形法设置5个样点,取样时将土壤表面枯落物和腐殖质层移开,采集表层(0—20 cm土层)的土壤样品500 g,然后将5个样点所采集的土壤进行混合,作为该样地的土壤样品,并用密封袋密封之后,放入冰盒带回实验室。土样过2 mm筛后,分为两份,一份风干进行土壤养分等的测定,另一份放入-20℃冰箱待测。样地基本特征见表1。
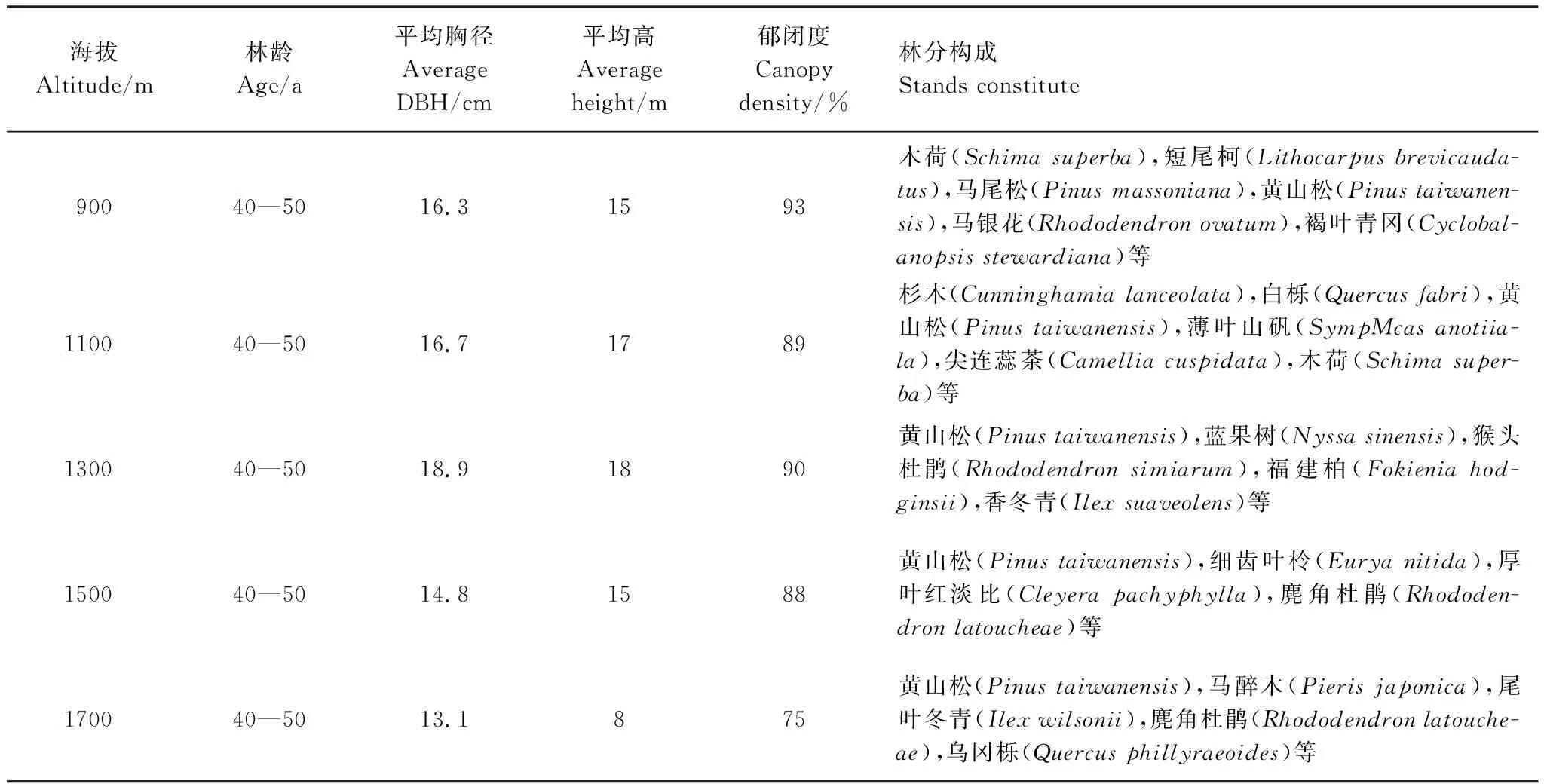
表1 样地林分基本特征
1.3 测定方法
土壤理化性质测定:土壤pH采用pH计测定(水土比2.5∶1);土壤容重及含水量用环刀取样后称量法测定[34];土壤有效磷含量采用钼锑抗比色法测定,土壤有机碳采用重铬酸钾外加热法测定[35];总氮、总磷采用流动分析仪测定(Bran+Luebbe); 土壤微生物群落结构多样性采用磷脂脂肪酸方法(PLFA)[36],采用修正的Bligh-Dyer 方法进行脂类提取和磷脂脂肪酸分析:土样用体积比为1∶2∶0.8的氯仿∶甲醇∶柠檬酸缓冲液振荡提取总脂类,然后经SPE硅胶柱分离得到磷脂脂肪酸,将得到的磷脂脂肪酸进行碱性甲酯化,用Agilent 6890N 气相色谱仪分析PLFA的成分,内标为正十九烷酸甲酯(19:0)[37]。
本研究选取了6种指标,其中表征的磷脂脂肪酸如下:革兰氏阳性细菌(13:0iso,15:0iso,15:0anteiso,16:0iso,17:0iso,17:0anteiso,18:0iso);革兰氏阴性细菌(10:0 2OH,16:1ω9c,16:1ω7c,17:1ω7c,17:1ω8c,17:1ω9c,16:0 2OH,18:1ω7c,18:1ω5c);放线菌(16:0 10-methyl,18:010-methyl);厌氧菌(17:0 ω7c,19:0cycloω9c,19:0cycloω7c);16:1ω5c;SEM真菌(18:2ω6c,18:1ω9c)。由于16:1ω5c被发现在G-和AM fungi中同时存在,且所占比重较大。同时,16:1ω5c是表征AM fungi的一个重要的磷脂脂肪酸。因此,本研究选取16:1ω5c作为一个独立的指标来表征微生物的数量[24]。本文中我们用磷脂脂肪酸的相对丰度分析反映微生物群落组成[38]。
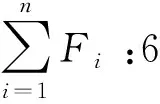
1.4 数据处理
土壤理化性质及微生物群落的相对丰度(革兰氏菌、革兰氏细菌、放线菌、厌氧菌、16:1ω5C和SEM真菌)在各海拔梯度之间的差异,使用单向方差分析(ANOVA)和最小显著性差异(LSD)分析,数据不满足正态分布时,采用K检验。土壤理化性质与土壤微生物群落结构之间的差异采用非度量多维标度(NMDS),所用分析使用R语言进行(“vagan”软件包)[39]。
2 结果与分析
2.1 海拔变化对黄山松林地土壤理化性质的影响
随海拔升高,土壤理化性质出现了显著变化(表2)。土壤pH值、容重及土壤含水量无明显的变化规律,但在各海拔之间有显著性差异(P<0.05)。土壤有机碳、总氮、总磷及有效磷含量在中海拔(1100—1500 m)处较高,在海拔1700 m处均显著降低(P<0.05)。但各指标最大值并不出现在同一海拔高度。

表2 土壤理化性质
TOC:total organic carbon; TN: total nitrogen; TP: total phosphorus; AP: available phosphorus,同列不同字母表示差异显著P<0.05,n=3
2.2 海拔变化对黄山松林地土壤微生物群落结构的影响
随海拔变化,黄山松阔叶林土壤微生物各群落均显示出一定差异(图1)。高海拔处(1300—1700 m)革兰氏阴性细菌丰度显著低于低海拔 (900—1100 m,P<0.05,图1),而相对丰度最高的革兰氏阴性细菌则表现出相反的特征,高海拔处 (1500—1700 m) 相对丰度显著高于其他海拔 (P<0.05,图1)。1500 m海拔的放线菌和丰度显著低于其他海拔 (P<0.05),其中900 m处的丰度值最高(图1)。厌氧菌相对丰度同样在1500 m处最低,但只显著低于1100 m和1300 m处的丰度值(图1)。16:1ω5c和真菌的相对丰度则是随着海拔先升高后下降,在1300 m海拔处达到最高值。
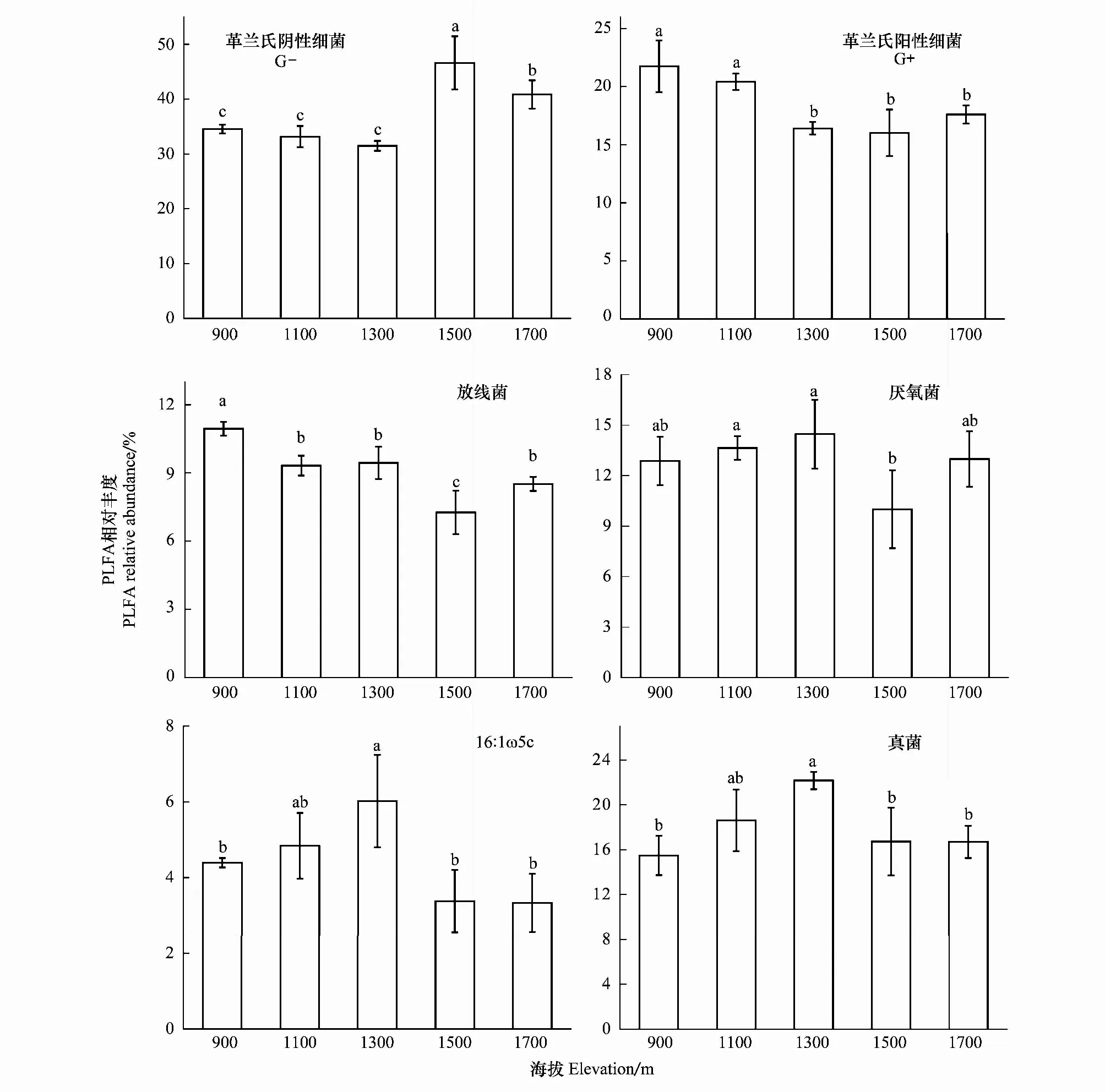
图1 5个海拔梯度不同微生物类群的相对丰度Fig.1 Relative abundance of different microbial groups at different elevations不同字母表示P<0.05时差异显著

图2 土壤微生物群落丰度的非度量多维尺度分析 Fig.2 Nonmetric multidimensional scaling analysis (NMDS) showing the overall composition of microbial communities
非度量多维标度(NMDS)排序结果显示(图2)。从整个NMDS排序图中(图2)可以看出5个海拔梯度针阔混交林地土壤微生物群落结构被划分为3个类群,即海拔900、1100 m为主的较低海拔土壤微生物群落类群;海拔1300 m的中海拔土壤微生物群落类群及以海拔1500、1700 m为主的高海拔土壤微生物群落类群。从空间角度来看,地理空间上相近的样点聚为一类。
对各海拔梯度样点在NMDS 两轴上得分进行分析(表3)。沿NMDS 1 轴,海拔900、1100、1300 m与海拔1500、1700 m处得分有显著差异(P<0.05)。而海拔1300 m处得分则与海拔900、1500、1700 m处沿NMDS 2轴有显著差异(P<0.05)。
2.3 土壤微生物群落组成与土壤理化性质间的关系
对各海拔针阔混交林土壤微生物群落组成与土壤因子渐进进行冗余分析(RDA),RDA轴1和轴2能共同解释所有变量的71.3%,模拟效果较好(图3)。冗余分析中,向量的长度与该因子的重要性成正比;土壤理化性质向量与微生物对碳源的利用向量之间的夹角余弦值表示他们之间的相关系数[40]。结果表明,土壤微生物群落结构组成与土壤理化性质之间相关性较好。土壤革兰氏阳性细菌与放线菌正相关;土壤厌氧菌与革兰氏阴性细菌丰度负相关。土壤pH值、有机碳含量与总氮含量显著正相关;但是这些因子与容重和总磷含量负相关;土壤有效磷含量与含水量之间存在显著正相关;海拔高度的变化影响了土壤环境因子的变化。土壤微生物群落组成中,放线菌、革兰氏阳性细菌、革兰氏阴性细菌及厌氧菌受土壤环境因子的影响较大。海拔高度的变化主要影响土壤放线菌及革兰氏阳性细菌丰度,与其显著负相关,此外还与革兰氏阴性细菌正相关,对其他微生物群落丰度的影响较小。

表3 各海拔梯度样点在NMDS轴上的得分

图3 不同海拔针阔混交林地土壤微生物群落结构与土壤因子分冗余分析Fig.3 Redundancy analysis (RDA) between soil microbial community and soil properties
3 讨论
海拔高度的变化通常会在较短的地理距离内引起气候环境因子的变化及物质周转的剧烈变化[19]。土壤微生物群落结构作为土壤生态系统中较为敏感的指标,对周围环境的变化会产生极为迅速的响应。本文研究发现,随海拔的升高,凤阳山针阔混交林地土壤微生物群落组成也发生了变化。
通过NMDS降维分析,将5个海拔梯度的微生物群落组成分为3个类型类群。海拔900 m及1100 m处,土壤微生物群落中,革兰氏阳性菌、放线菌及厌氧菌丰度较高;海拔1500 m及1700 m处,土壤革兰氏阳性菌丰度显著高于其他海拔;海拔1300 m处则拥有较低的细菌丰度。仅从土壤微生物群落组成的海拔效应上看,海拔变化主要影响土壤细菌及放线菌丰度的变化,对其他微生物群落影响较小。朱文杰研究了太白山北坡土壤放线菌的垂直分布,发现海拔800—1845 m范围内,土壤放线菌 最高含量出现在1845 m,这与本文的研究结果相似[41]。土壤革兰氏阳性与阴性细菌变化趋势相反,随海拔升高,革兰氏阳性与阴性细菌的相对丰度分别呈现下降和升高趋势,革兰氏阴性细菌对高海拔环境的适应更有优势[42]。
作为土壤生态系统中的重要组成部分,土壤微生物直接参与森林生态系统的物质循环和能量转化,同时对稳定团粒结构等方面也有明显作用[43]。土壤微生物种类、群落结构、生物量等受气候环境、植被群落结构及土壤性质等环境因子的影响。根据RDA分析的结果,海拔变化引起的土壤性质的变化一定程度上导致了土壤微生物群落的变化[44],由于森林土壤的异质性及植被类型的差异,各土壤因子对微生物群落的影响不同[45-46]。土壤性质对不同土壤微生物类群的作用不同[47]:土壤革兰氏阳性细菌与放线菌丰度几乎受到所有土壤因子的影响,这说明影响它们丰度的因素较复杂;土壤革兰氏阴性细菌丰度则主要受到土壤容重、含水量及土壤有效磷含量的影响,其中容重为负相关,含水量及有效磷含量为正相关。许多研究都证明土壤N,P含量是影响土壤微生物群落的重要因素[48],但是在不同的研究区域影响效果有所差异。良好的土壤物理性质,也对土壤微生物群落结构的丰富作用显著[49]。土壤微生物群落结构受土壤性质的影响,大都是多个因子的综合作用结果[50]。
植物群落组成也显著影响土壤微生物群落结构组成。一方面,大量研究探讨了植物群落结构多样性与土壤微生物群落组成及丰度之间的相互关系,发现较高的植物群落结构多样性多伴随着大的土壤微生物群落结构多样性[14]。另一方面,有学者认为每种植物对生态系统的贡献都是不同的,植物通过根系形态、分泌物及枯落物的分解影响着土壤微生物群落结构组成[51]。这些观点都说明植物群落组成是影响土壤微生物群落结构的重要因素。海拔变化后,针阔混交林内部植物种类及组成均发生改变,这种差异及其引起土壤环境差异也是土壤微生物群落结构不同的重要因素[52-53]。
本研究利用磷脂脂肪酸(PLFA)技术测定土壤微生物群落组成,因为它可以直接提取原位土壤的PLFA,但是该方法的准确性对实验条件要求较高,同时无法区分植物体与土壤的PLFA,因此利用分子生物学技术深入探讨土壤微生物群落多样性或许是我们进一步研究方向。
4 结论
风阳山不同海拔梯度土壤理化性质及土壤微生物群落组成均有差异。随海拔升高,土壤养分含量大致呈现先升高后降低的变化特征,在海拔1100—1500 m范围内养分含量较高。土壤pH值及容重分别与海拔高度呈正、负相关关系。土壤微生物群落组成中,土壤革兰氏阳性细菌、革兰氏阴性细菌及放线菌丰度与海拔高度的变化相关关系显著,其他类群的土壤微生物丰度与海拔的相关性较弱。
土壤理化性质对土壤微生物群落丰度有一定的影响,土壤革兰氏阳性细菌及放线菌丰度收土壤理化性质各因子的综合影响,革兰氏阴性细菌丰度则主要受到土壤含水量及有效磷含量的关系密切。

