河南省猪肠外致病性大肠杆菌毒力因子的检测及分布
徐引弟 ,张青娴 ,王治方 ,朱文豪 ,焦文强 ,李海利 ,郎利敏 ,王克领
(1.河南省农业科学院畜牧兽医研究所,河南郑州450002;2.河南省畜禽繁育与营养调控重点实验室,河南郑州450002)
肠外致病性大肠杆菌((Extraintestinalpathogenic Escherichia coli,ExPEC)是引起世界性疾病的主要病原,可引起各种肠道外疾病,包括新生儿脑膜炎、脓毒症以及泌尿道疾病,已经报道它在欧洲和北美引起动物和人的死亡,ExPEC由于分离部位和遗传模式而区分于肠内致病性大肠杆菌和共生型大肠杆菌[1-4]。
ExPEC是养猪业的一个主要病原,引起严重的经济损失,随着我国养猪业工业化的快速发展,猪ExPEC的暴发呈上升的趋势,成了迫切需要解决的问题。而且,人和动物分离的ExPEC分离菌之间的相似性表明,ExPEC存在不同的宿主之间交叉感染的可能性,包括人、伴侣动物、猪和禽类[5-8]。近年来,猪大肠杆菌病的报道日益增多,特别是高致病力ExPEC的报道逐年增多,已经给我国的养猪业造成重大的损失[9-18]。
本试验对2017年分离自河南省猪场猪ExPEC进行了毒力试验和毒力因子的鉴定,并对河南省ExPEC在猪群中的流行现状、毒力特性等进行研究,旨在为预防和控制该病的流行提供依据。
1 材料和方法
1.1 试验材料
1.1.1 病料及菌株 来自于2017年1—12月河南省养猪场发生呼吸困难、败血症、关节炎及神经症状的发病及死亡猪的脑、肺、气管、心血、关节液等病料共148份,质控菌ATCC25922购自中国兽药监察所。
1.1.2 培养基及试剂 胰蛋白大豆琼脂(Tryptic Soy Agar,TSA)和胰蛋白大豆肉汤(Tryptic Soy broth,TSB)购自Difco公司。麦康凯琼脂(Maconkey Agar,MC)购自北京奥博星生物技术公司。Ezup柱式动物基因组DNA抽提试剂盒、50×TAE浓缩液购自生工生物工程(上海)股份有限公司;2×Taq Mix,DL2000 DNA Marker购自宝生物工程(大连)有限公司。
1.2 试验方法
1.2.1 培养基配制
1.2.1.1 TSA固体培养基 4 g TSA琼脂粉,溶于100 mL超纯水中,115℃灭菌15 min,加胎牛血清5 mL,倾倒平皿。于4℃保存备用。
1.2.1.2 TSB液体培养基 含TSB肉汤粉3 g,溶于100 mL超纯水中,115℃灭菌15 min,加胎牛血清5 mL。于4℃保存备用。
1.2.1.3 TSA血平皿 TSA固体培养基灭菌后冷却至45℃,加脱纤绵羊血5 mL,倾倒平皿。于4℃保存备用。
1.2.1.4 MC琼脂平皿 5 g MC琼脂溶于100 mL超纯水中,121℃灭菌15 min,冷却至45℃,倾倒平皿。于4℃保存备用。
1.2.2 引物设计 参考文献[9-10,12-13],根据大肠杆菌uid A基因序列设计引物,用于大肠杆菌的扩增,设计15个毒力因子包括kpsMTⅡ,kpsMTⅢ,iroN,fyuA,ireA,iutA,papC,papA,fimH,afa,vat,ompA,traT,usp和 ibeA基因的引物,分别用于ExPEC的15个毒力因子的扩增,引物序列如表1所示。引物由生工生物工程(上海)股份有限公司合成。

表1 PCR鉴定所用靶基因及引物
1.2.3 ExPEC的分离鉴定 其参考文献 [9-10]进行。取病死猪肝脏、肺脏、气管、心血、关节、脑组织等,在无菌条件下,涂布于TSA平板上,置于37℃5%的二氧化碳培养箱中过夜。在TSA平皿上,挑取疑似菌落于麦康凯平板上,培养12~24 h后,挑取红色菌落革兰氏染色。将纯化后的疑似菌挑取少量单菌落溶解于30 μL无菌水中,按照Ezup柱式动物基因组DNA抽提试剂盒操作提取DNA,扩增uid A基因。
1.2.4 致病性试验 将分离鉴定好的ExPEC接种于不含血清的TSB培养基,37℃250 r/min振摇培养24 h。用生理盐水稀释菌数约为109cfu/mL,腹腔注射小白鼠0.2 mL;同时设生理盐水为阴性对照。接种后观察发病及死亡情况,剖检小白鼠,无菌取其心血分离细菌并鉴定。
1.2.5 毒力因子鉴定方法的建立 DNA的提取:取纯化后的菌落适量于50 μL纯水的EP管中,按照DNA提取试剂盒说明操作,用表1中15对毒力因子的引物进行扩增。
反应体系为 25 μL,其中,2×Taq Mix 12.5 μL,10 μmol/L 上下游引物各 1 μL,模板 DNA 1 μL,加ddH2O至25 μL。反应条件为95℃预变性5 min;95℃1 min,57℃1 min72℃ 30 s,共 35个循环;最后72℃延伸10 min。PCR产物4℃保存。取10 μL扩增产物电泳,紫外光下观察结果,阳性产物测序。1.2.6 毒力因子的分布 对2017年1—12月分离鉴定的ExPEC进行15个毒力因子的检测,阳性测序比对,统计毒力因子的分布情况。
2 结果与分析
2.1 ExPEC的分离鉴定结果
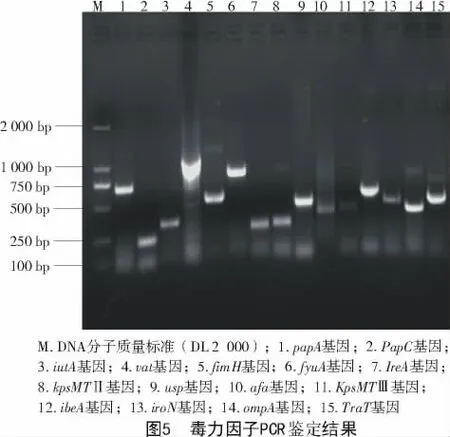
在TSA平皿上可见到凸起、圆形、光滑、湿润、不透明、边缘整齐、直径2~3 mm的黄色菌落(图1),在麦康凯平皿上长出玫红色、光滑的圆形菌落(图2)。革兰氏染色为革兰氏阴性粗杆菌(图3)。PCR鉴定结果如图4所示,在264 bp处有目的条带,与预期相符。
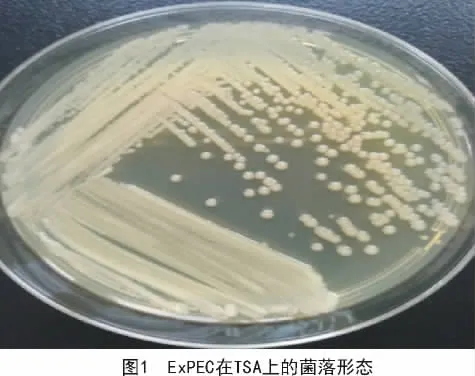
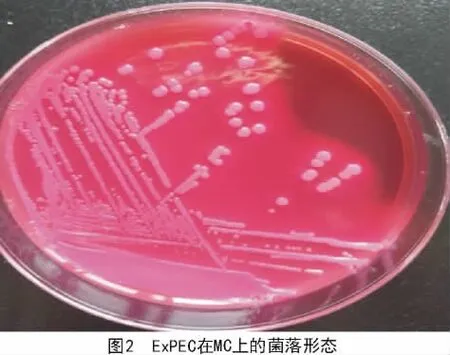
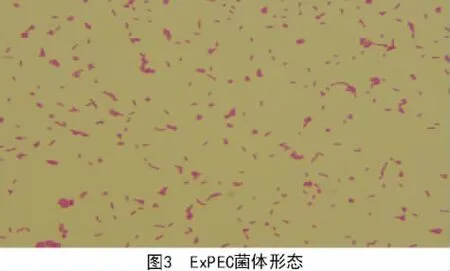
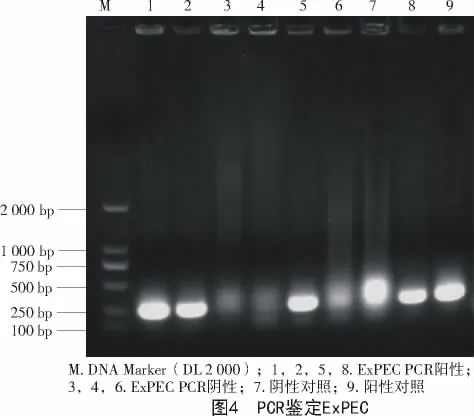
2017年1—12月,从河南省35家猪场送检的病死猪组织148份样品,一共分离到肠外致病性大肠杆菌52株。
2.2 ExPEC的致病性分析
所有分离鉴定的ExPEC接种小鼠24 h内死亡,取死亡鼠心血接种TSA平皿。结果分离出纯的经鉴定与ExPEC一致的细菌,证明为ExPEC,其对小鼠有毒力。
2.3 毒力因子PCR鉴定结果
用ExPEC的15对毒力因子的引物扩增,结果分别扩增出与预期大小相符的片段(图5),测序与GenBank中所有ExPEC毒株的序列同源性均在98%~100%。
2.4 毒力因子的分布
将鉴定好的52株ExPEC进行15个毒力因子的扩增,结果统计列于表1。毒力基因的流行程度是不同的,其中,ompA,traT基因在所有分离株中都含有,其次为fimH,iutA,vat,iroN,其含量分别为86.5%,67.3%,63.5%,61.5%,最少的是 usp,kpsMTⅢ基因,只有1株。分离体含有的毒力基因最多的有10个(9,40,46号菌),其次含有9个毒力基因(1,18,30,39,51,52 号菌),最少的仅含有 ompA,traT基因(2,3号菌)(表 2,表 3)。阳性结果测序,同源性均在98%以上。
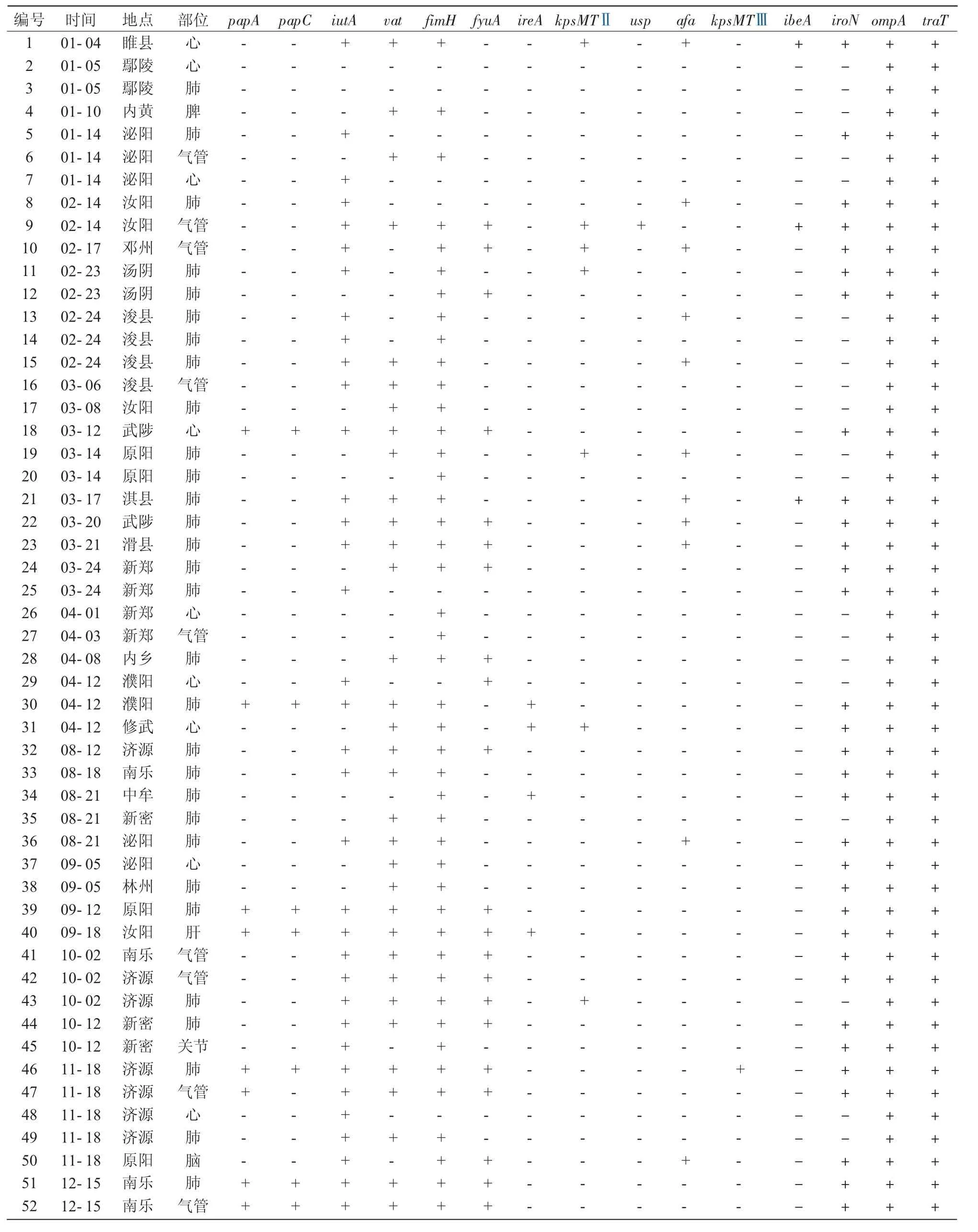
表2 15个毒力基因在52株ExPEC中的分布

表3 15个毒力基因分布统计
3 结论与讨论
2006年以来,河南省农科院畜牧兽医研究所传染病研究室从河南省发病猪场的猪肠外组织分离出300多株ExPEC,大部分猪场能分离到ExPEC。可见,猪ExPEC流行广,病原复杂。猪源ExPEC已成为威胁我国养猪业的主要细菌性疾病之一,2017年分离52株,在猪群的分离率为30%以上[12-13]。
人们已经认识到ExPEC的重要性,北美和欧洲报告了许多在牛、人和食物与ExPEC有关的疾病,可致使不同宿主发生脑膜炎、败血症、泌尿道感染和呼吸道感染。在我国养猪业中,ExPEC已成为一种常见的致病菌。然而,对ExPEC发病机制和流行病学的认识还很有限。JOHNSON等[6-7]提出了一种分子方法,ExPEC中5个毒力标记(PapA/Papc,sfa/foc,afa/dra,iutA 和 kpsMTⅡ)中至少有 2个标记定义为ExPEC。根据该标准,在本研究的52株菌株中,有22株被鉴定为ExPEC。表明JOHNSON等的标准更严格、更有选择性,且能识别出具有较高致病潜力的菌株。单一的毒力因子并不能决定细菌的致病性[18-23]。因此,本研究筛选出15个主要的毒力相关基因进行分析,旨在揭示与毒力相关的基因型性状。TAN等[10]研究表明,fimH(85.4%),traT(76.8%),iroN(70.2%),iutA(66.7%),fyuA(56.8%)和 kpsMTⅡ(56.8%)在猪ExPEC分离物中非常普遍,所占比例均在50%以上。这与本研究结果基本一致,而kpsMTⅡ,ibeA,papA,papC 差异较大。ZHU等[9]的研究中,iutA,vat,fimH,traT 和 ompA 比例均在 60%以上,而且ompA在每株菌里均能检测到,cnf1,focG,ibeA,kpsMTⅢ,afa,hlyD,sfaS,papA 低于 10%,focG未检测到。这与本研究类似,但本研究中,traA,iroN,papA,afa,fyuA比例比ZHU等的研究结果高。因此,毒力基因的检测在不同的研究中比例会有所差异,这可能与分离菌的来源、毒力、地域差异等有关。由于本研究只进行了小鼠的致死试验,而没有测定每一株菌的半数致死量,因此,每株菌的毒力差异及与毒力基因的分布关系无法确定,还需进一步研究或收集更多的ExPEC分离物得到验证。
猪ExPEC病的发生不同地域间无明显差异,与季节关系较大,冬春季发病率相对较高,而夏秋季较少,这与气温、通风等条件有较大关系。通过对猪ExPEC的毒力及毒力基因进行研究,为河南省猪ExPEC病的基础研究、诊断、预防与控制提供了一定的理论依据。

