非编码RNA甲基化与肝癌发生发展关系研究进展*
刘晓霓,刘秀红 综述,陈德喜 审校
非编码RNA(non-coding RNA,ncRNA)是指不编码蛋白质的 RNA,其中包括 rRNA,tRNA,snRNA,snoRNA,microRNA和lncRNA等多种已知功能的RNA和未知功能的RNA。非编码RNA在生物体的生命活动中发挥着极广泛的调控作用,对其进行深入研究,可能对揭示基因转录后调控、基因敲除、人类疾病防治及生物进化探索有重要意义[1]。DNA甲基化(DNA methylation)是最早发现的基因表观修饰方式之一,DNA甲基化如同开关调控着许多肿瘤相关基因的表达,在肿瘤的发生发展中起着至关重要的作用。随着人们对于非编码RNA的认识,针对非编码RNA甲基化相关研究也越来越多[2]。
微小 RNA(microRNA,miRNA)和长链非编码 RNA(Long non-coding RNA,lncRNA)是目前研究较为热点的非编码RNA,其中microRNA、lncRNA甲基化异常可能是影响肝癌发生发展的关键信号,导致肝癌的发生、发展[3,4]。本文将对近几年microRNA、lncRNA甲基化与肝癌发生发展的关系进行综述。
1 m icroRNAs甲基化与肝癌
microRNA是一种广泛存在于真核生物、大小约为20-25个核苷酸的内源性单链小分子RNA,降解或是阻遏靶mRNA,参与生命过程许多的重要进程。miRNAs功能失调是人类癌症的共性,近年来miRNAs在HCC的甲基化状态及其在HCC发生发展中的作用备受关注[4](表1)。
miRNA-200b可以明显抑制肝癌细胞的增殖、克隆形成、细胞周期和侵袭。研究miRNA-200b和BMI1的生物学功能中发现83.3%的肝癌组织中miRNA-200b显著下调,相反66.7%的肝癌组织BMI1过表达。报告基因结果显示BMI1是miRNA-200b的靶基因。肝癌组织中miRNA-200b启动子区CpG岛甲基化水平增高,miRNA-200b相应表达下降。miRNA200b部分被DNA甲基化而沉默,可以通过靶向作用BMI1抑制肝癌的进展[5]。miR-372可以调节多种肿瘤细胞的细胞周期、凋亡、侵袭和预后,和肿瘤进展关系密切[6]。在肝癌细胞系和组织中检测到miR-372上游相邻CpG岛的启动子区高度甲基化,其在肝癌组织中的表达水平较低,与肝癌转移和不良预后相关[7]。miR-106a在肝癌组织中的表达水平明显高于癌旁组织,与启动子低甲基化有关。报告基因检测显示tp53inp1和CDKN1A可能直接靶向作用于miR-106a。高表达miR-106a细胞具有更强的侵袭性,加快细胞周期进程,抗凋亡作用。miR-106a启动子低甲基化,导致miR-106a表达上调可能有助于肝癌的进展[8]。miR-146a启动子DNA甲基化与其表达下调与肝癌转移密切相关,可以作为一个潜在的肝癌抑制因子[9]。miR-148a在多种癌症中表达下调,可能是肿瘤抑制子,miR-148a过表达具有抑制HCC细胞增殖和周期进展的作用。研究发现miR-148a由于GpG岛超甲基化,介导其在HCC细胞的表达沉默。DNMT1过表达是miR-148a甲基化的原因[10]。miR-34家族作为癌变过程中肿瘤抑制网络的重要组成部分。miR-34a、miR-34b/C的甲基化频率均显著高于癌旁非癌组织,miR-34b表达与CpG岛甲基化呈负相关,提示DNA甲基化可能参与miR-34b在肝癌的失活[11]。MicroRNA-9调控失常见于多种肿瘤,探讨HCC miR-9的表达和甲基化状态与肝癌的相关性。结果显示miR-9在HCC表达下调,甲基化频率增高,与肿瘤大小相关。体外研究显示其通过调控miR-9/IGF2BP1/AKT&ERK轴抑制肝癌细胞增殖和迁移作用,是潜在的治疗靶标和预后标志物[12]。肝特异性 microRNA-122在多种 Huh7、HepG2和 QSG-7701肝癌细胞甲基化水平增高,表达下调,miRNA-122具有促进肝癌细胞凋亡作用,miRNA-122甲基化调节与肝癌进展相关[13]。DNA 甲基阻断剂可以使miR-122在HCC表达明显上调,PPARγ/RXRα复合物在miR-122表观调控中发挥重要作用,HBX蛋白与PPARγ结合,抑制miR-122转录,丙型肝炎病毒没有这种作用[14]。miR-101,是一个重要的肝癌肿瘤抑制miRNA,以c-Myc介导方式通过PRC2复合物而被表观抑制。反过来,它又抑制两个PRC2两个亚单位(EZH2和EED),建立了肝癌发生的双向负反馈环。恢复miR-101表达可以抑制 HCC细胞多个恶性表型(STMN1,JUNB,和CXCR7)。HCC 细胞共过表达c-Myc和EZH2与miR-101低表达和HCC患者不良预后有关[15]。研究发现几乎所有HCC细胞系中miR-129-2高甲基化,表达下调。与癌旁组织比较,93%(39/42)HCC患者肝癌组织miR-129-2甲基化水平增高[16]。miR-129-2在肝癌细胞过表达,可以抑制增殖和克隆形成,与SOX4共表达可以部分逆转其抗肿瘤作用,提示甲基化介导的miR-129-2表达抑制可能提高癌基因SOX4的表达,肝癌发生有关[17]。HBx和乙肝相关HCC的发生发展密切相关。HBx在HepG2细胞诱导miR-132启动子甲基化。MiR-132在HBV相关HCC组织中表达下降,和HBx表达相关[18]。HBx介导miR-101下调和DNMT3A上调增强多种抑癌基因的DNA甲基化,提示这可能是HBx介导肝癌发生的新的机制[19]。miR-335被宿主基因MEST内含子所包含,miR-335的表达和MEST表达密切相关,说明内含子miR-335与其宿主基因共表达,在HCC miR-335/MEST异常甲基化增高而致miR-335表达水平降低,与近处的转移的HCC肿瘤相比,远处转移的HCC肿瘤表达显著降低[20]。异位表达miR-517a和 miR-517c抑制细胞增殖和阻断G2/M周期,HCC细胞用DNA甲基化阻断剂处理后,miR-517a和 miR-517c表达上调,提示二者在HCC细胞处于高甲基化状态,可通过调控Pyk2促进HCC的进展[21]。miR-23b具有抑制HCC的增殖和侵袭的生物学功能。与癌组织相比,miR-23b在HCC中的表达明显降低,而且高表达miR-23b的患者的总生存期
(Overall survival,OS)和无病生存期(Disease-free survival,DFS)明显延长,提示miR-23b是一个HCC预后的分子标志物。miR-23b的下调与DNA甲基化有关[22]。用芯片的比较有淋巴结转移和无淋巴结转移的 HCC患者肝癌组织的miR-129-3p表达情况,发现有淋巴结转移的肝癌组织miR-129-3p表达明显下调,其启动子区高甲基化,提示miR-129-3p甲基化与肝癌转移、复发和不良预后密切相关[23]。miR-615-5p体内外具有抑制肝癌生长和转移的作用。去甲基化酶KDM4B可以介导 miR-615-5p启动子CpG岛甲基化,下调miR-615-5p在肝癌中的表达,miR-615-5p可以下调Ras相关蛋白RAB24,进而促进肝癌上皮间质化、黏附和血管生长[24]。mir-1247-5p在多种癌细胞中起着不同的作用。在HCC,mir-1247-5p在HepG2细胞高度甲基化,肝癌临床样本及肝癌细胞株中mir-1247-5p转录显著下调。mir-1247-5p异位表达明显抑制HepG2细胞增殖和侵袭,诱导细胞凋亡,并抑制移植瘤的体内生长。可以显著下调Wnt3表达,提示miR-1247-5p可以是HCC治疗和诊断的潜在标志物[25]。miR-142参与调节癌症患者肿瘤的生长、转移和血管生成。miR-142在HCC中低表达,和TNM分期、转移和分化有关。miR-142直接靶向抑制TGF-β,导致细胞活力、增殖、EMT和促血管生成的能力。miR-142在HCC的低表达与其高甲基化有关,可以增加TGF-β诱导的肿瘤生长。
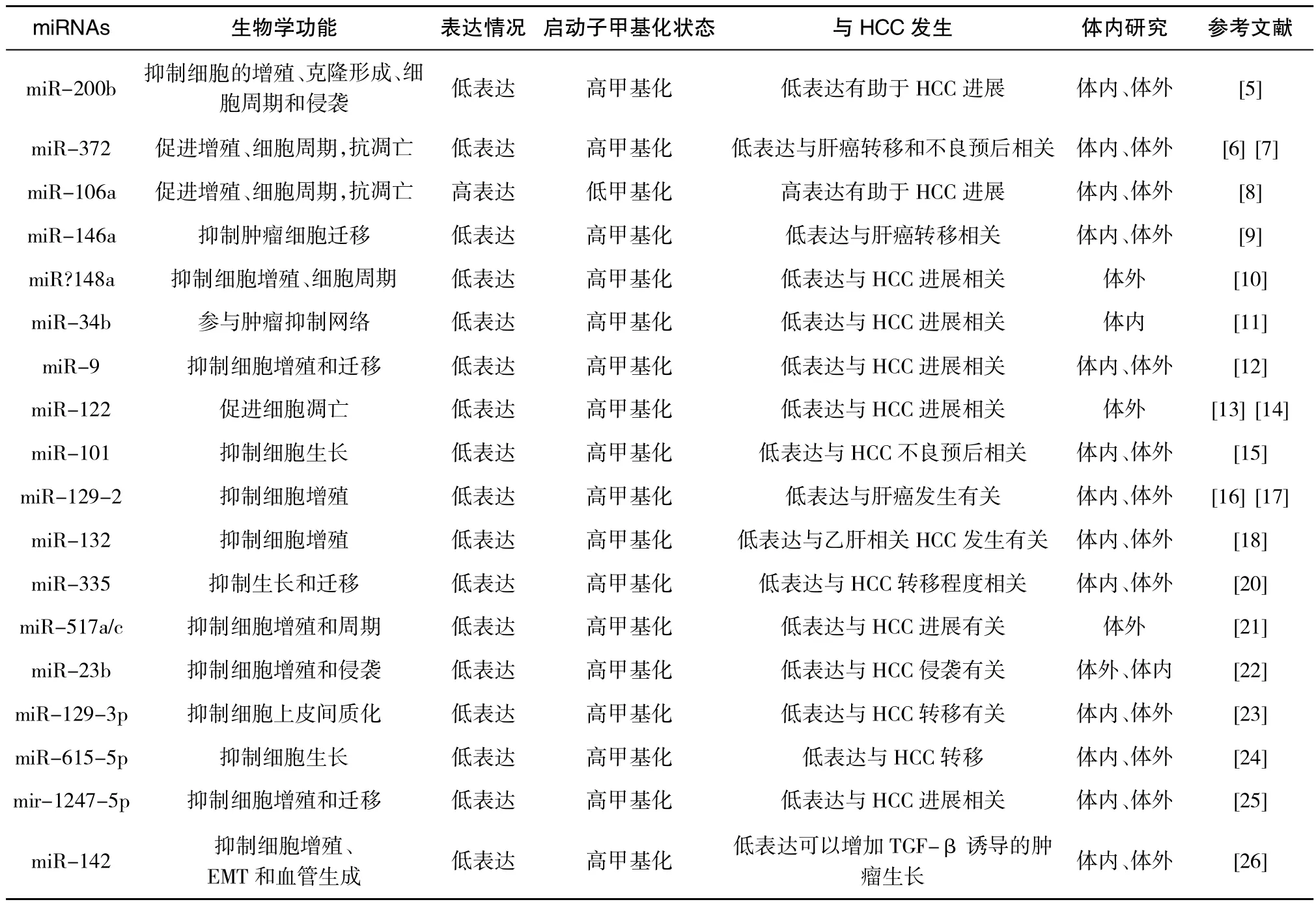
表1 m icroRNA DNA甲基化在HCC发生中的作用
可见,miRNA基因的缺失、突变、扩增或表观遗传沉默以及生物合成过程中的异常都可能导致miRNA表达水平的改变。而DNA甲基化可能是导致miRNA在肿瘤中表达沉默并影响其靶基因的表达和功能,进而影响肿瘤生物学行为的重要方式之一。miRNA DNA甲基化是肿瘤发生发展的重要机制之一,为肿瘤的诊断及治疗提供了新的方法。
2 lncRNAs与肝癌
lncRNA是一组长度大于200个核苷酸、缺少特异完整的开放阅读框、无蛋白质编码功能的RNA。一方面证据显示某些特定的lncRNAs是肝细胞癌发生发展的关键因素,同时大量的lncRNAs DNA甲基化和组蛋白修饰影响肝癌的关键信号通路。某些特定的lncRNA基因的异常甲基化修饰可能是包括肝癌等肿瘤预后不良的至关重要的事件。另一方面,尽管大量的lncRNAs通过全基因组的转录组分析发现,lncRNA的表达调控在很大程度上仍然模糊。
Zeb1-as1是一个特定lncRNA,在肝癌(尤其是转移性肝癌)中表达上调。DNA甲基化分析显示zeb1-as1启动子低甲基化,zeb1-as1低甲基化或zeb1-as1高表达与不良生存率相关。zeb1-as1促进肿瘤的生长和转移,为肝癌的癌基因,提示zeb1-as1可作为HCC预后的生物标志物。研究lncRNA-SRHC在肝癌的表达在HCC发病机制中的作用发现SRHC能抑制肝癌细胞增殖,在肝癌组织低水平表达与血清AFP高水平以及和肿瘤低程度分化有关。SRHC启动子区域CpG岛DNA甲基化是其表达沉默的部分原因。lncRNA-MEG3(maternally expressed gene 3)作为肿瘤抑制基因,在HCC下调。lncRNA-MEG3启动子显示高甲基化状态,MEG3表达的调节是依赖于靶向作用DNMT1的miR-29。甲基化相关的特异性调节MEG3表达显示了lncRNA和基因表达的表观遗传调控之间的相互作用关系。lncRNA GAS5(Growth arrest special 5)过表达具有抗肿瘤细胞凋亡的作用。其启动子的插入缺失多态性(rs145204276)和HCC的敏感性相关,rs145204276缺失可显著增高HCC的风险。进一步表型分析显示,在HCC,rs145204276等位基因缺失和GAS5高表达相关。rs145204276的基因表型和GAS5启动子甲基化相关。rs145204276可能通过影响GAS5启动子甲基化状态有助于肝癌的形成。
此外,lncRNA除了自身DNA甲基化外,和抑癌基因以及miRNA的甲基化还存在交互作用,如反义lncRNA-TARID(for TCF21 antisense RNA inducing demethylation)与TCF21启动子和GADD45A(growth arrest and DNA-damage-inducible,alpha;a regulator of DNA demethylation)相互作用,通过诱导启动子去甲基化激活TCF21表达,提示lncRNA可以作为GADD45A介导的去甲基化的标签。特异性的lncRNAs位于肿瘤相关基因附近,可能更易于作为各种作用子位点特异性甲基化关键招募平台。lncRNA-HULC可以通过诱导miR-9启动子CpG的甲基化激活miR-9表达。在肝癌靶向作用PPARA mRNA导致miR-9表达抑制,下调HCC脂质代谢。提示受lncRNAs调控的下游基因的甲基化不受特异位点限制,为lncRNAs参与肿瘤相关基因的甲基化修饰提供更多的可能性。lncRNA-GIHCG在肝癌组织高表达,与肝癌大小、血管侵袭、肿瘤分期和不良预后有关,lncRNA-GIHCG可以通过招募 EZH2和 DNMT1到miR-200b/a/429启动子区,促进miR-200b/a/429启动子甲基化,沉默其表达。lncRNA-ZNFX1-AS1可以通过下调miR-9启动子CpG岛甲基化进而上调miR-9表达,抑制肝癌生长。lncRNA PCAT-14在肝癌病人中过表达,和肝癌手术以后的不良预后相关。PCAT-14可以促进肝癌细胞增殖、侵袭、阻滞细胞周期。此外,PCAT-14可以通过诱导miR-372启动子甲基化进而抑制其表达,而miR-372可以抵消PCAT-14对HCC的促增殖、侵袭和阻滞细胞周期的作用。PCAT-14可以通过miR-372调控ATAD2表达,激活Hedgehog通路。lncRNA-GIHCG在肝癌组织高表达,与肿瘤大小、微血管侵袭、BCLC分期、不良预后密切相关。GIHCG招募EZH2和DNMT1到miR-200b/a/429启动子区,促进miR-200b/a/429 DNA甲基化进而沉默其表达。
与miRNA相比,lncRNAs的表观调控研究尚处于初期阶段,lncRNAs DNA甲基化可能是未来肿瘤诊断和预后的重要因子。
3 结语
人类基因组中仅有约2%的DNA序列最终编码生成蛋白质,其余绝大部分区域转录形成非编码RNA。非编码RNA的转录受到严格的调控,其表达谱细胞特异性和组织特异性甚至高于蛋白编码基因。寻找和发现疾病过程中非编码RNA表达变化的原因,了解非编码RNA上游调控机制,是非编码RNA研究领域重要组成部分,而表观遗传学正是从基因组层面研究RNA转录调控的重要领域。
目前miRNAs甲基化与肝癌的关系研究较为广泛和深入,随着高通量测序技术的发展,越来越多的lncRNAs被发现,多种lncRNAs在肝癌中异常表达,可以作为抑癌或促癌基因参与肝癌的发生发展。尤其近年来,有研究发现lncRNAs也编码微肽,lncRNAs表观调控已成为肝癌乃至其他疾病发生发展的研究热点。

