外源甲基紫精对烟草活性氧和花芽分化的影响
岳彩鹏, 王 宁, 李园园, 黄进勇, 朱世新, 黄盈盈, 史亚周, 胡大洋
(1.郑州大学 生命科学学院 河南 郑州 450001; 2.河南龙宇煤化工有限公司 河南 永城 476600)
0 引言
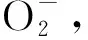
1 材料与方法
1.1 实验材料
本试验采用烟草K326作为供试品种.
1.2 实验方案
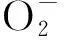
各组处理结束之后,正常条件培养,每天观察记录烟苗生长状况,每隔5 d观察记录烟草花芽分化情况,适时选取茎尖固定保存,统计烟草现蕾叶片数.
1.3 生理指标测定及方法
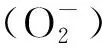
1.3.2过氧化氢(H2O2)含量测定 采用Sergiev[15]等的方法,样品加入三氯乙酸(TCA)溶液研磨,在上清液中加入碘化钾,反应结束后,390 nm测定吸光值.
1.4 开花基因表达量的测定
使用郑州贝贝生物科技有限公司的总RNA提取试剂盒提取RNA,通过1%琼脂糖凝胶电泳和微量核酸蛋白分析仪测定OD值,检测RNA完整性和浓度;使用北京爱普拜生物技术有限公司的Hiscript cDNA 合成试剂盒进行反转录,反应体系为:总RNA最大5 μg,Primer(Oligo dT) 0.5 μL,加Nuclease-free water至11.7 μL,70 ℃孵育5 min,立即置于冰水中至少5 min,之后加入5×RT buffer 4 μL,MgCl22 μL,dNTPs 1 μL,RNase抑制剂0.3 μL,MMLV逆转录酶1 μL,PCR仪上进行反转录,反应条件为25 ℃,5 min;42 ℃,1 h;75 ℃,15 min.
烟草目的基因LFY(GenBank: JQ686928.1)以及内参基因β-actin(GenBank: NO.U60495)的引物通过软件DNA man设计,FLC引物参照文献[16].LFY基因引物F:TAAGCCAAAAATGCGACACT,R:GTTCAGAATGGCAAAGCTGG;FLC基因引物F:CTCAAGAAAATAGCAGCCTTCC,R:TCTCCTTATTGCTCCTCACACA;β-actin基因引物F:ATGCCTATGTGGGTGACGAAG,R:TCTGTTGGCCTTAGGGTTGAG,均由上海生工合成.
实时荧光定量PCR试剂盒为FastStart Universal SYBR Green Master(Roche),反应仪器为Roche LightCycler®480 II全自动荧光定量PCR系统.20 μL反应体系为:HiTaq SYBR Green Mastermix(2x) 10 μL,Forward Primer(10 mM) 0.4 μL,Reverse Primer(10 mM) 0.4 μL,cDNA 1 μL,ddH2O(灭菌蒸馏水)8.2 μL.
反应条件为:95 ℃预变性2 min;95 ℃变性15 s;60 ℃退火20 s;72 ℃延伸20 s,40个循环.
1.5 观察花芽解剖结构并记录现蕾叶片数
花芽解剖结构的观察:处理结束后每隔5 d取茎尖,标记后FAA固定液保存,用体式显微镜Nikon SMZ800观察并拍照.FAA固定液配比:38%甲醛5.0 mL,冰乙酸5.0 mL,75%乙醇90.0 mL[17].
根据烟株上挂牌标记的叶位,及时观察并记录烟草现蕾时的叶片数.
1.6 数据处理
Real-time PCR实验中每个样品均做3个技术重复,Real-time PCR实验中得各样品Ct值及其平均值,扩增曲线、溶解曲线等均由计算机自带软件导出,根据公式ΔCt=Ct(目的基因)-Ct(内参基因),用2-ΔΔCt法计算各基因表达量.以对照组5 d时基因扩增结果作为对照,将其表达水平设置为1.实验所得的数据用Excel 2010和SPSS 19.0进行统计分析和方差分析.
2 结果与分析
2.1 外源甲基紫精处理对烟草活性氧含量的影响
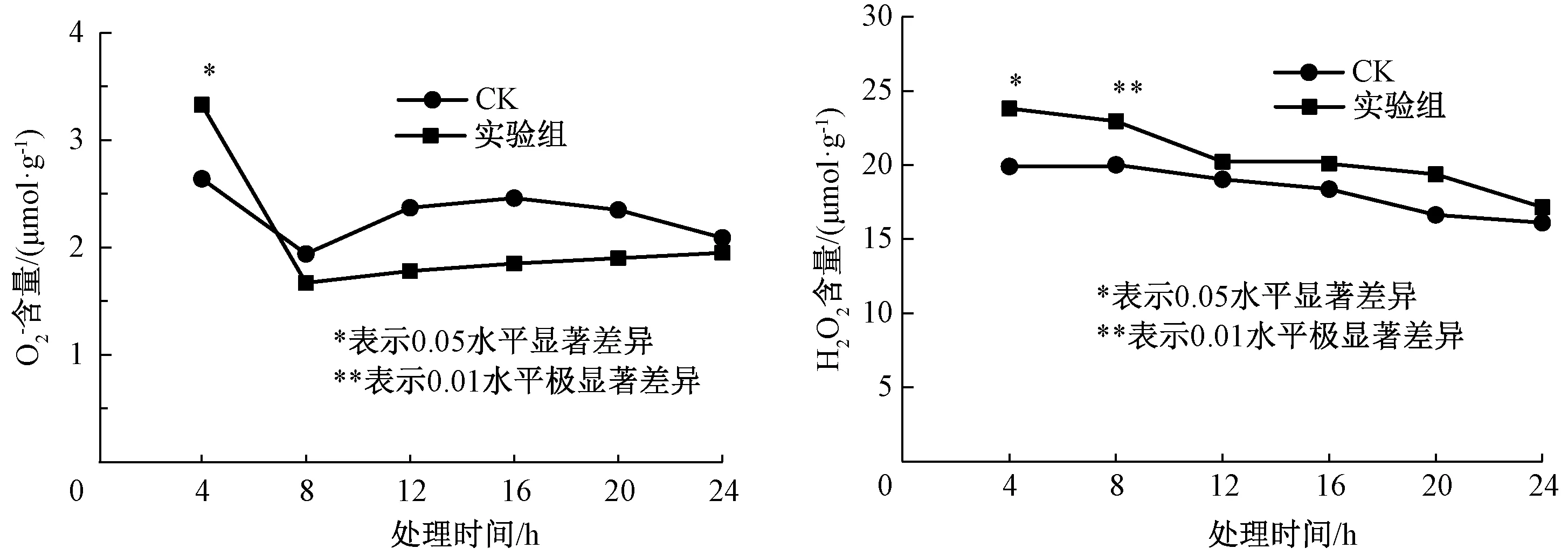
图1 外源甲基紫精处理下烟草叶片和H2O2含量的快速响应Fig.1 Rapid response of and H2O2 content in tobacco under exogenous methylviologen condition
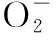
表1 长期外源甲基紫精处理下烟草叶片含量的变化Tab.1 The change of contentin tobacco under long-time exogenous methylviologen treatment μmol/g
注:*表示0.05水平显著差异;**表示0.01水平极显著差异.
长期喷施甲基紫精的烟草体内H2O2含量均高于对照(表2),而喷施结束一定时间后H2O2含量会有所回落.T1组在处理第5天显著高于对照组,处理结束后,体内H2O2也随即降低,与对照差异不显著.T2组在处理第10天、15天时分别比对照增加了18.6%、33.4%,第20天开始下降.长期喷施甲基紫精对烟草体内H2O2代谢影响较大,同时也使保护体系受到抑制,清除能力下降,喷施时间越长,体内H2O2积累越多.喷施15 d、20 d、25 d的T3、T4和T5组随着处理时间延长,H2O2含量一直显著高于对照.烟草体内长期较高水平的H2O2使烟草受到活性氧伤害,严重影响了烟草的生长发育.
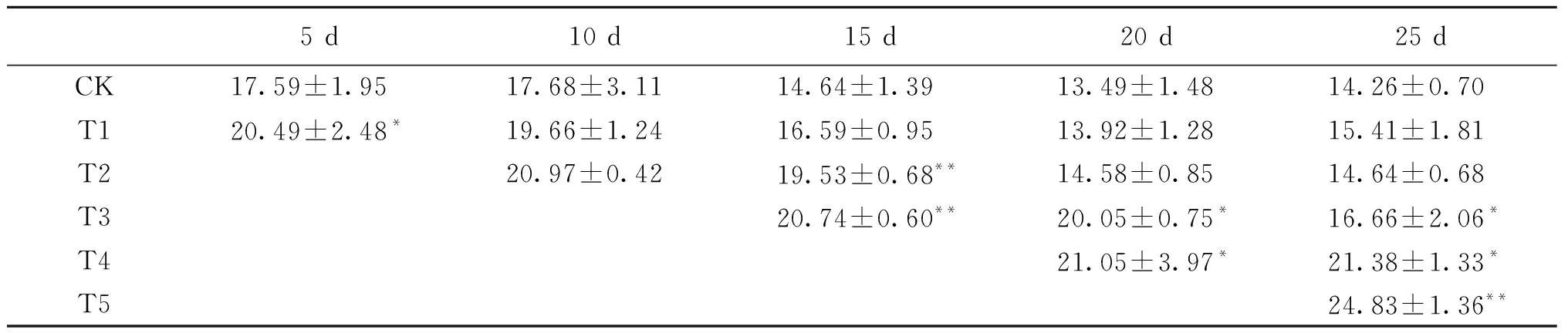
表2 长期甲基紫精处理下烟草叶片H2O2 含量的变化Tab.2 The change of H2O2 content in tobacco under long-time methylviologen condition μmol/g
注:*表示0.05水平显著差异;**表示0.01水平极显著差异.
2.2 外源甲基紫精对基因FLC、LFY表达量的影响
外源甲基紫精对烟草开花抑制基因FLC表达量的影响如表3所示,外源甲基紫精作用下FLC表达量整体呈下降趋势.喷施5 d的T1组在处理15 d时迅速下降接近最低点,并且从第15天开始FLC表达量显著低于对照;T2组在前期FLC的表达量并没有显著差异,第25天显著低于对照;T3、T4、T5的变化趋势比较类似,整体呈下降趋势,但差异与对照不显著.总之,外源甲基紫精处理烟草5 d和10 d都表现出对开花抑制基因FLC表达的抑制,但喷施时间过长,对FLC表达抑制作用不明显.

表3 外源甲基紫精对基因FLC表达量的影响Tab.3 The effects of expression of FLC in tobacco under exogenous methylviologen
注:*表示0.05水平显著差异;**表示0.01水平极显著差异.
外源甲基紫精对LFY表达量的影响如表4所示,整体上是外源甲基紫精作用下LFY表达量呈升高的趋势,表明外源甲基紫精可以促进烟草成花基因的表达,但是促进的程度并不一致.喷施5 d的T1组在处理10 d时LFY表达量有明显的增强,20 d、25 d后增幅分别为63.1%、87.1%,与对照差异显著;喷施10 d的T2组LFY表达量也一直呈上升的趋势,前期与对照差异不明显,在25 d时差异极显著.T3、T4、T5组LFY表达量与对照差异不显著.

表4 外源甲基紫精对基因LFY表达量的影响Tab.4 The effects of expression of LFY in tobacco under exogenous methylviologen
注:*表示0.05水平显著差异;**表示0.01水平极显著差异.
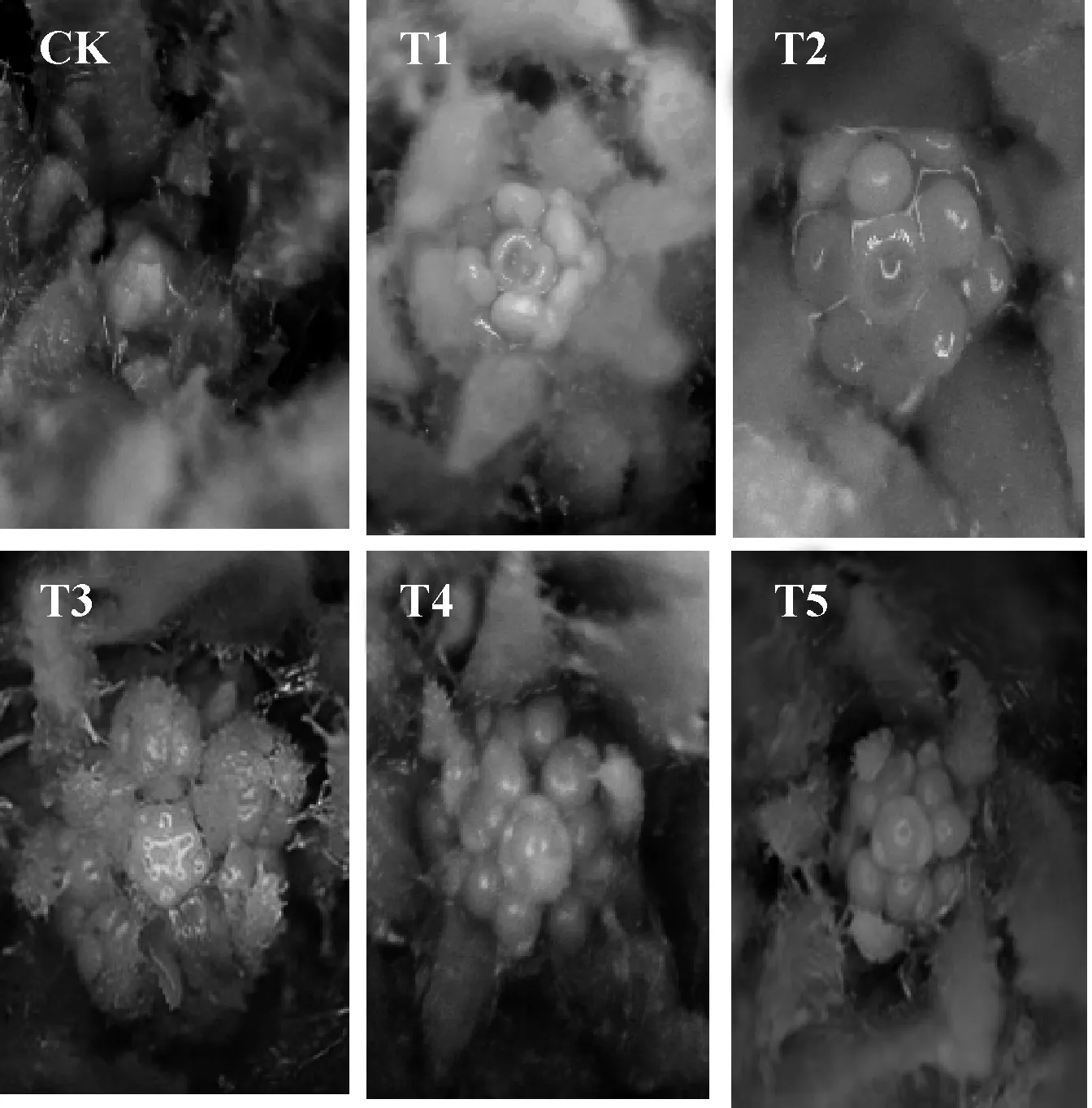
图2 外源甲基紫精条件下烟草花芽分化情况Fig.2 The flower bud differentiation of tobacco under exogenous methyl viologen
2.3 外源甲基紫精对烟草花芽分化的影响
图2是喷施外源甲基紫精22 d后各组的花芽分化图,其中CK处于营养生长期,T1处于雌蕊原基分化期,处于花芽分化的末期.T2处于雄蕊原基和雌蕊原基分化期,花瓣原基、雄蕊原基和雌蕊原基都已经分化,但是雄蕊原基内侧还没有形成凹陷,分化进程略晚于T1.T3处于花瓣、雄蕊原基分化期,图2 T3中可见5个雄蕊原基微微凸起,在其外侧与其互生的是花瓣原基,最内侧的圆形凸起是雌蕊原基,尚未分化.T4、T5均处于花萼原基分化期,以上结果表明,外源甲基紫精处理使T1、T2、T3、T4、T5各组花芽分化都有不同程度的提前,喷施时间不同,促进发育的程度也有差异,喷施5 d和10 d 的T1、T2处理促进效果最为明显,喷施15 d的T3处理次之.这与外源甲基紫精喷施5 d和10 d的T1、T2处理组的开花抑制基因FLC表达量显著下调,同时花分生组织基因LFY表达量显著上调的结果一致.
2.4 外源甲基紫精对烟草现蕾叶片数的影响
由图3可知,外源甲基紫精处理下, T1、T2、T3、T4、T5处理组烟草的现蕾叶片数与CK相比分别减少了3.75、3.75、4、2.25、1.5片真叶,现蕾均有提前.T1与T3与对照差异显著,T2与对照差异极显著.这与花芽解剖观察结果基本一致,喷施甲基紫精5 d、10 d、15 d使烟草体内活性氧含量在一定时间内升高,抑制了开花抑制基因FLC表达,促进了花分生组织基因LFY的表达,从而促进了烟草花发育,但喷施时间过长,超过15 d后,体内活性氧含量一直维持高浓度,细胞氧化损伤严重,对开花促进基因LFY表达不利.
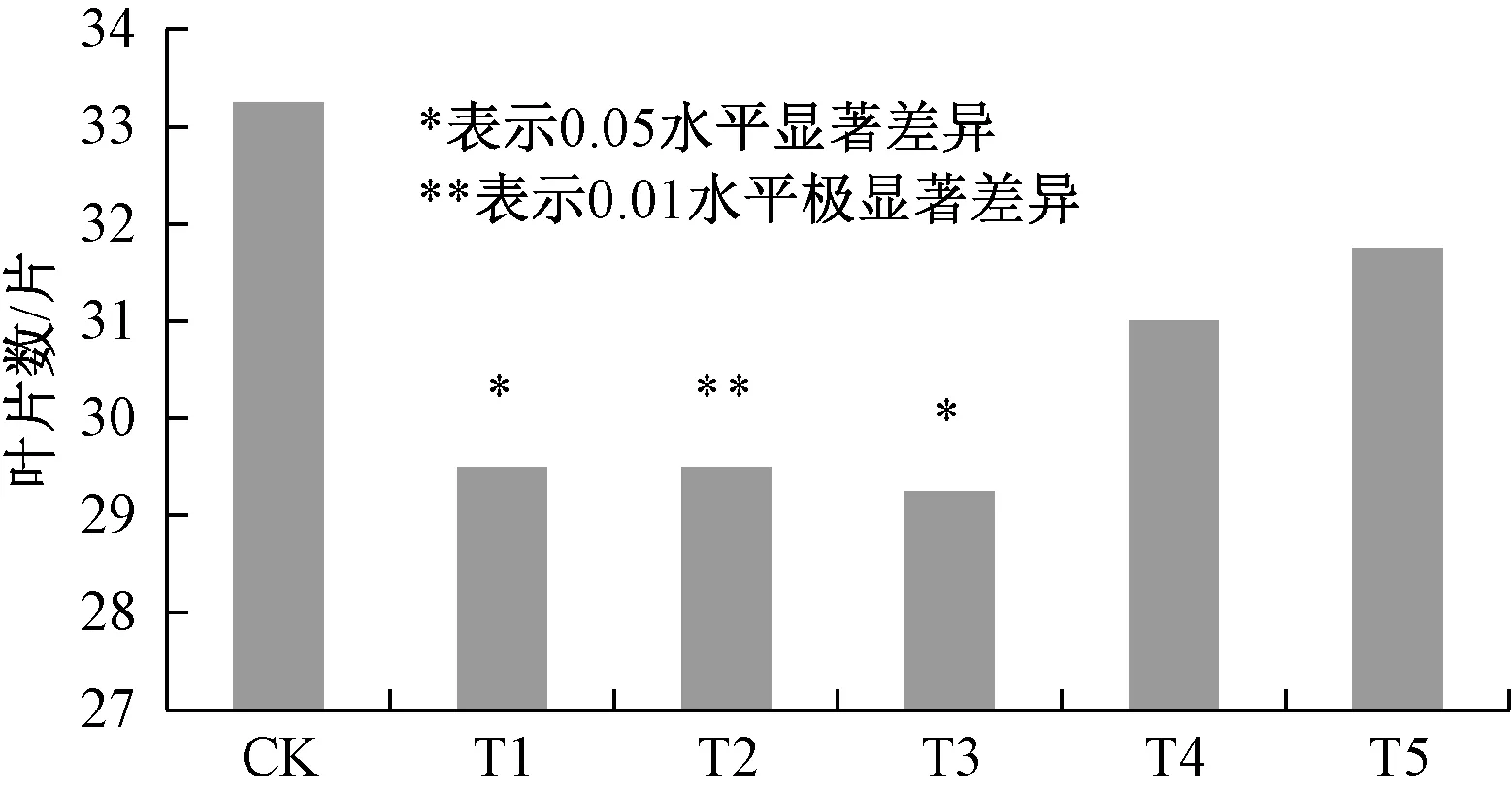
图3 外源甲基紫精条件下烟草现蕾叶片数Fig.3 Leaf number of tobacco when buds occur under exogenous methyl viologen
3 讨论
开花是植物从营养生长转换为生殖生长的生理发育过程,受光周期、温度、激素、年龄等多个因素诱导,在植物生长和物种进化中处于核心地位[18].在拟南芥中已经鉴定出5个关键开花整合子,分别是FLC、FT、SOC1、LFY和SVP,主要位于细胞核内,编码的植物特有的转录因子在生殖生长过程中扮演着开花时间促进基因和花分生组织决定基因双重角色[19].FLC是开花抑制基因,在植物营养生长阶段表达量较高,抑制下游花发育正调控因子的表达.LFY是开花促进基因,在成花转变早期高表达,促进下游花器官发育基因的表达,促进成花.
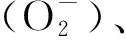
活性氧被证实参与多种生理生化反应,影响植株的生长发育.研究发现20种被子植物的花都有H2O2积累,特别是在柱头[24].文献[25]对两种景观树种研究结果表明,ROS参与了多种花器官早期的发育阶段,在花发育早期,ROS水平在所有花组织中水平较高,然后在发育后期降至低水平,ROS水平在雄蕊中最高.文献[26]进行了荔枝盆栽实验,分别进行低温、中温和高温处理,中温组的树木进行ROS处理后促进了开花.本实验研究发现,低温胁迫和外源过氧化氢处理都引起烟草体内活性氧代谢失衡,烟草现蕾时叶片数减少,烟草花芽分化提前完成[4-5].而有关ROS作为信号分子对植物成花转变及花发育的调控的分子机制还没有深入研究报道.

