中华大蟾蜍EDF-1重组蛋白的原核表达、纯化及抗血清的制备
刘怡君 贾宇坤 王玲芳 刘虹杏 杨仙玉
(浙江农林大学动物科技学院,临安 311300)
内皮分化相关因子-1(Endothelial differentiation related factor-1,EDF-1)最早是在HIV-1-Tat处理的人类内皮细胞中分离的,具有抑制血管内皮细胞分化的作用[1-2],而肿瘤的生长和演进需要形成新血管来提供营养物质,抑制肿瘤新血管的形成可以控制肿瘤的生长。
以蟾蜍(Bufo)为基源的蟾皮、蟾酥和蟾衣等,作为传统中药,具有解毒、抗菌、增强免疫力以及抗肿瘤等多种药理作用[3-5],广泛应用于多种疾病的临床治疗,包括肿瘤的治疗[6-9]。由干蟾皮制成的水溶性注射液——华蟾素,具有良好的抗肿瘤效果,且已有实验表明,其抗肿瘤的有效成分是多肽类物质[10-13]。
作者所在团队多年来从事蟾蜍皮肤相关功能性蛋白的基因克隆研究,以分析蟾蜍皮肤中含有的多肽类有效成分[13-17]。为能更好地挖掘蟾蜍皮肤的药用价值和新药开发潜能,作者尝试将中华大蟾蜍(B. gargarizans)EDF-1开放阅读框(Open reading frame,ORF)[17]亚克隆至原核表达载体诱导其重组蛋白的表达,但是未能成功。因此本研究对中华大蟾蜍EDF-1的ORF进行了密码子优化,并委托公司合成和构建原核表达重组质粒。本文将报告通过密码子优化构建中华大蟾蜍EDF-1原核表达载体的方法,重组蛋白的诱导表达及纯化以及制备鼠抗重组中华大蟾蜍EDF-1的抗血清等的实验结果,为后续研发抑制内皮细胞分化的相关制剂提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 ICR小鼠和鼠饲料购于浙江省实验动物中心,小鼠为40日龄健康的雌鼠。
1.1.2 实验材料 大肠杆菌(E. coli)感受态细胞BL21(DE3)、PVDF膜、Protein Maker、异丙基 -β-D-硫代半乳糖苷(IPTG)、卡那霉素(Kanamysin,Kan)、小鼠抗His-tag抗体和辣根过氧化酶标记山羊抗小鼠抗体购自碧云天生物技术研究所;X-tractor和BeyoGoldTMHis-tag Purification Resin(钴胶)购自Clontech公司;基因合成委托苏州金维智生物科技有限公司;弗氏完全佐剂和弗氏不完全佐剂购于Sigma公司。
1.2 方法
1.2.1 重组表达载体的构建 在前期工作中构建的原核表达载体不能在宿主大肠杆菌顺利表达,考虑可能因密码子的偏好性,真核细胞的密码子在原核细胞中存在识别困难。通过E. coliCodon Usage Analysis 2.1软件进行密码子的偏好性分析。根据上述结果,对方琦璐等[17]克隆的中华大蟾蜍EDF-1(GenBank 登录号K F769459)的ORF委托公司进行密码子优化,化学合成,并连接到原核表达载体pET-28b,构建密码子优化后的重组质粒pET-28b-EDF-1-Bufo。
1.2.2 重组蛋白的诱导表达 将重组质粒pET-28b-EDF-1-Bufo转化至感受态细胞BL21(DE3)中,涂布于LB固体培养基(含50 mg/L Kan),37℃倒置培养12-15 h。次日,取一单菌落接种于l mL LB培养液(含50 mg/L Kan),37℃恒温振荡培养12-15 h。将过夜培养的菌液按l %的体积接种于LB培养液(含50 mg/L Kan),在37℃恒温震荡培养至OD600值0.7-1.0时,加入IPTG使其终浓度分别为0、0.001、0.01、0.1、1 mmol/L,并在30℃和37℃分别进行重组蛋白的诱导表达。每隔1 h收集一次菌液,通过离心收集菌体,加入1×SDS-PAGE上样缓冲液裂解菌体并进行聚丙烯酰氨凝胶电泳(SDS-PAGE)以探索重组蛋白诱导表达的最佳条件。使用His-tag单克隆抗体进行Western-blot以确定过量表达蛋白为目的蛋白。
1.2.3 可溶性检测及纯化 按上述最佳条件,对重组中华大蟾蜍EDF-1进行大量诱导表达。在收集的0.5 mL 培养的菌体中加入 40 μL X-tractor、0.05 μL DNaseⅠ和0.5 μL 12 mg/mL溶菌酶使菌体彻底裂解,然后16 100×g离心20 min,将分离的上清和沉淀分别进行SDS-PAGE。根据可溶性检测结果,收集上清,按照钴胶使用说明,取2 mL钴胶(含1 mL储存液)加入纯化柱内,用平衡液(pH 8.0)置换储存液后,加入上清使其与钴胶混合1 h,然后用2mmol/L 咪唑溶液(pH 8.0)洗涤5次,150 mmol/L咪唑溶液(pH 8.0)洗脱,纯化的重组蛋白作为制备抗血清的抗原。
1.2.4 小鼠抗重组中华大蟾蜍EDF-1抗血清的制备及其特异性和效价检测 将纯化的重组中华大蟾蜍EDF-1(蛋白浓度约1.5 μg/L)35 mL与弗氏完全佐剂1∶1混匀,在小鼠皮下多点注射;两周后再与弗氏不完全佐剂1∶1混匀皮下注射,该步骤每周重复一次,共免疫4次。最后一次免疫一周后心脏采血,1 500×g离心30 min,上清即小鼠抗重组中华大蟾蜍EDF-1抗血清。抗血清的特异性通过Western-blot进行检测。效价检测使用间接ELISA,以纯化的重组中华大蟾蜍EDF-1(2 μg/mL)为抗原,以小鼠抗重组中华大蟾蜍EDF-1抗血清为一抗,抗血清从最低稀释倍数1∶1000连续2倍比稀释。显色后,进行OD450检测,若抗血清与阴性对照的比值(P/N)≥2.1,即判定为有效效价。
2 结果
2.1 重组质粒pET-28b-EDF-1-Bufo的获得
根据E. coliCodon Usage Analysis 2.1软件分析结果(图1)显示中华大蟾蜍EDF-1有16%密码子在大肠杆菌中使用频率小于10%,存在识别困难的问题。委托公司优化中华大蟾蜍EDF-1ORF 的密码子并合成(图2),连接至原核表达载体,最终构建pET-28b-EDF-1-Bufo重组质粒。
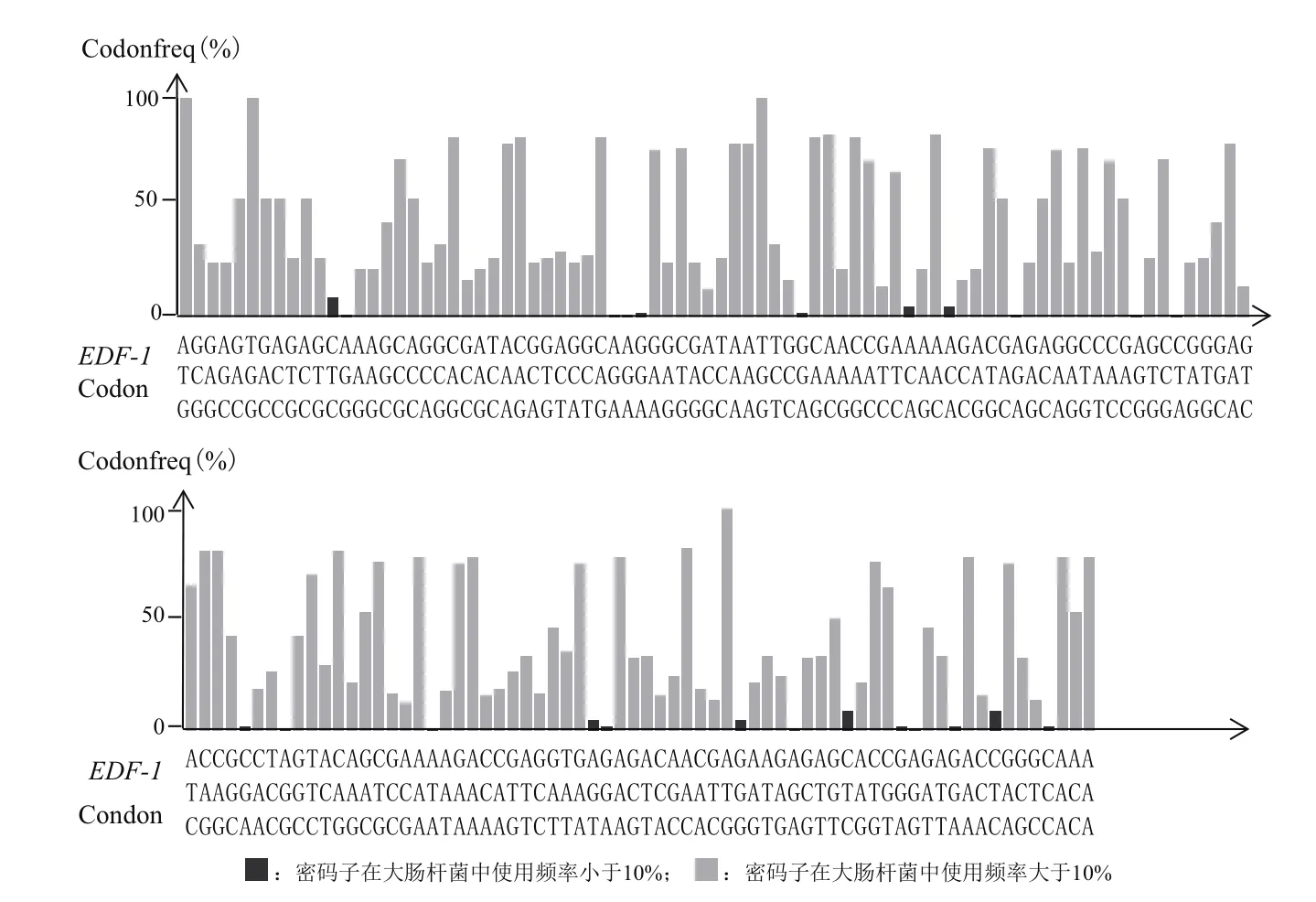
图1 中华大蟾蜍EDF-1序列与大肠杆菌密码子偏好性分析
2.2 重组中华大蟾蜍EDF-1诱导表达条件的优化
将重组质粒转入E. coliBL21(DE3)后,使用不同的IPTG浓度、时间和温度诱导重组中华大蟾蜍EDF-1的表达。SDS-PAGE结果(图3)显示,除对照组和IPTG浓度为0.001 mmol/L的样品外,其他样品均在20 kD附近出现明显过量表达的蛋白,与预测的分子量19.662 kD非常接近,并且随诱导时间的延长和IPTG浓度的增加表达量增加。为减少重组蛋白进入包涵体以及恒温振荡器的使用方便,选取37℃(实验室常用)、0.01 mmol/L IPTG和诱导3 h作为最佳表达条件。
2.3 可溶性检测
可溶性检测(图4)表明,重组中华大蟾蜍EDF-1蛋白主要分布于上清中,小部分分布于包涵体中。
2.4 重组目的蛋白的免疫印迹检测
为确定过量表达重组蛋白是目的蛋白,使用His-tag抗体作为一抗实施Western-blot检测。结果(图5,泳道2和4)显示,IPTG诱导的样品在分子量20 kD附近出现明显的信号,与SDS-PAGE结果吻合,表明该蛋白确实为目的蛋白。

图2 中华大蟾蜍EDF-1优化前和优化后ORF碱基序列

图3 重组中华大蟾蜍EDF-1在不同温度、IPTG浓度、时间条件下的诱导表达
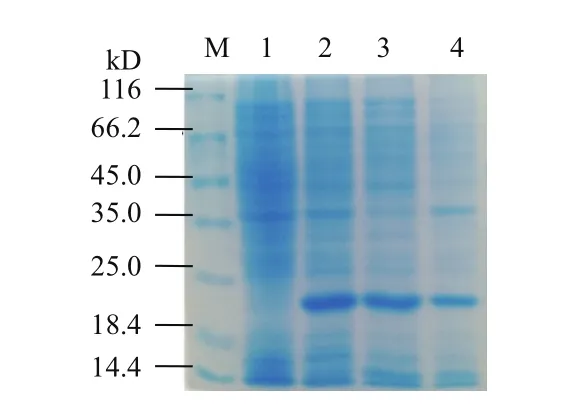
图4 重组中华大蟾蜍EDF-1可溶性检测
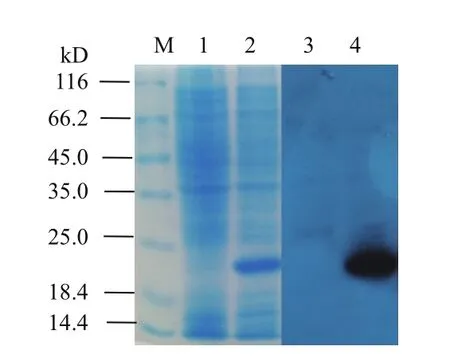
图5 重组中华大蟾蜍EDF-1的Western-blot检测
2.5 小鼠抗EDF-1-Bufo抗血清的特异性及其效价检测
Western-blot检测结果(图6)显示,小鼠抗重组中华大蟾蜍EDF-1的抗血清特异性良好。检测OD450结果(表1)显示,抗血清稀释倍数达到1∶8 000时,P/N值为3.1,大于2.1,稀释倍数达到1∶16 000时,P/N值为2.01,小于2.1,故该抗血清效价为1∶8 000。

图6 重组中华大蟾蜍EDF-1以抗血清为一抗的Westernblot检测
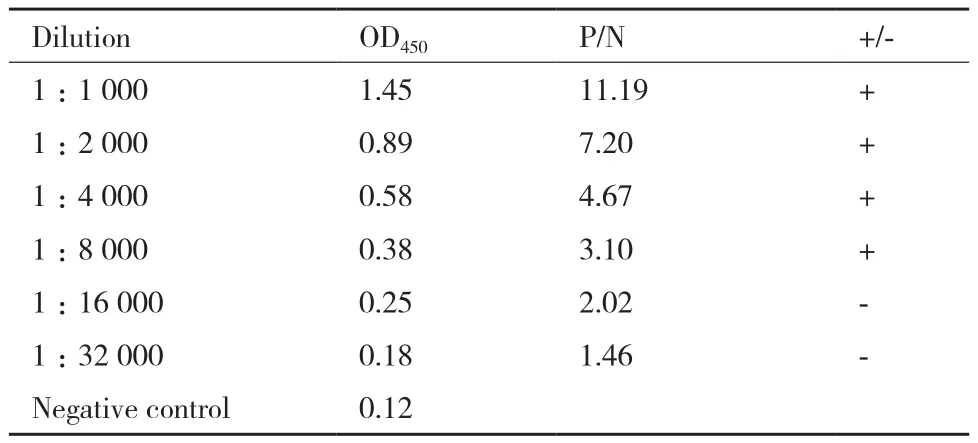
表1 EDF-1-Bufo ELISA检测效价结果
3 讨论
内皮细胞是位于血管内表面的单层扁平上皮细胞,组成血管的内壁。因此,无内皮细胞的分化,就没有新血管的形成。临床与动物实验证明,肿瘤的生长及演进也需要通过生成新血管为其提供所需营养[18]。没有新生血管的营养供应,肿瘤在直径或厚度达到1-2 mm后将不再增大,因此抑制肿瘤血管生成的研究是当前的研究热点之一[19-20]。
EDF-1具有抑制内皮细胞分化的作用,能够阻断新血管生成。EDF-1不仅在人类的内皮细胞中分离得到[1],在小鼠、壁虎中也克隆到该蛋白编码的基因[2]。研究发现,血管的形成和血管完整性与一氧化氮(NO)在组织中的浓度息息相关,而EDF-1可以通过与细胞质中的钙调素结合,降低一氧化氮合成酶的活性,从而减少NO的含量[21-24]。又有研究发现,EDF-1与家蚕(Bombyx mori)的MBF-1(Multiprotein Bridging Factor-1)和盘基网柄菌(Dictyostelium discoideum)早期发育相关的H7高度同源,因此有人提出,EDF-1可能是转录激活因子,通过结合通用转录因子TBP(TATA Binding Protein)调节基因的表达,进而参与内皮细胞分化的抑制,但此观点有待进一步验证[1,25-26]。
4 结论
本研究首次优化中华大蟾蜍EDF-1ORF的密码子,构建其原核表达载体,明确重组中华大蟾蜍EDF-1原核表达的最佳条件,获得特异性和效价优良的小鼠抗中华大蟾蜍重组EDF-1的抗血清,为今后对EDF-1生理功能等进一步研究奠定了良好基础。
在中华大蟾蜍皮肤中EDF-1的发现揭示蟾蜍皮肤相关药物中,EDF-1很可能是其中的多肽类有效成分之一。

