氧化苦参碱对转化生长因子β1诱导大鼠心肌成纤维细胞增殖与分化的抑制作用
乔璐,李博,李庆
郑州市第一人民医院,河南 郑州 450008
心肌纤维化是由胶原纤维大量积聚、心肌胶原浓度比例失衡引起的[1~2]。心肌成纤维细胞(Cardialfibroblasts,CFs)是心肌组织的重要组成部分,病理增殖分化过度时会大量分泌胶原蛋白,是形成心肌纤维化的病理基础[3~4]。转化生长因子-β1(Transforming growth factor-β1,TGF-β1)是心肌纤维化形成的重要调控因子,在作用于CFs后,主要通过TGF-β信号通路中的Smads蛋白,转导和调节相关基因表达,促进胶原纤维的合成及纤维化的发展[5~6]。氧化苦参碱(Oxymatrine,OM)为苦参的有效成分,具有抗纤维化、抗炎等作用。既往研究已证实OM对心肌细胞受损有保护作用,且能够有效治疗心肌纤维化[7]。因此,本研究进一步通过OM干预接受TGF-β1刺激的CFs增殖模型,观察OM对该模型的抑制作用及干预机制。
1 材料与方法
1.1 实验动物 实验动物选取出生1~3 d内的新生SD大鼠480只,雌雄不限,购自长沙天勤生物技术有限公司,动物许可证号:SCXK(湘)2014-0011。
1.2 药品与试剂 98%OM(陕西帕尼尔生物科技有限公司);TGF-β1、荧光定量PCR试剂盒、Vimentin兔抗人波形蛋白及Fibronection兔抗体(美国 Pepro Tech公司);兔抗 PCNA、α-SMA抗体和DABKit(上海瑞齐生物技术有限公司);大鼠Ⅰ型胶原纤维(CoL-Ⅰ)、Ⅲ型胶原纤维(CoL-Ⅲ)ELISA试剂盒(上海晶天生物科技有限公司);RNA提取试剂盒(北京中杉金桥公司),Smad2、Smad3 XPRabbit mAb[赛信通(上海)生物试剂有限公司]。
1.3 CFs的培养及鉴定 用75%的乙醇对新生SD大鼠皮肤进行消毒,固定大鼠四肢,剪取心脏前1/3部分组织,洗净后转存入青霉素小瓶中,剪为大小不超过1 mm3的碎块,平铺在培养瓶底,加入含有10%血清的DEME培养基,倒置培养瓶于95%饱和湿度的培养箱中培养,4 h后翻转培养瓶,保证培养基浸过组织块后继续置于培养箱中孵育,每隔1天更换培养液[8]。待细胞生长面积没过瓶底后进行传代,将传代后3代的CFs作为实验对象。通过免疫细胞化学法染色证实细胞中存在波形蛋白及纤维连接蛋白表达者,为CFs。培养的CFs分为对照组、TGF-β1组及观察组。
1.4 MTT法检测CFs增殖情况 细胞接种、步骤同上。对照组(无血清DEME)及TGF-β1组采用浓度为20 ng/mL TGF-β1孵育24 h;先对观察组采用3.78×10-4mol/L的OM预处理后,再加入浓度为20 ng/mLTGF-β1孵育24 h,通过免疫检测仪上490 nm波长处测定光吸收值(A490值),判断各组CFs增殖情况。
1.5 ELISA法检测CoL-Ⅰ、CoL-Ⅲ含量 将所有处理过的CFs消化离心,经磷酸缓冲盐溶液(Phosphate buffer saline,PBS)制成细胞悬液,待细胞浓度达到1×106个/mL后,采用复冻融破坏细胞,诱导细胞分泌蛋白,1 500 r/min离心30 min后,用ELISA法检测CoL-Ⅰ、CoL-Ⅲ含量,含量越高则表明细胞胶原表达越多,以上操作严格按照ELISA试剂盒说明书进行。
1.6 RT-PCR检测Smad2 mRNA表达水平 用RNA提取试剂盒提取处理好的CFs的总RNA,逆转录合成cDNA;严格按照YBRPremix Ex Taq试剂盒操作,加入上、下游引物(Smad2上游序列:ACCACTCTCTC-CCCTGTCAAT,下游序列:CAAACCTAAGCAGAAC-CTCTCC;β-actin上游序列:CACCC GCGAG-TACAACCTTC,下游序列:CCCATACCCACC ATCACACC。)进行PCR反应。根据 2-ΔΔCt进行Smad2 mRNA的相对表达量分析。
1.7 Westorn blot检测α-SMA、PCNA、Smad2及Smad3表达水平 TGF-β1刺激1 h、24 h后,离心收集细胞,检测α-SMA、PCNA、Smad2及Smad3表达水平。PBS反复洗涤,根据蛋白提取试剂盒提取总蛋白,通过BCA蛋白定量试剂盒对处理好的CFs行蛋白定量,上样,10%SDS-聚丙烯酰胺凝胶电泳分离总蛋白,转膜,1%BSA封闭,加一抗稀释液(1∶1 000),洗膜后加二抗稀释液(1∶5 000),对所得样本行免疫蛋白印记分析,通过ECL化学发光试剂盒显像,并分析各蛋白条带灰度值,以β-actin为内参标准,分别计算α-SMA、PCNA、Smad2及Smad3灰度值与β-actin灰度值的比值。
1.8 统计学方法 采用SPSS22.0软件进行分析,计数资料以n,%表示,行χ2检验,计量资料用(±s)表示,行独立t检验,P<0.05为差异有统计学意义。采用重复测量数据的方差分析3组CFs增殖水平、胶原蛋白及Smads间的差异性及各时间点测量值的时间差异性。
2 结果
2.1 原代CFs形态特征 见图1。显微镜观察组织块培养的CFs生长情况,3~5天后CFs游出组织块,呈形态饱满的菱形、多角形胞体,均为贴壁生长,胞质透明且折光性强。6~10天后细胞排列紧密,且呈相互融合状态。传代培养保留了原代的特点,采用反复差速贴壁方法培养,纯度更高。免疫细胞化学法染色后,显微镜下可见波形蛋白细胞胞质被染成棕黄色,纤维连接蛋白染色呈强阳性,均符合CFs染色特征,纯度超过99%。

图1 各时期CFs形态(×200)
2.2 各组大鼠CFs增殖水平及CoL-Ⅰ、CoL-Ⅲ含量结果比较见表1。与对照组比较,TGF-β1组CFs的CoL-Ⅰ、CoL-Ⅲ含量均增加(P<0.05);与TGF-β1组比较,观察组CFs的A490、CoL-Ⅲ均明显降低(P<0.05)。
2.3 各组大鼠CFs Smad2 mRNA、PCNA、α-SMA、Smad2和Smad3表达结果比较 见表2、图2。与对照组比较,TGF-β1组Smad2 mRNA、PCNA、α-SMA、Smad2和Smad3明显升高(P<0.05);与 TGF-β1组比较,观察组的 Smad2 mRNA、PCNA、α-SMA、Smad2和Smad3均明显降低(P<0.05)。
表1 各组大鼠CFs增殖水平及CoL-Ⅰ、CoL-Ⅲ含量结果比较(±s)
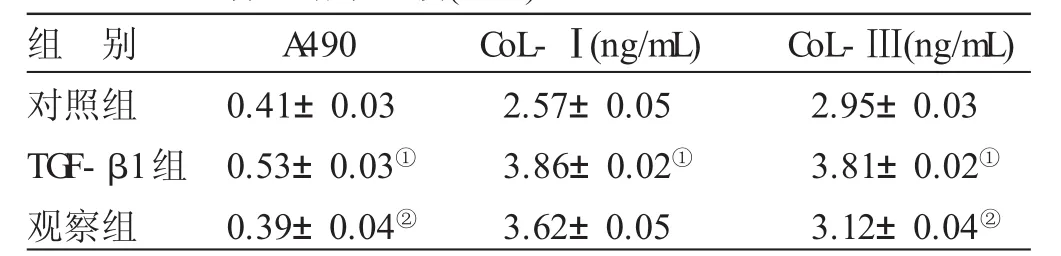
表1 各组大鼠CFs增殖水平及CoL-Ⅰ、CoL-Ⅲ含量结果比较(±s)
与对照组比较,①P<0.05;与TGF-β1组比较,②P<0.05
组 别对照组T G F-β 1组观察组A 4 9 0 0.4 1±0.0 3 0.5 3±0.0 3①0.3 9±0.0 4②C o L-Ⅰ(n g/m L)2.5 7±0.0 5 3.8 6±0.0 2①3.6 2±0.0 5 C o L-Ⅲ(n g/m L)2.9 5±0.0 3 3.8 1±0.0 2①3.1 2±0.0 4②
表2 各组大鼠CFs Smad2 mRNA、PCNA、α-SMA、Smad2和Smad3表达结果(±s)

表2 各组大鼠CFs Smad2 mRNA、PCNA、α-SMA、Smad2和Smad3表达结果(±s)
与对照组比较,①P<0.05;与TGF-β1组比较,②P<0.05
组 别对照组T G F-β 1组观察组S m a d 2 m R N A 3.2 6±0.0 2 5.5 7±0.0 3①3.5 2±0.0 4②P C N A(灰度值)0.3 1±0.0 2 0.7 6±0.0 4①0.4 3±0.0 3②α-S M A(灰度值)0.4 2±0.0 4 0.8 4±0.0 3①0.5 3±0.0 2②S m a d 2(灰度值)0.4 5±0.0 2 1.0 2±0.0 3①0.5 8±0.0 4②S m a d 3(灰度值)0.5 1±0.0 3 0.9 7±0.0 4①0.7 6±0.0 5②
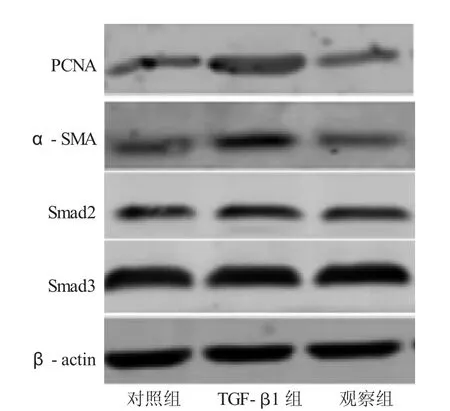
图2 各组大鼠CFs PCNA、α-SMA、Smad2和Smad3蛋白印迹结果比较
3 讨论
心肌纤维化的形成原因与胶原比例失衡有关,其病理基础则是由CFs的增殖分化过度引起的[9~10]。TGF-β1是目前治疗器官纤维化的重要靶标,是调控细胞增殖分化的重要因子,促进细胞外机制沉淀积聚,诱导CFs的增殖分化,刺激胶原蛋白的高表达,进而导致细胞外基质降解与合成失衡,最终引发心肌纤维[11]。相关研究表明,Smad蛋白为TGF-β信号通路中的主要分子,Smad信号能够介导胶原蛋白的合成,且TGF-β1发挥其生物学作用也是通过Smads信号通路完成的[12~13]。
本研究结果显示,CFs经过TGF-β1的诱导处理后,TGF-β1组的CFs的A490值明显较对照组高,但观察组OM预处理后的A490值则明显低于TGF-β1组。提示TGF-β1能够诱导CFs增殖,但OM能够有效抑制CFs的增殖。研究表明,OM有较强的抗皮肤、肝纤维化的作用,能够抑制肝星状细胞中TGF-β1的表达[14]。原因可能是OM为中药苦参的有效成分,是四环喹嗪啶类结构生物碱,具有抗心律失常、抑制胶原活动度及抗纤维化等作用。
PCNA为DNA合成和复制的辅助因子,是反应细胞增殖情况的标志分子之一,PCNA的增加能表明细胞增殖活跃,可参与肺纤维化的进展[15]。α-SMA是肌细胞的标志物,可以作为成纤维细胞转化为肌成纤维细胞的标志物,α-SMA的高表达状态提示胶原蛋白的合成增加[16]。肌细胞外间质主要成分是CoL-Ⅰ、CoL-Ⅲ,当心肌纤维化发展时,胶原蛋白表达上调,细胞外基质沉积,导致心脏功能受损。研究证实,TGF-β1能够明显诱导CFs增殖,并促进胶原蛋白的合成[17]。本研究结果表明,TGF-β1组CFs的PCNA、α-SMA、CoL-Ⅰ、CoL-Ⅲ均明显高于对照组。证实TGF-β1能够诱导CFs大量增殖,且在TGF-β1刺激下,大量成纤维细胞转化为肌成纤维细胞,而经过转变的成纤维细胞则会合成和分泌大量胶原,引起细胞外基质沉积,促进心肌纤维化的进展。而观察组的PCNA、α-SMA、CoL-Ⅰ、CoL-Ⅲ均明显低于TGF-β1组,提示OM能够改善胶原及细胞外基质大量堆积的情况,阻止纤维化进展。
赵娜等[18]研究发现苦参素能够抑制TGF-β/Smads信号通路,有效改善糖尿病心肌病大鼠的心肌纤维化发展。国外研究发现,心肌纤维化与TGF-β1诱导的Smads的磷酸化以及磷酸化的Smads核移位有关[19]。本研究结果也显示,TGF-β1组CFs Smad2基因、Smad2、Smad3蛋白表达明显高于对照组,而观察组上述指标的表达则明显低于TGF-β1组。提示心肌纤维化的发展与Smad2、Smad3密切相关。且可以从中发现OM能够有效抑制TGF-β1的表达,从而降低Smad2、Smad3蛋白表达水平,起到阻断TGF-β/Smads信号通路,减少细胞外基质的堆积,降低胶原蛋白的大量分泌,抗纤维化的作用。
综上,OM能够明显抑制TGF-β1诱导的CFs增殖与分化,主要作用机制可能与降低心肌纤维化发生发展的Smad2、Smad3蛋白表达,进而阻断TGF-β/Smads信号系统有关。具体作用机制还需进一步的临床研究。

