2012年—2015年安徽省H9N2禽流感病毒抗原变化分析
胡晓苗,张丹俊,戴 银,赵瑞宏,潘孝成,周学利,侯宏艳,沈学怀,朱传明
(安徽省农业科学院畜牧兽医研究所,安徽合肥 230031)
禽流感病毒(Avian influenza virus, AIV)易发生点突变引起抗原漂移,不同亚型毒株同源重组,引起抗原频繁变异,产生众多血清亚型[1]。因此,对禽流感的有效防控一直都面临极大的挑战。H9N2亚型AIV在中国家禽中呈地方流行性并呈蔓延趋势,如果继发感染其他病原,则病死率大大升高,同时还可作为H5N1、H7N9和H10N8的新型人类禽流感病毒的基因供体,严重威胁公共卫生安全[2-4]。国内已经使用Ck/SD/6/96和Ck/SH/F/98等作为疫苗株[5]来防控H9N2禽流感。然而,在巨大的疫苗压力和环境选择下,H9N2病毒在已经接种疫苗的鸡群中仍然不断发生着抗原漂移[6-9],人们迫切需要了解当前流行毒株的抗原特性和常用疫苗对这些病毒的保护效率。
本试验选取2012年—2015年我国安徽省分离的24株H9N2亚型AIV进行HA基因序列测定、遗传演化分析和抗原位点分析,选取1株流行株与疫苗株F98进行抗原差异分析,以了解当前H9亚型AIV变异动向及抗原性变化,为H9禽流感疫苗的评估和使用提供依据。
1 材料与方法
1.1 材料
1.1.1 病毒和鸡胚 本试验中使用的24株H9N2亚型AIV分离毒株,2012年—2015年间自安徽省家禽养殖场和活禽市场中分离;疫苗毒株为 A/chicken/Shanghai/F/98(F株)[8],扬州大学农业部畜禽传染病学重点开放实验室提供;无特定病原体(SPF)种蛋,购自北京梅里亚公司,由安徽农业科学院畜牧兽医研究所兽医研究室实验室孵育至9日龄~11日龄。
1.1.2 试剂 RNA提取试剂Trizol Reagent,Invitrogen公司产品;AMV反转录酶及TaqDNA聚合酶,Fermentas公司产品;RNA酶A、dNTPs、DNA Marker、RNA提取试剂盒、DNA Gel Extraction Kit (AxyPrep),Axygen公司产品;RNA酶抑制剂(RNasin),宝生物工程(大连)有限公司产品;其余试剂均为国产分析纯级产品。
1.1.3 引物 反转录引物为5′-AGCAAAAGCAGG-3′;HA基因扩增的通用引物1对,P1:5′-AGCGAAAGCAGGGG-3′;P2:5′-AGTAGAAACAAGGGTGTTTT-3′;引物由南京金斯瑞生物技术有限公司合成。
1.2 方法
1.2.1 RT-PCR 扩增HA基因片段 用病毒RNA提取试剂盒抽提病毒总RNA。用反转录引物和反转录酶(A-MLV)对病毒RNA反转录获得病毒基因组cDNA。以cDNA为模板进行PCR,HA基因扩增的通用引物P1/P2特异性扩增出HA基因片段。将PCR回收产物连同PCR引物,送金斯瑞生物科技有限公司测序。
1.2.2 HA基因的测序和遗传进化树绘制 含HA基因的PCR产物由南京金斯瑞有限公司测序。采用Lasergene 7.1软件进行HA基因序列编辑和翻译;用Mega5.1软件绘制遗传进化树。
1.2.3 流行株A/chicken/Anhui/20150416/2015和疫苗株F98灭活疫苗的交叉免疫保护试验 收集A/chicken/Anhui/20150416/2015(AH0416)和F98毒株感染鸡胚的尿囊液,用3.5 mg/mL甲醛灭活72 h,与白油混和均匀,制成油乳剂疫苗。将36只3周龄SPF鸡随机分为6组,每组6只,隔离饲养;其中2组接种F98株禽流感灭活油乳疫苗(0.2 mL/只),2组接种H9亚型流行株AH0416株禽流感灭活油乳疫苗(0.2 mL/只) ,另外2组接种灭菌PBS (0.2 mL/只)作为对照。21 d后采集各组鸡的血清,分别以F98和AH0416作为抗原,测定血凝抑制 (HI) 抗体效价(以log2表示);免疫同种疫苗的2组动物分别用F98和AH0416毒株经鼻腔途径攻毒,同时接种PBS对照组,剂量为每只鸡106EID50/0.1 mL。攻毒后第3、5、7天,采集喉头和泄殖腔拭子样品。
1.2.4 实时荧光定量PCR检测排毒情况 用试剂盒提取交叉免疫保护试验所采集棉拭子样品中的病毒RNA,用TaqMan-MGB实时荧光定量PCR检测样品中是否存在H9N2病毒的核酸,参照文献[10]实施。分别统计各组鸡的排毒情况。
2 结果
2.1 HA基因的序列分析
对24株分离株HA基因测序分析显示,HA基因全长为1 683 bp,共编码560个氨基酸,与H9亚型禽流感病毒华东地区经典株A/Chicken/Shanghai/F/98(F98)相比,无核苷酸的插入或缺失。本研究24个毒株HA基因核苷酸同源性在94.5%~99.9%之间,与Dk/HK/Y280/97的核苷酸序列及其推导出的氨基酸同源性分别在90.5%~94.8%和91.6%~95.8%之间,与Ck/SH/F/98的核苷酸序列及其推导出的氨基酸同源性分别在89.8%~91.6%和92.0%~93.8%之间,相比较而言,本研究的24个毒株HA基因与Dk/HK/Y280/97(Y280-lik)的同源性更高,说明与Y280-like的遗传距离更近,具有相同起源。
根据完整的HA基因编码的氨基酸序列绘制HA基因的遗传进化树,由图1可看出,本研究的所有毒株均属于Y280-like。但是,除了2株2014年的分离株外,所有分离株都聚集在与Y280-like遗传进化距离较远的分支上,与上述氨基酸同源性分析结果一致,说明H9N2亚型病毒在中国正持续进化,趋于形成稳定的分支。2012年—2015年的毒株在遗传进化树上的分布较集中,说明病毒之间的遗传进化距离比较近,在这4年间病毒并未发生大的遗传变异。但与常用的疫苗株F98已有了较大的遗传差异。
2.2 HA基因抗原位点变异分析
在24株H9N2禽流感病毒HA1所有变异的氨基酸中包含部分抗原位点。本研究以文献[11]人H3亚型流感病毒A/Achi/2/68毒株的HA基因氨基酸序列作为参照,推导并比较了本研究毒株HA基因的几个关键位点的氨基酸序列,再根据A/Swine/HongKong/8/98 HA晶体结构模型[12],对这些毒株HA1的变异位点进行归类,结果表明,2012年—2015年间发生禽流感病毒的氨基酸位点变异主要集中在与H3亚型相对应的C、D和E 3个抗原变异区,而A和B位点相对保守(表1)。

◆.毒株;●.F98疫苗株;▲.Y280株;◇.试验用株
◆.Strains; ●.F98 vaccine strain; ▲.Y280 strain; ◇.Experiment strain

图1 HA基因遗传进化树
2.3 交叉免疫保护试验
AH0416于2015年从鸡体分离,根据HA基因遗传进化树显示,该分离株与F98的遗传距离最远,且为近年分离的毒株,故选取其与疫苗株F98进行交叉免疫保护试验,评价流行株抗原性的变化。对3周龄SPF鸡接种H9亚型AH0416株禽流感灭活疫苗21 d后,产生的针对AH0416株和F98株的HI抗体效价分别为8.36 log2和7.16 log2,接种H9亚型F98株疫苗21 d后,产生的针对AH0416株和F98株的HI抗体效价分别为7.53 log2和 8.09 log2(表2)。结果表明,H9灭活疫苗免疫,均能诱导产生较高的中和免疫毒株的血清抗体(大于8 log2),但对遗传距离较远的异源病毒的中和效价要低1个~2个滴度,说明随着H9N2病毒不断进化,其抗原性也随之发生改变。

表2 F98与AJ3株之间交叉血凝抑制结果
H9病毒灭活苗对SPF鸡的保护效率见表3。F98株攻毒后,F98疫苗可以保护SPF鸡不排毒,免疫组攻毒第3天的喉头排毒率为33.33%(2/6),泄殖腔排毒率为33.33%(2/6);第5天的喉头排毒率为16.67%(1/6),泄殖腔排毒率为33.33%(2/6),第7天停止排毒;PBS对照组第3天喉头和泄殖腔的排毒率为100%(6/6),第5天喉头的排毒率为50%(3/6),泄殖腔排毒率为100%(6/6)。AJ3株攻毒后,AH0416疫苗可以保护SPF鸡不排毒;F98株攻毒第3天的喉头排毒率为33.33%(2/6),泄殖腔排毒率为1/6;第5天的喉头排毒率为16.67%(1/6),泄殖腔排毒率为50%(3/6),第7天停止排毒;PBS对照组第3天喉头和泄殖腔的排毒率为100%(6/6),第5天喉头的排毒率为50%(3/6),泄殖腔排毒率为83.33%(5/6)(表3)。排毒情况与交叉血凝试验结果一致,证明流行株的抗原性已经发生了变化,F98疫苗对其无法提供完全保护。
3 讨论
近年来,国内有报道认为当前H9N2亚型AIV流行毒株已经发生了显著变化, 现有疫苗已经不能产生完全免疫保护[13]。本研究对2012年—2015年期间从安徽地区鸡群分离的24株流行毒株所进行的HA基因测序分析,结果24株与Dk/HK/Y280/97的同源性更高,与Y280-like的遗传距离更近,具有相同起源。根据HA基因ORF编码的氨基酸序列绘制HA基因的遗传进化树,本研究的所有毒株均属于Dk/HK/Y280/97-like,但与Dk/HK/Y280/97遗传进化距离比较远。除了2014年的2株与Y280遗传距离较近之外,其他毒株都聚集在较远的独立分支,说明2012年—2015年的H9N2病毒正在不断进化,近年来形成的分支与之前的Y280株已有了较大的遗传差异。对这些毒株HA1的变异位点进行归类,结果表明,发生的氨基酸变异位点主要集中在与H3亚型相对应的C、D和E3个抗原变异区,共有28个氨基酸发生变化,预示着流行株的抗原特性可能发生了一些改变。
为了研究当前流行株与疫苗株F98之间的抗原差异,本研究选取一株遗传进化树中距离F98株最远的分离株AH0416,用其和F98株进行交叉免疫保护试验。发现灭活疫苗免疫对同种病毒可以提供完全保护,而不能完全阻断异种H9N2病毒的排毒。表明当前的流行毒株AH0416是一株抗原变异株,在基因水平上发生的变异已经累计到抗原性的变化,常用的疫苗已经不能提供完全保护。加强对H9N2亚型禽流感病毒生物学特性和分子流行病学研究,掌握其遗传变异规律,研发合适的新型疫苗,对于科学防控H9N2禽流感意义重大。
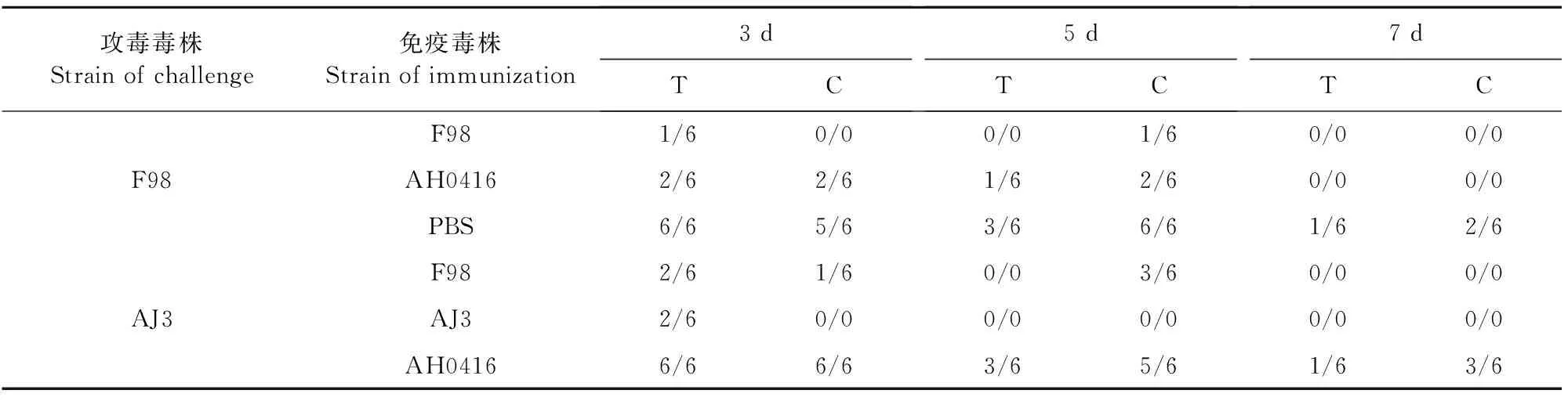
表3 H9病毒灭活疫苗对SPF鸡的保护效率
注:C.泄殖腔,T.喉头。
Note:C.Cloaca,T.Larynx.

