基于声触诊组织成像和定量技术鉴别诊断乳腺实性肿瘤
昝星有,丁炎,周卫平,朱巧英,吴鹏西,李明
(南京医科大学附属无锡人民医院1.超声医学科,2.医学影像科,江苏 无锡 214023)
在中国,乳腺超声是乳腺癌最重要的筛查和诊断技术之一。近年来发展起来的剪切波弹性成像技术,成为多模态乳腺超声中术前诊断乳腺肿瘤的重要方法之一。声辐射力脉冲(acoustic radiation force impulse, ARFI)成像较应变弹性成像技术具有更好的图像稳定性和无明显深度依赖性,对检查者和仪器的依赖性明显减小。声触诊组织成像和定量(virtual touch tissue imaging quantification,VTIQ)作为一种实时二维剪切波弹性成像方法,可反复多次测量,可自定义感兴趣区,且测量范围可以完整包络肿块及部分肿块周边组织。VTIQ可定量分析肿块内部任意点(1 mm×1 mm)弹性剪切波速度(shear wave velocity, SWV),从而反映出器官或组织内部的绝对硬度。本研究拟采用VTIQ技术研究乳腺肿瘤内部9点最高SWV,获得肿瘤内部最大硬度值,获取诊断界值,从而鉴别诊断乳腺实性肿瘤。
1 对象与方法
1.1 研究对象
连续纳入2016年11月至2017年4月在无锡市人民医院就诊且收治住院的乳腺肿瘤患者,术前行常规二维超声检查,对符合入组条件的患者行乳腺剪切波弹性超声检查。所有肿瘤均经过手术和病理证实。共106例,均为女性,年龄16~78岁,平均(46.3±14.1)岁。肿瘤直径6.7~43.0 mm,平均(17.9±7.8) mm。其中良性肿瘤67例,恶性肿瘤39例。
入选标准:(1) 超声可探及肿块;(2) 乳腺实性肿块;(3) 乳腺BI- RADS分类≥3类。排除标准:(1) 孕妇;(2) 哺乳期妇女;(3) 乳腺假体植入;(4) 乳腺放化疗史;(5) 乳腺肿块曾行活检;(6) 受检侧乳腺手术史;(7) 乳腺肿块伴大量粗大钙化;(8) 乳腺囊性肿块。
肿块的选择:每个患者仅评估1个肿块。如双侧乳腺内有多发肿瘤,则先进行乳腺BI- RADS分类,剪切波评估分类级别最高的肿瘤,分类级别低的另一侧乳腺肿瘤则不纳入本研究;如腺体内有多个BI- RADS分类级别相同的肿瘤,则评估其中直径最大的肿瘤。
1.2 方法
采用德国西门子公司S3000超声仪,配备可行剪切波弹性成像的9L4高频线阵探头,频率范围4~9 MHz。嘱患者充分暴露双侧乳房,上臂外展(与外科手术姿势一致)。由一名具有多年乳腺超声诊断经验且进行过剪切波弹性超声培训的主任医师完成超声检查。常规二维超声观察肿瘤位于乳腺的方位及层次、肿瘤的形态及生长方式、肿瘤的大小及纵横比、肿瘤的边缘及内部回声特点、肿瘤有无钙化及钙化的位置、肿瘤的后方回声特征、肿瘤的相关特征及彩色多普勒特征等。参照第五版乳腺BI- RADS分类标准进行分类。切换至VTIQ模式,取肿瘤最大切面,嘱患者屏住呼吸,探头垂直轻放在乳房上,探头与皮肤充分接触且不施压。当肿块区皮肤与水平面不平行时,嘱患者改变体位使其与水平面平行。启动剪切波,重复成像3次。感兴趣区应包含瘤体全部及周边部分正常腺体组织。待患者配合且二维剪切波图像稳定(即多次测量彩色编码高度一致)即可进行点式SWV测量。调整剪切波速度标尺,使肿瘤内部最硬处显示为暗红色,取样点放置在此处可显示出测量数据(即不能显示为“high”)。将点式剪切波测量点置于肿瘤内部颜色最深的9处,分别测量该9点的SWV。测量时应避开质控图显示为黄色或红色的区域,避开二维图像显示为粗大钙化的区域。
1.3 统计学处理
2 结 果
2.1 106例乳腺肿瘤的病理结果
106例乳腺肿瘤的病理结果见表1。
2.2 乳腺BI- RADS分类
本组乳腺肿瘤符合4a类及以上53个(无6类),符合3类53个。鉴于乳腺恶性肿瘤具有高度危害性,分类在4a类以上的肿瘤临床建议活检。因此本研究将分类为4 a类及以上归为恶性组,3类归为良性组,根据此分类诊断乳腺肿瘤的敏感性94.8%(37/39),特异性76.1%(51/67)。
2.3 VTIQ剪切波速度值
质控图质量良好时(图1),切换至速度模式测量肿瘤内部最高9点SWV。良性肿瘤(图2)内部最高9点SWV范围1.53~5.24 m·s-1,平均(3.66±0.32) m·s-1。恶性肿瘤(图3)内部最高9点SWV范围3.44~9.16 m·s-1,平均(6.00±0.61) m·s-1。恶性组最高9点SWV明显高于良性组,差异有统计学意义(t=8.870,P=0.000)。
表1106例乳腺肿瘤的病理结果

病理结果例数乳腺良性肿瘤67 纤维腺瘤46 肉芽肿性炎6 腺病6 导管内乳头状瘤4 良性叶状肿瘤2 错构瘤1 脂肪瘤1 纤维瘤病1乳腺恶性肿瘤39 浸润性导管癌30 黏液腺癌2 化生性癌2 导管原位癌2 髓样癌1 浸润性小叶癌1 实性乳头状癌1
2.4 ROC曲线分析结果
以SWV构建ROC曲线,AUC是0.919(图4),Youden’s index的最大值是0.73,对应的SWV是4.74 m·s-1,以该界值诊断乳腺实性肿瘤的敏感性82.1%(32/39),特异性91.0%(61/67),阳性预测值84.2%(32/38),阴性预测值89.7%(61/68)。
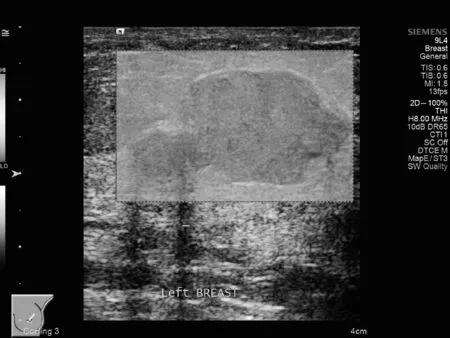
图1VTIQ质控图,肿瘤内部及周边呈均一颜色(绿色),表明剪切波质量良好且肿瘤内部信噪比高
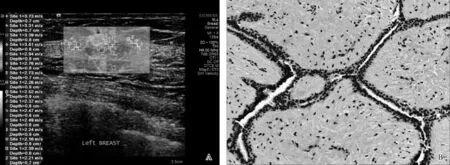
图2A.乳腺纤维腺瘤内部最高9点剪切波弹性成像,示肿瘤SWV低,且与周围正常乳腺组织剪切波差异小;B.与A为同一患者,病理常规HE染色图(×200)示腺体、导管及纤维组织增生
3 讨 论
弹性成像技术是根据组织间弹性系数的差异,以灰阶或彩色编码直观地反映被测物体的硬度[1]。从最初的手压式应变弹性到剪切波弹性,从单点剪切波到实时二维剪切波,其临床应用范围不断拓展。弹性成像在浅表器官尤其是乳腺疾病的鉴别诊断中得到广泛应用。第5版的乳腺BI- RADS分类首次将其引入。
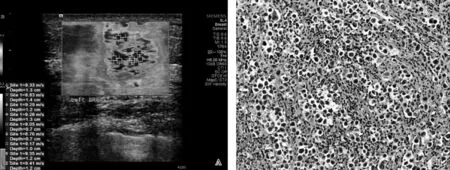
图3A.乳腺浸润性导管癌内部最高9点剪切波弹性成像,示肿块内SWV高,且与周围正常乳腺组织差异大;B.与A为同一患者,病理常规HE染色图(×200)示癌组织呈浸润性生长,癌细胞排列呈不规则巢团状及条索状,癌细胞核深染异型,周围纤维组织增生

图4以瘤体内部9点最高SWV鉴别诊断乳腺实性肿瘤的ROC曲线
VTIQ是最新的二维剪切波弹性成像技术。研究[2- 3]发现VTIQ检查在检查者内部和检查者之间有很好的可重复性,因此是一种可靠的弹性超声检查方法。
2015年发布的乳腺超声弹性成像指南[4]认为乳腺恶性肿瘤硬度高于周围正常乳腺组织,且早期就会出现该硬化改变。故使用弹性超声定量评估乳腺肿瘤的质地成为评估乳腺病变性质安全且有效的诊断方式。
本研究所有患者的常规二维超声和剪切波超声检查由一名主任医师独立完成。该医师经过剪切波弹性超声的培训且有多年乳腺弹性超声检查和诊断经验。剪切波图像质量稳定且与其他经过培训的医师图像一致性良好。测量SWV之前,先观察质控图,对于肿块质控图像质量不好的区域,经反复测量,排除呼吸或探头移动等人为因素外,认为可能是由于肿瘤内的成分不是良好的剪切波载体导致。研究发现,乳腺恶性肿瘤较良性肿瘤更容易出现剪切波质量不佳的情况,可能是由于恶性肿瘤内部成分复杂,噪声大,信噪比低,因而剪切波无法传播[5]。测量肿瘤内部的最高9点SWV时,应避开这些信噪比低的区域。
有学者研究提出鉴别诊断甲状腺实性结节以剪切波的均值为最佳指标[6],而剪切波对诊断乳腺肿瘤最有帮助的数值是肿物的最大硬度值[7],因此选取肿瘤内部最高的SWV更能反映肿瘤的真实硬度。9点SWV较其他学者随机的6点[8]或5~7点SWV[9]可以更准确反映恶性肿块内部的硬度特征,临床可操作性高,利于推广。
本研究发现,乳腺恶性肿瘤内部最高9点SWV明显高于乳腺良性肿瘤。与病理对照发现,恶性肿瘤内部癌巢聚集,间质内成纤维细胞和胶原纤维密集,部分肿瘤内可见多发的点状钙化或血管内癌栓,这些成分都直接导致肿瘤的硬度增加。因此肿瘤内部剪切波传播速度明显升高。本组67个乳腺良性肿瘤中,行VTIQ弹性成像后,有11个瘤体从4 a类降级为3类,故将VTIQ技术应用到乳腺BI- RADS分类系统中可以明显增加诊断的特异性,将其应用于4a类乳腺病变可以降低不必要的组织学活检或手术。
根据指南[4]的建议,剪切波的主要价值是将3类病灶升级或将4a类病灶降级,而不主张对4b类以上的病灶降级。因此本组良性病灶中,尽管有1例4c类和1例4b类病灶剪切波弹性成像显示为良性,仍建议手术或活检。
本研究还发现,不同病理类型乳腺癌其内部最大的9点SWV可能也不同。部分少见类型的乳腺癌,如化生性癌、乳头状癌等乳腺恶性肿瘤内部最大的9点SWV较常见的浸润性导管癌低。当乳腺恶性肿瘤内部伴有坏死时或呈髓样特征的浸润性导管癌质地也较软[10]。而良性病变中,肉芽肿性炎的SWV则明显高于其他类型的良性病变。由于样本量较小,乳腺恶性肿瘤之间的SWV差异及其与肉芽肿性乳腺炎的SWV的差异有待增加样本量进一步研究。本研究恶性组中的3例三阴性乳腺癌肿瘤内部的SWV均高于界值,对于常规超声声像图不典型的乳腺肿瘤行剪切波弹性成像有可能提高三阴性乳腺癌的检出率。由于本研究组三阴性乳腺癌病例数较少,其剪切波弹性特征及与病理成分的相关性还有待后续增加样本量后研究。
总之,以肿瘤内部9点最大剪切波速度代表瘤体的最大硬度时,乳腺癌的最大硬度明显高于乳腺良性肿瘤。VTIQ技术诊断乳腺恶性肿瘤有较高的特异性,将该技术应用于乳腺BI- RADS分类系统中,可改良肿瘤的分类,从而避免不必要的外科干预。

