淫羊藿苷对SCID小鼠前列腺癌原位移植瘤雄激素受体信号通路的影响
陈德森,胡熙耀,陈少秀,吴胜英*
(1.湖北医药学院基础医学院, 十堰 442000; 2.十堰市太和医院(湖北医药学院附属医院), 十堰 442000)
前列腺癌(prostatic cancer, CaP)指发生在前列腺的上皮性恶性肿瘤,中老年男性是高危人群,在肿瘤发病率及死亡率中仅次于肺癌,占癌症死亡的第二位,严重危害男性生命健康[1]。雄激素受体(androgen receptor,AR) 在雄性激素的代谢和发挥作用时起到重要作用,从生理角度来看,AR与雄性激素结合后可调控前列腺上皮细胞的生长、增殖和分泌,在前列腺癌的发生发展中,AR发生磷酸化反应是AR激活的重要途径,因此,可以认为AR过表达是促进前列腺癌发生发展的重要环节[2]。张力蛋白同源第10号染色体缺失的磷酸酶基因(phosphatase and tensin homolog deleted on chromosome ten,PTEN) 属抑癌基因,PTEN基因缺失和AR过度表达都能引发前列腺癌的肿瘤细胞无限生长,且有研究表明,前列腺癌患者PTEN基因突变率显著高于正常人[3-4]。目前,临床上应用最广泛的前列腺肿瘤标志物为前列腺癌特异性抗原(Prostate specific antigen,PSA),是前列腺癌诊断、鉴别诊断及疗效监测的重要参考指标[5]。在对前列腺癌原位移植瘤的研究中发现淫羊藿苷具有抑制前列腺癌细胞株的生长、迁移和侵袭的生物学活性[6-7]。但这一成果是针对细胞培养,而对在体动物方面鲜有报导,本实验采用灌胃给药的方法,研究淫羊藿苷对SCID小鼠前列腺癌原位移植瘤雄激素受体信号通路的影响。
1 材料和方法
1.1 实验动物
清洁级雄性SCID小鼠 64只,5~6周龄,体质量20.0~21.5 g,小鼠由湖北医药学院附属十堰市太和医院研究所提供[SCXK(鄂)2017-0031],在十堰市太和医院研究所清洁级动物房内饲养[SYXK(鄂)2017-0031]。福利伦理审查证号:湖北医药学院动(福)第2018-1号。自然光照、恒温20℃~22℃、恒湿60%~70%,自由饮用纯净水,喂养食料高压灭菌处理。
1.2 主要试剂和仪器
淫羊藿苷(北京索莱宝科技有限公司,批号:0170203);乙醚(广州钱盛化工有限公司,批号:20161124);人 LNCaP前列腺癌细胞株(上海酶研生物科技有限公司,批号:0712633-012);PTEN、AR 检测用RT-PCR试剂盒(南京森贝伽生物科技有限公司,批号:0161024,0161029);EDTA和RPMI-1640 细胞培养基(上海冠导生物工程有限公司,批号:);胎牛血清(FBS)(赛默飞公司,批号:0161203)。
1.3 实验方法
1.3.1 癌细胞复苏及培养
将在液氮罐中冻存的人 LNCaP前列腺癌细胞株取出,37℃速融,然后倒入RPMI-1640培养液中复苏24 h(培养箱通5%CO2、37℃怛温),每天换RPMI-1640培养液一次,培养3 d。再用EDTA消化(0.25%)后收集足够的人LNCaP前列腺癌细胞株,用RPMI-1640培养液调制成每毫升2×107个人LNCaP前列腺癌细胞的悬液,放入冰箱冻存备用。
1.3.2 动物模型制备及成模标准
模型参考文献方法[8],采用乙醚吸入的方法麻醉小鼠,固定,于下腹部正中切开皮肤、分离腹膜,暴露膀胱,将小鼠膀胱向尾端翻转,暴露生殖腺并用棉签推向左右腹壁,找到膀胱颈处的左右 2 叶(叶状肉红色组织)前列腺腺体。将备用的人 LNCaP前列腺癌细胞株用微量注射器抽取50 μL注射于左右 2 叶前列腺腺体的背外侧包膜内(两叶各25 μL)。注射后恢复脏器解剖位置,缝合创口,消毒,待小鼠清醒后放入隔离器内观察(单笼饲养)。成模标准:本实验在开展前的预实验中,实验人员采用以上方法,将10只小鼠前列腺注射人 LNCaP前列腺癌细胞株,发现全部小鼠的前列腺均有移植瘤生长,并广泛地浸润到膀胱、精囊等组织,形成固定的实质性肿瘤包块。其中100%(10/10)有盆腔淋巴结转移,80%出现(8/10)肺转移,40%(4/10)出现肝脏转移,30%(3/10)出现脾转移、20%(2/10)出现腹膜后淋巴结转移,这一结果与多数文献相符。在正式实验中,处死的动物均与上述预实验一致,全部建模的64只小鼠在摘取前列腺时均有本移植瘤生长并有广泛的转移,成瘤率达100%。
1.3.3 实验动物分组
注射2周后将上述建模的64只小鼠编号,采用随机数字表随机均分为模型组、实验A组、B组和C组。
1.3.4 治疗方法
实验A组、B组和C组于建模2周后分别按10 mg/kg、40 mg/kg和80 mg/kg剂量灌胃给予淫羊藿苷,模型组给予生理盐水对照。四组均于早晚各灌胃给予淫羊藿苷或生理盐水各一次,连续治疗 5周。
1.3.5 检测指标和方法
四组于治疗前和治疗结束时各取8只小鼠,脱臼法处死,摘取前列腺,剥离前列腺瘤体背外侧叶包膜,吸干、称重、编号,分别测量长、短径各3次,取3次的平均值为最终结果。肿瘤抑制率计算方法参照文献[9]:实验组肿瘤抑制率=(C-T)÷C×100%,其中T=实验组平均瘤重;C=模型组平均瘤重。细胞周期采用流式细胞学方法检测。取瘤组织剪碎,加入裂解液中冲打混匀,待其充分裂解后提取总RNA。采用RT-PCR检测雄激素受体和张力蛋白同源第10号染色体缺失的磷酸酶基因表达,检测时以β-ACTIN为内参,采用Bio-Rad荧光实时定量PCR仪进行反应并计算其相对表达量。采用Western blotting检测前列腺癌特异性抗原(Prostate specific antigen,PSA)和磷酸化AR(p-AR)相对表达量(灰度值),采用Quantity One软件分析其灰度值[10]。
1.4 统计学方法
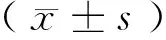
2 结果
2.1 各组治疗前后p-AR和PSA 相对表达量比较
模型组治疗前后AR、p-AR组内治疗前后比较差异无显著性(P>0.05)。实验A组组内治疗前后比较差异无显著性(P>0.05)。而实验B组、C组治疗后p-AR和 PSA低表达,与模型组和治疗前比较差异有显著性(P<0.05)。(图1)
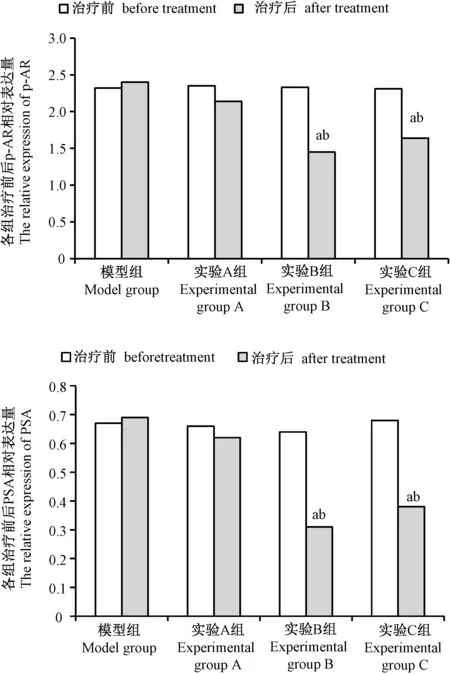
注:与治疗前比较,aP <0.05;与模型组比较,bP <0.05。
2.2 各组治疗前后AR mRNA、PTEN mRNA蛋白相对表达量比较
模型组治疗前后AR mRNA高表达,PTEN mRNA低表达,组内治疗前后比较差异无显著性(P>0.05)。实验A组组内治疗前后比较差异无显著性(P> 0.05)。而实验B组、C组治疗后PTEN mRNA高表达,AR mRNA低表达,与模型组和治疗前比较差异有显著性(P< 0.05)。

注:与治疗前比较,aP <0.05;与模型组比较,bP <0.05。
2.3 淫羊藿苷对各组细胞周期的影响
流式细胞学方法检测显示, 模型组G0/G1比值较高,而S期较低,且治疗前组间比较差异无显著性(P> 0.05),说明LNCaP前列腺癌细胞在G0/G1和S无序增殖,造模成功。治疗后,实验A组与模型组及组内治疗前比较差异无显著性(P> 0.05)。实验B组、C组治疗后前列腺癌LNCaP细胞阻滞于S期,其G0/G1比值明显降低,S期明显提高,与模型组和治疗前比较差异有显著性(P< 0.05)。(图3)
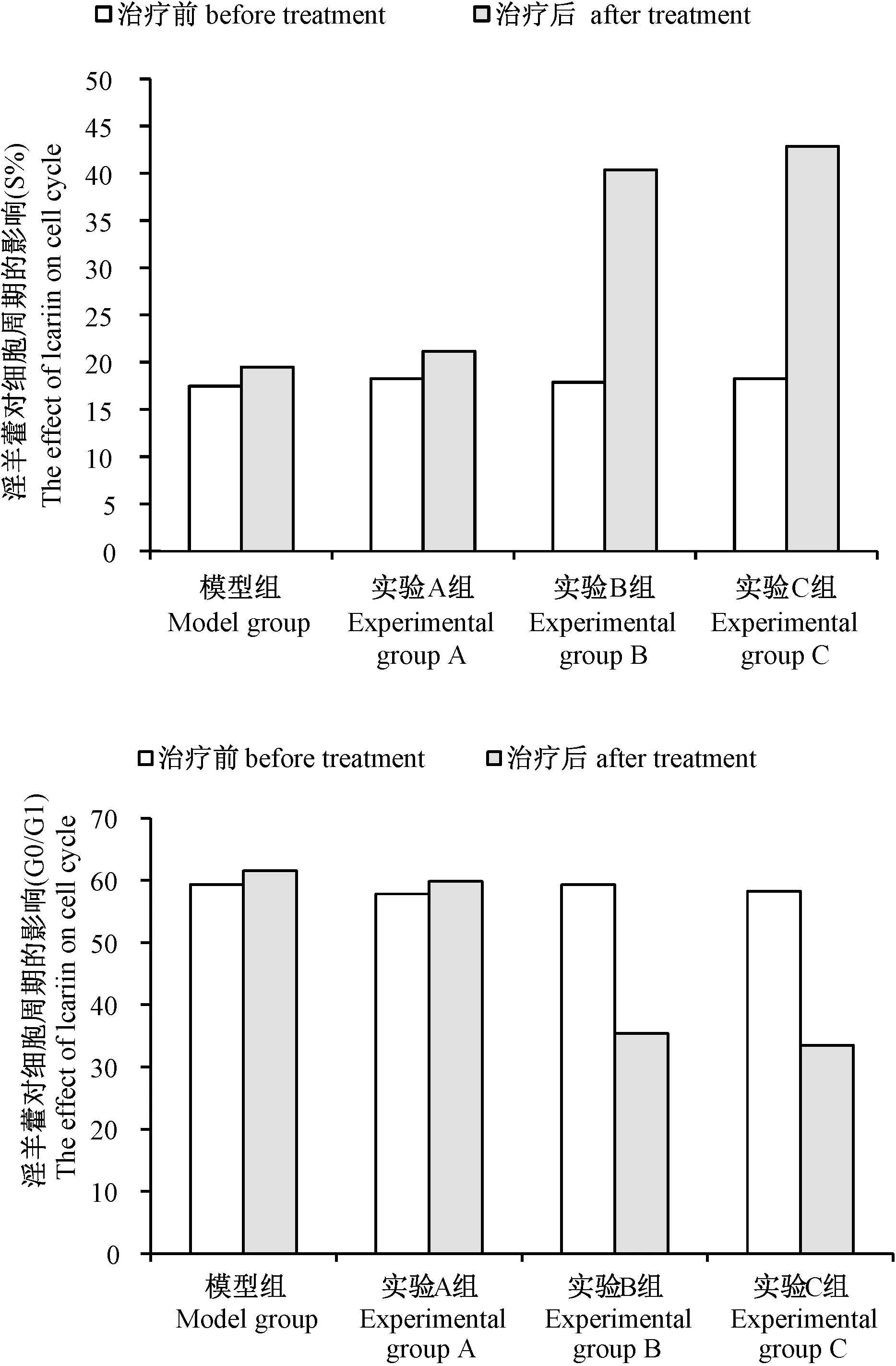
注:与治疗前比较,aP <0.05;与模型组比较,bP <0.05。
2.4 各组治疗前后肿瘤细胞生长情况比较
四组治疗前均有肿瘤生长,且治疗前组间比较差异无显著性(P> 0.05),说明造模成功。模型组抑瘤率较低,瘤质量和瘤体积组内治疗前后比较无显著性(P> 0.05)。治疗后,实验A组与模型组及组内治疗前比较无显著性(P>0.05)。实验B组、C组治疗后瘤质量和瘤体积降低,抑瘤率提高,与模型组和治疗前比较差异有显著性(P<0.05)。(表1)

表1 各组治疗前后肿瘤细胞生长情况比较
注:与治疗前比较,aP<0.05;与模型组比较,bP<0.05。Note. Compared with before treatment,aP<0.05; Compared with model group,bP<0.05.
3 讨论
淫羊藿(Epimedium brevicornu,Maxim)属小檗科淫羊藿属植物,又称仙灵脾。淫羊藿味辛、甘,性温,归肝、肾经。具有祛风除湿、强健筋骨、补肾壮阳之功效。主治遗精早泄、肾虚阳痿、筋骨挛急、肾虚喘咳、腰膝酸软、麻木拘挛、风湿痹痛、四肢不仁、半身不遂、小淋沥、喘咳及更年期高血压等[11-12]。淫羊藿苷是从淫羊藿的全草中提取的黄酮类生物碱,现代药理学研究证实其具有抗动脉粥样硬化、抗肿瘤、调节免疫力、促进成骨细胞生长及抑制破骨细胞活性等药理作用[13-14]。在中药治疗前列腺癌方面的研究中,动物实验发现淫羊藿素有雌激索样恬性,可以抑制LNCaP细胞前列腺癌特异性抗原的转录并促进LNCaP细胞AR降解而发挥抑癌作用[15-16]。
研究表明,细胞S期和G0/G1与肿瘤增殖密切相关, S期和G0/G1周期紊乱是导致细胞分化、生长和凋亡失控的主因,可导致细胞无限制性分化、增殖、恶化和转移[17]。由于恶性肿瘤生长的最基本生物学特征是肿瘤细胞失控性增殖(即细胞周期调控紊乱),故在治疗恶性肿瘤时应将失控性增殖的肿瘤细胞阻滞在细胞S期和G0/G1、G2/M期[18]。AR为核内转录因子,属性激素受体,与雄激素结合后激活下游靶基因,保持前列腺干祖细胞的正常分化[19]。研究表明,大多数恶性肿瘤的发生及发展均存在组蛋白乙酰化现象,正常前列腺干祖细胞内AR的低表达,而低表达的AR可维持干祖细胞的干细胞特性并抑制该细胞的分化,AR在组蛋白乙酰化转移酶(Tip60)及雄激素的刺激可诱导其乙酰化而增强其转录活性,促进AR的核转移从而导致前列腺癌细胞增殖增强[20]。PTEN是继p53后发现的较强的肿瘤抑制基因,具有磷酸化酶活性,与AR表达存在明显的相关性,可通过阻止AR乙酰化而降低AR活性,从而发挥抑制列腺癌细胞生长、调控细胞周期和转移的作用[21]。
在本研究中,模型组治疗前后AR、p-AR、AR mRNA均高表达,PTEN mRNA低表达,说明采用人LNCaP前列腺癌细胞株悬液前列腺内注射的方法建立前列腺癌原位移植瘤模型后,AR发生乙酰化现象,低表达的PTEN mRNA不能阻止AR乙酰化,LNCaP前列腺癌细胞在前列腺处于无序增殖。另外,模型组抑瘤率较低,瘤质量和瘤体积组内治疗前后比较无显著性。流式细胞学方法检测显示模型组G0/G1比值较高,而S期较低,且治疗前组间比较无显著性,说明LNCaP前列腺癌细胞在G0/G1和S无序增殖,提示造模成功。而实验B组、C组治疗后抑瘤率达(42.53±5.72,44.81±4.76)%,两组AR mRNA、p-AR和 PSA低表达,PTEN mRNA高表达,且G0/G1期细胞比例降低、S期细胞比值升高,肿瘤细胞增殖被阻滞于S期,与治疗前和模型组比较,差异有显著性。这一结果与前面的研究结果一致。笔者分析认为,淫羊藿苷可能通过抑制AR乙酰化,提高PTEN合成而降低AR活性,从而发挥抑制列腺癌细胞生长、调控细胞周期和转移效应。因此,实验B组、C组治疗后,p-AR和 PSA低表达,说明治疗有效。实验B组、C组治疗后G0/G1期细胞比例降低、S期细胞比值升高,提示肿瘤细胞增殖可能被阻滞于S期。
综上所述,淫羊藿苷可明显抑制LNCaP前列腺癌原位移植瘤的生长。众所周知,前列腺癌具有雄性激素依赖性,而AR的乙酰化是可逆的过程,推测淫羊藿苷可能通过调节雄激素受体信号通路来实现肿瘤生长抑制,在这个过程中,淫羊藿苷首先逆转AR乙酰化,使AR去乙酰化并降低其活性,进一步减少与雄性激素结合,降低前列腺癌细胞生长必需的激素基础,同时提高抑癌基因PTEN,高水平的PTEN 可增强磷酸化酶活性而发挥抑制肿瘤发生的作用。本实验结果表明,淫羊藿苷可使失控性增殖的肿瘤细胞阻滞在S期,这为淫羊藿苷应用于临床治疗前列腺癌提供了理论参考。

