空间植物栽培关键技术地面验证试验研究
沈韫赜,郭双生,赵丕盛,王隆基,李 健,王晓霞
(中国航天员科研训练中心,北京100094)
1 引言
受控生态生保系统(Controlled Ecological Life Support Systen,CELSS)是载人航天长期驻留任务的必然途径。该系统能够实现氧气、水和食物的自给自足。高等植物能够利用光能将二氧化碳和水合成为有机物,并产生氧气,同时通过蒸腾作用实现水的净化,可以保障人在太空中对环境和食品的需求,是受控生态生保系统中的关键生物部件[1-3]。
空间植物栽培技术研究已有40余年的发展历程,已进行多种植物的空间栽培试验,重点研究微重力对植物生长发育的影响。1975年前苏联就开始了空间植物栽培的探索,他们尝试在飞船中栽种小麦、洋葱等植物[4]。20世纪90年代,俄罗斯和保加利亚联合研制了SVET空间温室,在和平号空间站进行了长期搭载,并在其中完成了小麦“从种子到种子”的三代完整生长周期培养[5]。2002年,俄罗斯针对国际空间站研制了一款名为LADA的空间温室,至今已进行了二十多次空间植物栽培实验,成功培育了小麦、生菜等植物。近期俄罗斯研制了新一代LADA空间温室,拟用于多种植物的空间栽培[6-7]。2014年,NASA将Veggie空间蔬菜生产系统运送到空间站,并进行了 Veg-01试验[8]。2015年,经过 33天的培养,三名航天员在空间站收获并品尝了第二批种植的蔬菜——红色长叶莴苣。2015年 11月,NASA在轨道实验室进行了百日菊培养试验,并进行了天地对比[9]。在太空中,百日菊完成了开花过程,并于2016年2月进行了收获[10-11]。
空间微重力下水分传导特性与地面有很大不同。在微重力条件下,流体行为发生根本变化,植物周围形成边界层,导致植物与周围物质交换变得困难。同时,在微重力条件下实现栽培基质水分养分的充分供应,同时保证栽培基质的通气也具有挑战性。在空间微重力下进行植物光合、蒸腾和呼吸作用效率的测定与评价也具有较大难度。因此,微重力下的水分养分控制技术是空间植物栽培的关键。太空舱内环境与地球环境有很大不同,如微重力、低压、低氧、高二氧化碳等,同时,航天任务中植物栽培面临功耗、体积、重量等严格限制。CELSS空间植物栽培需要满足两个要求:一是空间利用率高,在有限空间中产生尽可能多的氧气和食物;二是高效节能,尽可能地提高能源利用率。因此作物种类的选择具有关键意义。生菜是前期CELSS研究的重点作物,具有产氧能力强,可食生物量比例高等优点。光照是植物的能量来源,也是能耗的主要构成,因此空间植物栽培的能耗限制,主要是对光照系统的限制。
本文在空间实验室任务中搭载一台植物栽培装置,为空间实验室植物栽培关键技术验证试验任务的前期地面验证试验,旨在对空间微重力下植物栽培的关键技术进行模拟和验证。试验采用的红蓝LED光照技术为前期试验中较为成熟的光照技术,经过长时间验证,具有能效高、适合植物生长等优点[12-13]。
2 材料与方法
2.1 供试植物
供试植物为大速生生菜(Lactuca sativa L cv.Dasusheng),该生菜品种具有生长速度快、生长周期短、抗逆性强等特点,适合用作空间植物栽培。
种子丸粒化处理情况:通过特殊材料对种子进行包被,使种子成为5 mm直径的规则颗粒,方便播种。包被材料透气透水,有利于种子发芽。
2.2 装置、材料和方法
试验平台为受控生态生保系统集成试验平台,该平台的功能是对空间植物栽培的实际环境进行模拟,为地面验证试验提供接近空间的试验条件[13]。
试验材料为空间植物栽培装置,结构包括栽培盒、生长区、LED灯板,栽培盒基质水分测量仪和大气CO2浓度测量仪等结构单元,采用模块化设计,可方便在轨拼装或拆卸。其结构外形如图1所示。
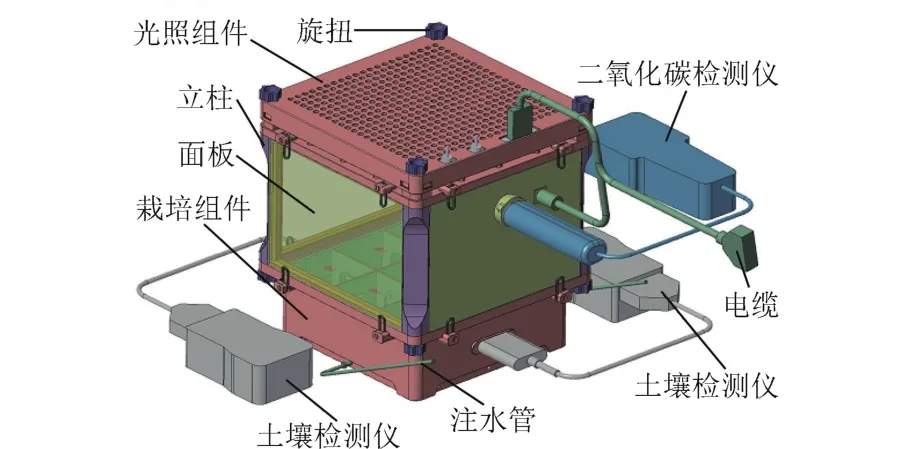
图1 空间植物栽培装置结构图Fig.1 Structure of space plant growth facility
空间植物栽培装置的主要性能指标和结构如下:
外形尺寸:L268 mm×W268 mm×H306 mm;
重量:TGM 990空间植物栽培装置3.4±0.2 kg,TGM 992空间植物栽培装置Ⅱ≯2.7 kg;
功耗:≯17 W;
栽培面积:0.0441 m2(L210 mm ×W210 mm);
植株栽培数量:共9株;
栽培盒内部结构:内部包括9个方格,方格之间连通,可实现栽培基质之间的水分和养分传导;栽培基质为蛭石,用棉质纱布进行分装(共9块,为大小相同并紧密接触的长方体形状,以便于基质采样);栽培盒底部具有供水管路系统,通过软管与饮水袋或注射器可紧密连接,以进行水分加注供应;
养分来源及供应方式:养分为一定量的特制缓释肥颗粒,在栽培基质方块中下部均匀铺层分布;
种子发芽凸台:位于栽培基质方块上部(每个方块上面1个),并与之紧密相连,确保其能够从下面的栽培基质获得足量水分。在每个凸台上设计了三种种子发芽结构(以验证发芽结构设计的可行性);
生长区:高度20 cm;四周围可开放也可封闭;背板中上部安装一台微型风扇,在其正上方具有密封安装孔,用于插装红外CO2分析仪探头;
植物光源:红、蓝、绿LED光源,位于生长区顶部隔板的正上方;光质:≈80%红+≈10%蓝+≈10%绿,光强92 μmol·m-2·s-1(距灯板20 cm正下方处平均值),光周期0~24 h人工开关电源控制;
测量仪器:包括位于栽培盒两侧、用于测量基质含水量和电导率的两台手持式土壤水分测量仪;一台用于测量生长区大气CO2浓度的手持式红外CO2分析仪;
环境控制能力:依靠实验舱环控系统对其进行大气环境条件调控。
由于受到太空舱内功耗、体积、重量等限制,植物栽培装置难以在栽培条件上达到植物需求的最佳状态,如光强偏弱等。地面验证试验为了对在轨试验做出最大程度的验证,在条件设计上也遵循了这一系列限制。
2.3 试验方法与流程
2.3.1 环境参数控制
试验环境条件控制如表1所示。
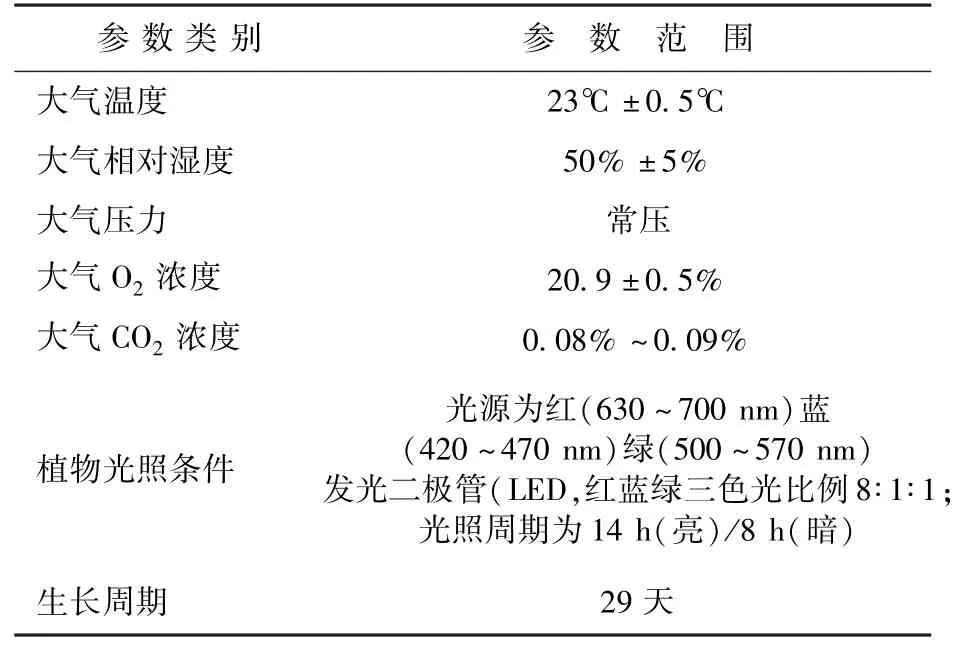
表1 环境参数Table 1 Environmental parameters
2.3.2 试验设计
试验共进行8批次,各自处理的具体培养条件如表2所示。
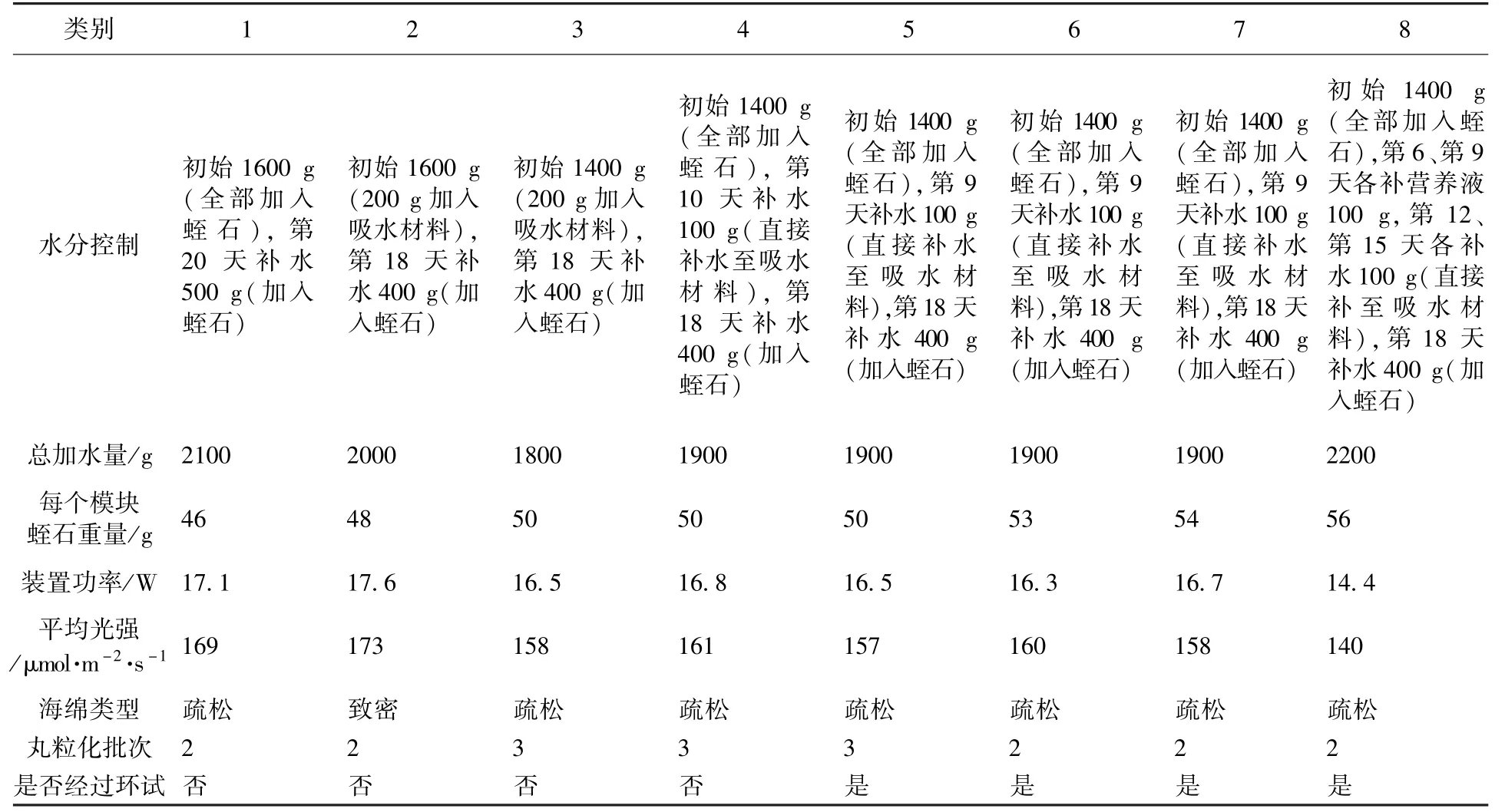
表2 试验设计Table 2 Design of experiment
2.3.3 试验流程
1)装置及工具消毒
装置组装前需进行消毒。其中,装置外壳及上盖板用75%酒精擦拭消毒;吸水材料采用紫外照射消毒;蛭石采用120℃、150 kPa高温高压消毒20 min并烘干;镊子、饮水袋和注射器用吸水纸包裹放入高温高压灭菌锅中,在120℃、150 kPa下消毒20 min。
2)播种
首先在吸水材料的缝隙中放入消毒种子,每个吸水材料块播5粒,播撒均匀,避免种子挤在一起;然后在海绵塞与吸水材料之间缝隙中放入消毒种子,每个吸水材料块播5粒;然后将丸粒化种子塞入预留的孔洞中,播种完毕盖好上盖板。
3)注水
试验开始时及试验过程中定期注水。注水方法为:用注射器将纯净水加入饮水袋内,将饮水袋的软管插入注水孔,挤压注水。第一次注水量均为蛭石体积的1/2加吸水材料重量的6倍。
4)发芽
第一次注水完毕后,拔出饮水袋软管,在上盖板上方盖一层保鲜膜,等待发芽。预计4~5天后可发芽。等待发芽期间,每天固定时间读取并记录一次含水率及电导率。
5)光照
发芽后,开始对植株进行14 h光周期的光照(8:00—22:00)。
6)间苗
发芽后,将保鲜膜取下。播种后第7天用剪刀进行第一次间苗,每个种子孔保留2株苗,间苗原则为保留长势最好的,且2株苗间隔至少1 cm。植株长出第三片叶时,第二次间苗,只留1株,保留长势最好的,2株苗长势相当的情况下,保留靠近吸水材料块中央的。
7)水分与养分监控和管理
每天固定时间通过土壤多参数分析仪读取栽培基质的含水率和电导率并记录,同时每天称量装置总重,确定失水量。根据含水率变化和装置总重确定补水时间和补水量,当含水率达到控制下限时,进行补水至含水率重新回到上限。若含水率读数和装置称重结果不吻合,则在地基试验中按称重结果控制加水,以形成补水预案,以防在天基试验中仪器读数无效。
苗期日常管理的主要内容主要包括栽培基质的水分、养分监控、对植株生长状况的观察记录和对病虫害的观察记录等。
8)植株生长发育状况观察
每天固定时间观察记录植株生长发育状况,包括株高、叶片数等,同时记录植株发育过程中的重要事件,如出苗、植株进入三叶期及其它可能的状况(叶片枯黄、叶尖枯萎、叶脉变黄、植株萎蔫、植株倾斜等)。如果出现了植株生长异常或病虫害等现象,首先根据出现的症状进行分析判断,找出原因并加以补救,如果难以判断,则取样保存,并请专家现场诊断病因。
试验期间,每天从固定位置对装置和植株进行拍照,作为后期分析和天地对比的依据。
9)光合作用测试
第18、21、24和27天时,进行光合作用产O2和CO2净化能力测试,维持试验环境CO2浓度为0.3%左右,将前、左、右3块挡板安装到位,启动循环风扇工作,启动便携式CO2测试仪读取初始浓度并记录数值,计时1 h后再读取生长区内CO2浓度并记录数值,取下前、左、右3块挡板,关闭循环风扇,继续后续试验,每天测量一次,根据数值推算光和作用效能。
10)植株及栽培基质采样分析
第29天时,对植株及栽培基质进行采样分析。采样工作需佩戴乳胶手套进行。
徒手将植株在发芽结构以上的茎叶部分折断,9株植物分别称取茎叶鲜重,装密封袋保存,并进行营养成分分析。
栽培基质取样时,将上盖板取下,用塑料标尺将9个模块之间连接的根系切断,徒手取出栽培基质装密封袋,用于植株根系生长发育状况和基质水分养分状况的分析。
3 结果与分析
3.1 各批次发芽情况
各批次发芽率具体如表3所示。对比各批次发芽率发现,切缝播种发芽率始终较稳定,各批次均高于70%。第2批海绵播种发芽率较低,其原因与海绵类型有关,分析认为,致密的海绵影响了其透气性,不利于发芽,因此在之后批次中换回了疏松海绵。
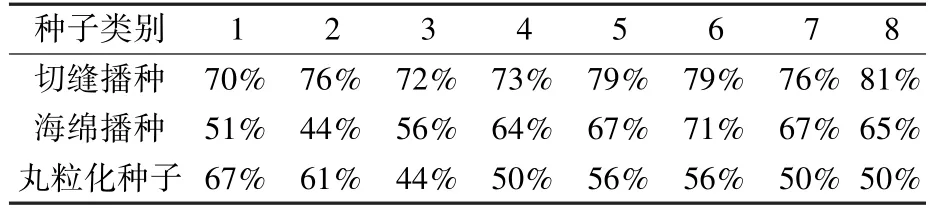
表3 各批次发芽率对比Table 3 Comparison of germination rate
丸粒化种子共生产3个批次,其中第1、2、6、7、8批蛭石培养试验采用第2批丸粒化种子,4、5、6批蛭石培养试验采用第3批丸粒化种子。在丸粒化种子发芽率测试中,发现第2批丸粒化种子发芽率明显高于第3批,但在实际应用中,8个批次间丸粒化种子发芽率呈现较大的随机性。
3.2 水分养分控制情况
各批次基质含水率及电导率结果如图2所示。
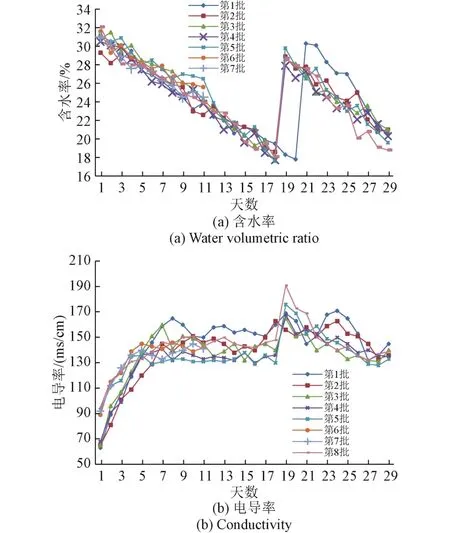
图2 各批次基质含水率和电导率曲线Fig.2 The curve of water volumetric ratio and conductivity
从含水率来看,各批次含水率变化趋势基本一致,从变化趋势可以看出:第18天补水400 mL(第1批为第20天)可使得基质含水率回升至28%以上,满足植株进入快速生长期后对水分需求的增加;在吸水材料上补水对基质含水率无明显提升,可见补水100 mL对吸水材料来说仅能保证其潮湿和柔软,基质从吸水材料获取的水分较少。第1批初始加水量和补水量均高于后4批,但在含水率曲线中并未发现明显差异,其原因可能与蛭石的压实程度有关,第1批蛭石装填过程中未用力压实。根据之前对蛭石特性的研究,蛭石压得越紧实,在同样加水量情况下其含水率数值越高。
从电导率来看,变化趋势差异主要在于第1、2、3、4 批和第 5、6、7、8 批之间;后 4 批初始电导率明显高于前4批,第6天后二者逐渐趋于一致;后4批在补水后电导率上升幅度也明显高于前4批;分析其原因,环试可能是主要因素。后4批经过环试,缓释肥包衣受到一定程度的磨损,加速了其养分释放过程。
第8批增加了补充营养液的操作。营养液电导率为230 ms/cm,理论上将营养液加入装置会使得基质电导率增加。从曲线看,第6、第9天在吸水材料上补充100 mL营养液并未明显增加基质电导率,第18天补充200 mL水和200 mL营养液后,电导率增幅大于补充400 mL水的电导率增幅。说明在吸水材料上补充100 mL营养液,营养液大部分保留在吸水材料中,未进入基质。
另外,在栽培过程中,发现吸水材料表面干的现象,各批次之间吸水材料状态差异较大,从湿到干的天数也有所差异,总体来看,吸水材料从湿润状态至变干,大约需3~5天。第8批通过每3天在吸水材料上补100 mL水(或营养液),可明显缓解这一现象。
3.3 植株生长状况
生长期内各批次平均株高和叶片数变化如图3所示。具体株高叶片数数据如表4所示。
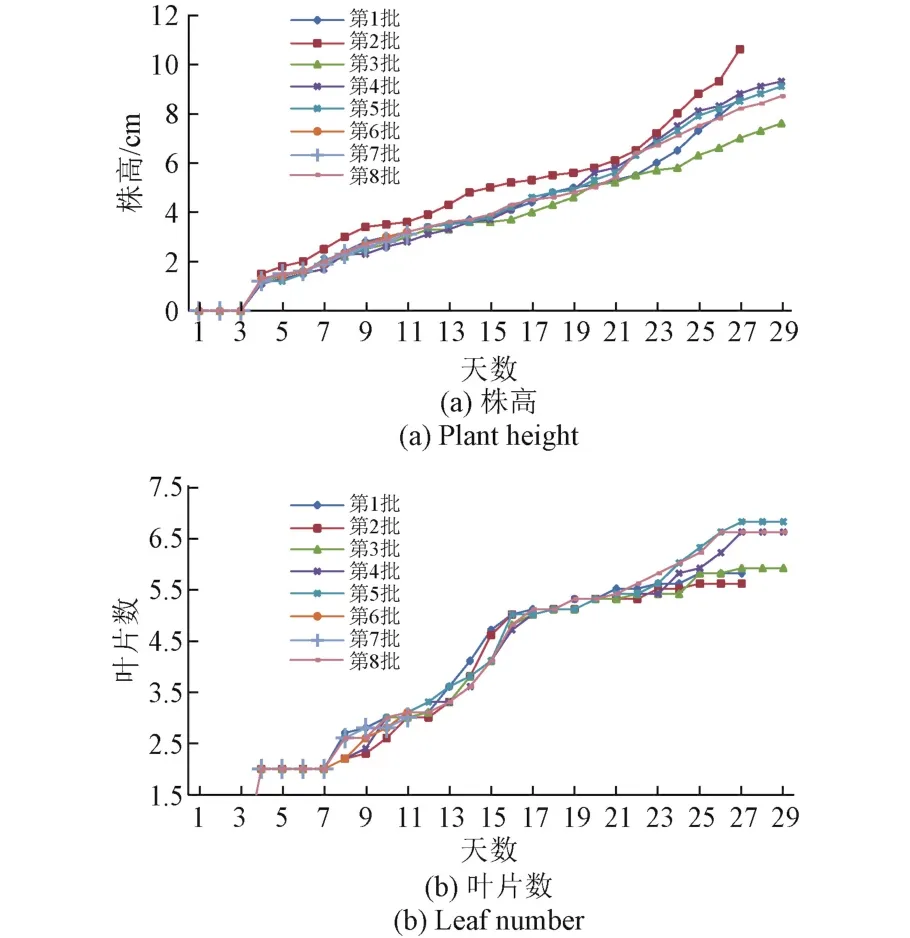
图3 各批次株高和叶片数变化曲线Fig.3 The curve of plant height and leaf number
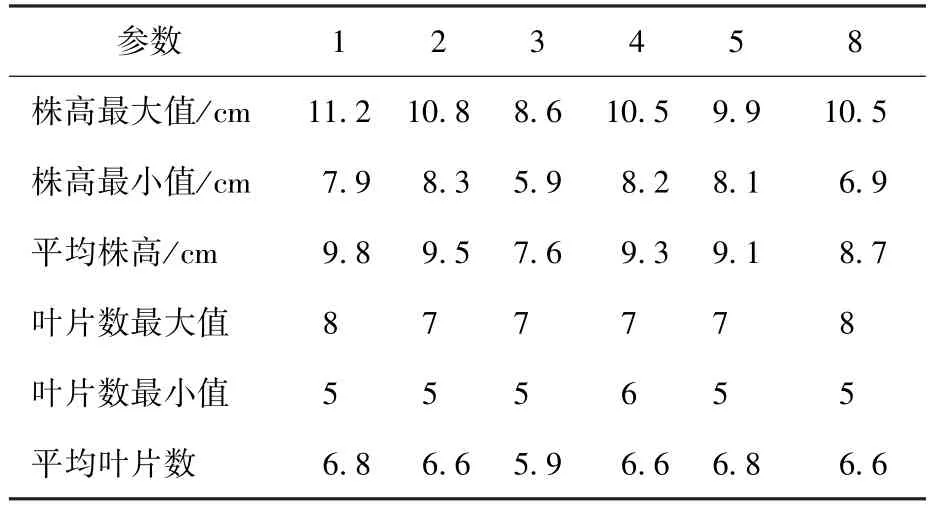
表4 各批次收获时株高叶片数统计Table 4 Plant height and leaf number at the time of harvest
从图3中可以看出,各批次平均株高和叶片数变化趋势基本一致,但第3批平均株高和叶片数显著低于其余几批。从表4中可以看出,第3批总加水量为各批次最少,因此初步判断其长势弱于其他批次的原因分别为水分供应不足和光照不足。其中,第3批与第4批除水分控制条件不同外,其余条件均相当,因此单独比较这两批。其主要差异为:
1)初次加水,第3批1400 g水中有200 g是直接加在吸水材料表面,而第4批全部加入蛭石。
2)第4批在第10天时向吸水材料表面补水100 g,第3批无此操作。
3)初次加水时,往吸水材料表面加200 g水主要是为了使吸水材料迅速湿润变软,缩短摘取吸水材料盖所需等待的时间。而第4批虽然未在吸水材料表面加水,但通过蛭石与吸水材料间的导水作用,其吸水材料最终的含水状态与第3批无明显差异,因此对植株生长状况不会产生显著影响。
4)第10天时,吸水材料表面已经处于完全干燥的状态,吸水材料变硬,此时正是植株加速生长的关键期,吸水材料变硬抑制了茎的变粗,影响根部与叶片间的水分养分传导。第4批通过在吸水材料表面补水100 g,使得吸水材料表面湿润变软,一定程度上缓解了这一不利条件。
因此,分析认为,造成第3批株高和叶片数低于其余几批的原因可能与缺水导致的吸水材料变干有关,而在表面补水可有效缓解这一现象。
3.4 植株营养成分
第2批茎叶部分采收后,营养成分测试结果如表5所示。
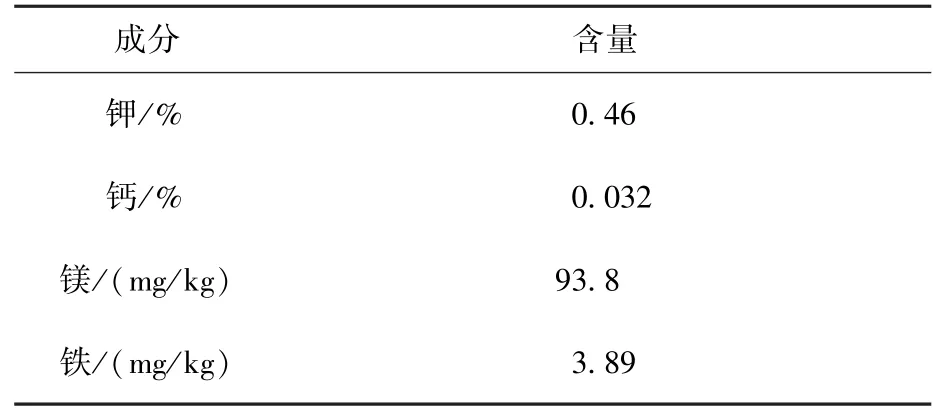
表5 植株营养品质测试结果Table 5 Nutrition quality of plant
3.5 光合作用测试结果
各批次光合作用测试结果如表6所示。从表中可以看出,各批次光合作用强度均随着生长天数而递增;光合作用强度与株高、叶片数呈现明显的正相关性。第4批长势较弱,光合作用强度也明显低于其余批次;光合作用强度与灯板光强呈现明显的正相关性。
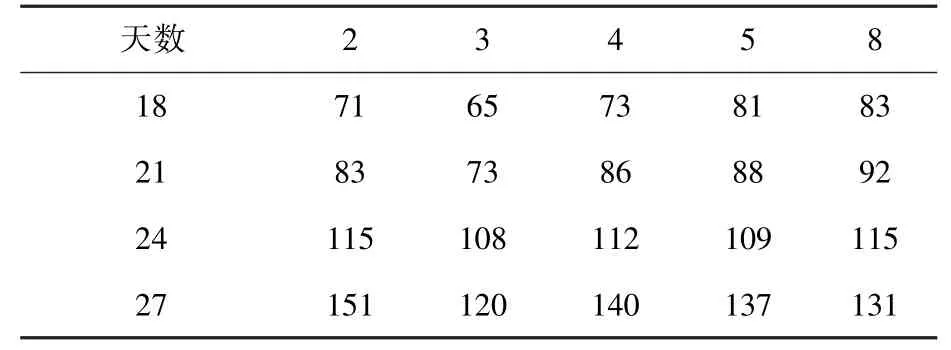
表6 光合作用测试CO2浓度下降值Table 6 Decreased value of CO2concentration during the photosynthesis measurement /ppm
3.6 根系生长情况
各批次收获后均对根系生长分布状况进行了解剖观察分析,发现根系生长呈如下特点:各批次根系生长发育均偏弱,侧根较少,根系分布空间不到基质总空间的1/3;根系呈乳白色,颜色正常,无烂根现象;第8批相比于第1~5批根系分布较少。植株根系生长状况直接关系到营养和水分的获取,对于植株生长发育至关重要。影响根系生长发育的因素有温度、基质水分养分分布、基质质地、氧气含量等。当前的培养条件下,温度对于根系生长是适宜的;从根系颜色看,水分养分含量对于根系生长也是适宜状态。
分别对第2~5批和第8批的根系总长度进行了测量统计,结果如表7所示(第3、4批均有1株死亡,只统计8株数据)。
初步分析根系生长发育不良与蛭石压实程度有关。每个模块装入的蛭石越多,则蛭石质地越紧密,氧含量越少,不利于根系生长。
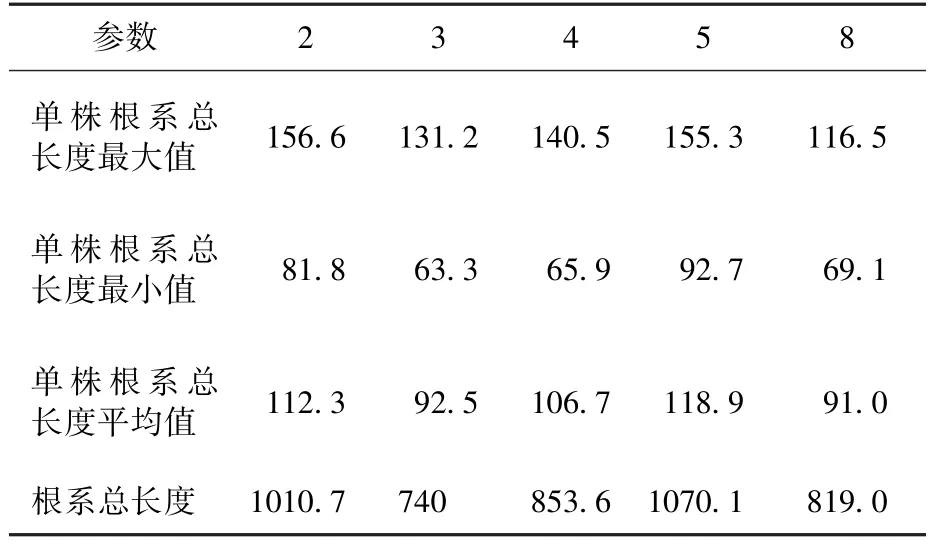
表7 根系总长度Table 7 Total length of root system /cm
4 结论
1)发芽结构同时采用切缝、海绵和丸粒化3种结构,经验证,3种发芽结构均能有效发芽,发芽率从高到低顺序依次为切缝播种、海绵播种和丸粒化种子,三种结构发芽率分别可达到70%、60%和50%。以上这三种方式发芽可靠性均较高,同时使用可最大限度保证发芽,避免天地差异可能带来的影响;
2)验证了水分养分控制方案,缓释肥比例6 g/L,每株植物由2 g缓释肥供应养分,含水率控制范围为18%~28%。经验证,在这一水分养分控制方案下,装置水分可满足植物生长需求,不会出现缺水或泡水现象,缓释肥总量可满足植株对养分的需求,且该缓释肥比例不会造成电导率过高烧苗现象;
3)按照第18天以后植株的生长发育状况,其光合二氧化碳净化能力能够被有效测量,且随着天数增加,植株越来越高,叶面积越来越大,其净化能力也明显增强;
4)在确定的栽培方案下,植株平均株高可到达7 cm,平均叶片数可达到6片/株,平均鲜重可达到5.5 g/株;
5)在目前较弱的光照强度水平下,植株长势与光照强度呈明显的正相关,而光照强度主要由装置输入功率决定,因此保证装置功率至关重要;
6)在当前栽培方案下,根系生长较弱,根系分布空间不足蛭石总空间的1/3。植株根系受蛭石装填紧实度影响,装填过于紧实,影响根系获取氧气,导致根系发育不良,侧根较少。

