DON暴露对断奶仔猪抗氧化水平、血清生化指标及小肠黏膜形态的影响
王希春,张娅菲,储小燕,朱 雷,朱电锋,冯士彬,李 玉,吴金节
(安徽农业大学 动物科技学院,安徽 合肥 230036)
脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON),又称为呕吐毒素,是一种主要由禾谷镰刀菌产生的B型单端孢霉烯族毒素[1],是世界上最常见的霉菌毒素之一。近年来,DON在粮食作物中污染的问题屡见不鲜,Wu等[2]研究发现,中国不同省的饲料原料和全价饲料中的DON检出率为93.9%。对2017年上半年全国饲料霉菌毒素检测后发现,DON的检出率为98.3%,平均含量为1 855.2 μg·kg-1,超过国家标准的最高限量标准[3]。动物采食DON污染的饲粮后,出现厌食、呕吐、发热、反应迟钝等中毒症状,消化系统受到一定程度的损伤,并产生氧化应激[4]。在畜禽中,猪对DON的敏感性最强[5]。研究表明,高剂量DON可降低断奶仔猪脾脏中谷胱甘肽过氧化物酶(GSH-Px)和总超氧化物歧化酶(T-SOD)的活性,并显著提高丙二醛(MDA)的含量[6]。在DON与玉米赤霉烯酮(zearalenone,ZEN)的联合作用下,可使仔猪血清中γ-谷氨酰转移酶(γ-GGT)、谷草转氨酶(AST)和谷丙转氨酶(ALT)含量增加72.0%、32.6%和36.6%[7]。此外,DON还是蛋白质生物合成的抑制剂,其主要靶细胞为肠上皮细胞[8],无论是低剂量还是高剂量的DON暴露均可导致不同程度的肠道损伤。目前,饲料中DON对仔猪抗氧化作用及机体生理生化、消化系统毒性的研究尚不完善。本试验旨在通过对断奶仔猪饲喂DON污染饲料,研究其对仔猪机体抗氧化指标、血清生化指标及肠道黏膜屏障的影响,为丰富和完善DON的毒性作用机理提供依据。
1 材料与方法
1.1 试验动物
试验用 “杜×长×大”三元杂交断奶仔猪,由安徽省青阳县五星畜牧种猪场提供。
1.2 试剂和仪器
禾谷镰刀菌由南京农业大学中毒病实验室惠赠;玉米购自合肥市农贸市场;离心管、TIP头,美国Axygen Biosciences公司;BSD-100振荡培养箱,上海博讯实业有限公司;高效液相色谱仪,美国Waters公司;微量移液器,德国Eppendorf公司;Multiskan Mk3型酶标仪,赛默飞世尔(上海)仪器有限公司;TGL-18R台式高速离心机,珠海黑马医学仪器有限公司;超净工作台,苏州智净净化设备有限公司;BS-220全自动生化分析仪,深圳迈瑞生物医疗电子有限公司;YD-1508R 轮转式切片机,浙江金华益迪医疗设备厂;CX31光学显微镜,日本OLYMPUS公司;ELISA试剂盒,南京森贝迦生物技术有限公司。
1.3 DON饲粮的制备
将保存于4 ℃的禾谷镰刀菌接种到马铃薯葡萄糖琼脂培养基上,25 ℃复苏培养,观察禾谷镰刀菌的生长情况。将复苏好的禾谷镰刀菌接种到察氏液体培养基,置于恒温振荡培养箱内,120 r·min-125℃培养5~7 d。随后将150 g干燥玉米装入500 mL锥形瓶中,调节水分含量至45%,塞上软胶塞,置于同一培养箱中,27 ℃培养20 d,取出锥形瓶,灭菌后烘干备用。将烘干的霉变玉米粉碎,使用液相色谱法,测定其中DON含量,然后与基础饲粮(DON、ZEN含量分别为0.15、0.05 mg·kg-1)进行混合,分别制备含量为1 mg·kg-1与2 mg·kg-1的DON饲粮。
1.4 试验动物分组与饲养管理
选取30头21日龄断奶仔猪(平均体质量为6.87±0.41 kg),随机分为3栏,每栏10头,分别饲喂基础饲粮(对照组)、低剂量DON饲粮(DON含量为1 mg·kg-1)、高剂量DON饲粮(DON含量为2 mg·kg-1),试验期为60 d。自由采食,自由饮水,每天观察仔猪的采食和健康状况,消毒免疫程序严格按照猪场管理方案进行。
1.5 检测样本的制备
1.5.1 血清的制备
在60 d时,对所有仔猪进行前腔静脉采血,血液样品静置30 min,3 000 r·min-1离心10 min,制备血清,-20 ℃保存,用于测定相关血清指标。
1.5.2 小肠病理切片制作
试验结束时,每组随机选择5头仔猪放血致死,采集十二指肠、空肠中段、回肠中段各5 cm,置于10%甲醛溶液中固定。48~72 h 后取出固定的肠道样本,进行石蜡包埋,切取5 μm切片并进行HE染色,封片后在光学显微镜下观察。
1.6 检测指标和方法
1.6.1 血清生化指标的测定
使用深圳迈瑞公司BS-220全自动生化分析仪进行血清生化指标测定。检测指标包括谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)、γ-谷氨酰转移酶(γ-GGT)、总蛋白(TP)、白蛋白(ALB)、球蛋白(GLB)、尿酸(UA)、尿素(UREA)、肌酐(CREA)、淀粉酶(α-AMY)、脂肪酶(LIP)、钙(Ca)、磷(P)、肌酸激酶(CK)。所有指标的测定操作均按照说明书进行。
1.6.2 抗氧化性能指标的测定
分别用猪SOD、GSH-Px、CAT、NO、MDA ELISA试剂盒进行测定,操作过程严格按照试剂盒说明书进行。
1.6.3 肠道通透性指标的测定
分别用猪DAO及D-乳酸(D-LA)ELISA检测试剂盒进行测定,操作过程严格按照试剂盒说明书进行。
1.6.4 小肠绒毛高度及隐窝深度的测量
小肠组织HE染色切片在40倍光学显微镜下观察,分别选取10个典型视野(绒毛结构完整、走向平直),使用ISCapture V3.5数码互动成像系统进行拍摄,在Image-Pro Plus 6.0软件中测量各视野中绒毛高度及隐窝深度,并计算绒毛高度/隐窝深度。
1.7 数据处理
2 结果与分析
2.1 DON对断奶仔猪抗氧化性能的影响
由表1可知,高剂量组血清中SOD、GSH-Px、CAT含量显著低于对照组和低剂量组(P<0.05);低剂量组显著低于对照组(P<0.05)。高剂量组血清中NO含量较对照组显著增加(P<0.05)。此外,高剂量组血清中MDA显著高于对照组和低剂量组(P<0.05),低剂量组显著高于对照组(P<0.05)。
2.2 DON对断奶仔猪血清生化指标的影响
由表2可知,高剂量组血清中AST含量显著低于对照组(P<0.05),ALP含量显著高于对照组(P<0.05),γ-GGT显著高于对照组与低剂量组(P<0.05)。高剂量组血清CREA显著高于对照组和低剂量组(P<0.05),低剂量组显著高于对照组(P<0.05)。高剂量组与低剂量组α-AMY含量显著高于对照组(P<0.05)。高剂量组LIP显著高于对照组(P<0.05),CK显著高于低剂量组与对照组(P<0.05)。
表1DON对断奶仔猪抗氧化性能的影响
Table1Effect of DON on antioxidant capacity in weanling piglets
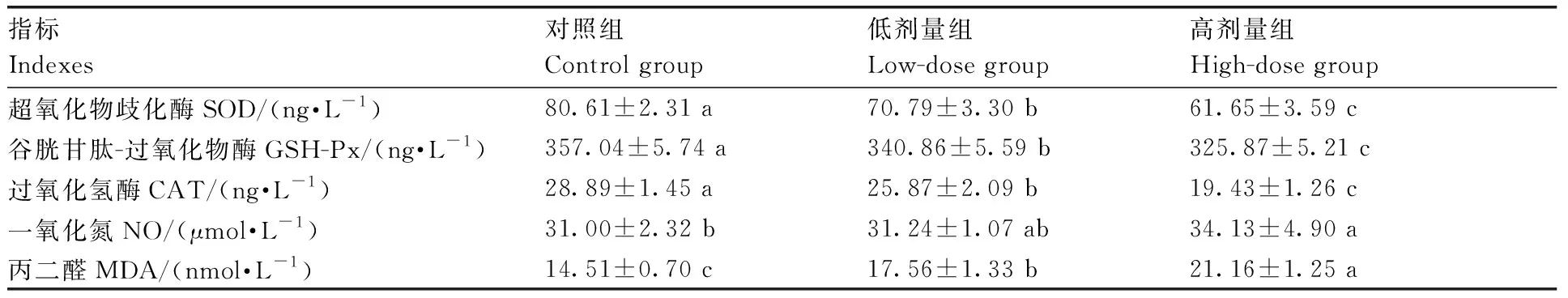
指标Indexes对照组Control group低剂量组Low-dose group高剂量组High-dose group超氧化物歧化酶SOD/(ng·L-1)80.61±2.31 a70.79±3.30 b61.65±3.59 c谷胱甘肽-过氧化物酶GSH-Px/(ng·L-1)357.04±5.74 a340.86±5.59 b325.87±5.21 c过氧化氢酶CAT/(ng·L-1)28.89±1.45 a25.87±2.09 b19.43±1.26 c一氧化氮NO/(μmol·L-1)31.00±2.32 b31.24±1.07 ab34.13±4.90 a丙二醛MDA/(nmol·L-1)14.51±0.70 c17.56±1.33 b21.16±1.25 a
同行比较,无相同字母表示处理间差异显著(P<0.05)。下同。
Data followed by no same letters wihin the same row indicated significant difference atP<0.05 . The same as follows.
2.3 DON对断奶仔猪肠道通透性的影响
由表3可见:试验开始时,各组间血清中DAO与D-LA含量无显著差异。试验结束后,血清中DAO、D-LA含量随毒素剂量的增加而升高,各处理间差异显著(P<0.05)。
2.4 DON对断奶仔猪小肠黏膜形态的影响
由表4可见:高剂量组十二指肠肠绒毛高度显著高于对照组与低剂量组(P<0.05),低剂量组肠绒毛则显著低于其他组(P<0.05)。空肠绒毛高度随毒素剂量的增加而显著降低(P<0.05)。回肠对照组绒毛显著高于毒素处理组(P<0.05),且处理组肠绒毛随毒素剂量的升高而降低,但不显著。各肠段隐窝深度均无显著变化。此外,绒毛高度与隐窝深度的比值所呈趋势与绒毛高度相一致。
表2DON对断奶仔猪血清生化指标的影响
Table2Effect of DON on serum biochemical indexes in weanling piglets

指标 Indexes对照组 Control group低剂量组 Low-dose group高剂量组 High-dose group谷丙转氨酶 ALT/(U·L-1)51.73±6.0952.50±9.0558.95±3.46谷草转氨酶 AST/(U·L-1)112.8±7.35 a91.80±2.83 ab77.05±8.70 b碱性磷酸酶 ALP/(U·L-1)282.73±11.72 b341.50±9.01 ab374.03±24.09 aγ-谷氨酰转移酶 γ-GGT/(U·L-1)95.27±3.84 b105.03±9.41 b151.10±30.18 a总蛋白 TP/(g·L-1)59.30±2.9956.20±4.3154.03±3.45白蛋白 ALB/(g·L-1)27.73±4.2824.30±3.9326.30±2.43球蛋白 GLB/(g·L-1)31.57±2.32 31.90±7.5427.73±2.87白蛋白/球蛋白 ALB/GLB0.90±0.170.80±0.260.93±0.12尿酸 UA/(μmol·L-1)12.30±2.4610.60±1.8710.13±2.76尿素 UREA/(mmol·L-1)4.54±0.634.11±0.365.05±0.88肌酐 CREA/(μmol·L-1)65.83±6.52 c 84.33±2.37 b96.23±7.06 a淀粉酶 α-AMY/(U·L-1)1 557.50±170.41 b2 586.35±172.75 a2 570.60±74.23 a脂肪酶 LIP/(U·L-1)4.63±0.25 b5.40±0.44 ab6.00±0.56 a钙 Ca/(mmol·L-1)2.48±0.162.30±0.222.36±0.28磷 P/(mmol·L-1)3.91±0.083.79±0.444.22±0.59肌酸激酶CK/(U·L-1)962.45±26.38 b1 326.03±382.25 b2 196.03±248.32 a
表3DON对断奶仔猪肠道通透性的影响
Table3Effect of DON on intestinal permeability in weanling piglets
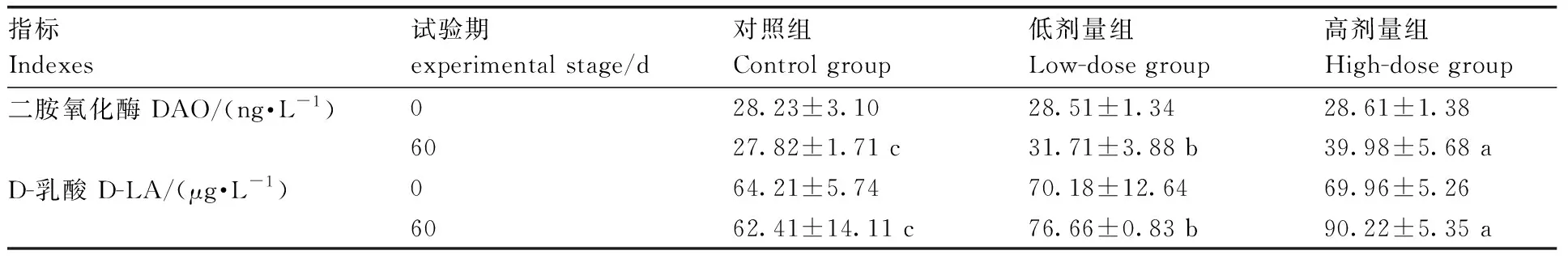
指标Indexes试验期experimental stage/d对照组Control group低剂量组Low-dose group高剂量组High-dose group二胺氧化酶 DAO/(ng·L-1)028.23±3.1028.51±1.3428.61±1.386027.82±1.71 c31.71±3.88 b39.98±5.68 aD-乳酸 D-LA/(μg·L-1)064.21±5.74 70.18±12.6469.96±5.266062.41±14.11 c76.66±0.83 b 90.22±5.35 a
表4DON对断奶仔猪小肠黏膜形态的影响
Table4Effect of DON on small intestinal morphology in weanling piglets
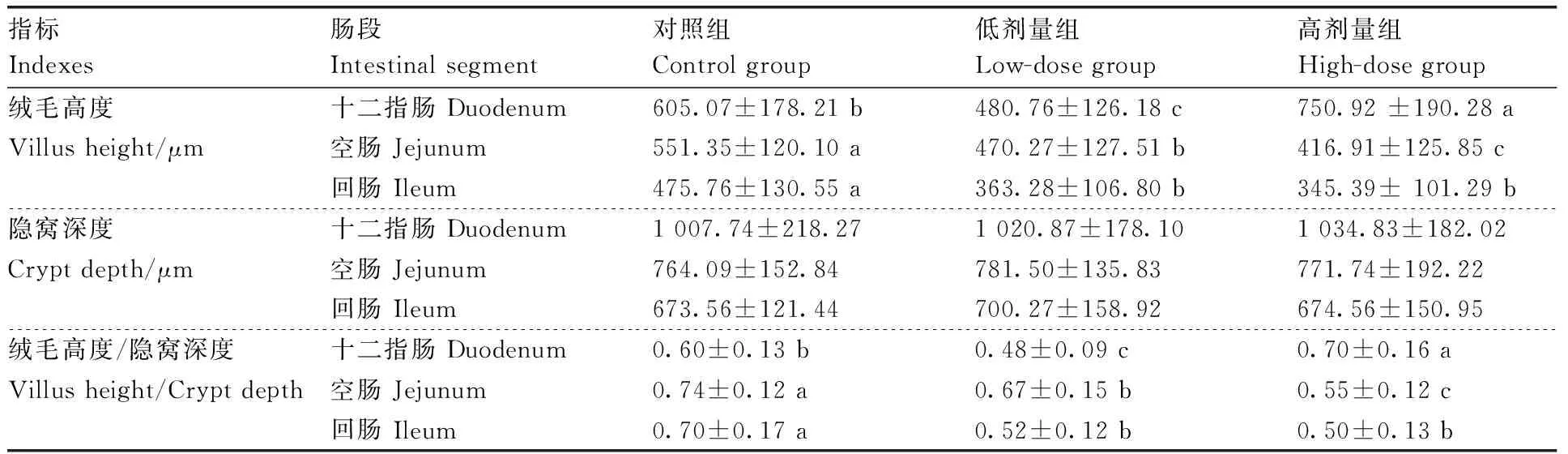
指标Indexes肠段Intestinal segment对照组Control group低剂量组Low-dose group高剂量组High-dose group绒毛高度十二指肠 Duodenum 605.07±178.21 b480.76±126.18 c750.92 ±190.28 aVillus height/μm空肠 Jejunum551.35±120.10 a470.27±127.51 b416.91±125.85 c回肠 Ileum475.76±130.55 a363.28±106.80 b345.39± 101.29 b隐窝深度十二指肠 Duodenum 1 007.74±218.271 020.87±178.101 034.83±182.02Crypt depth/μm空肠 Jejunum764.09±152.84781.50±135.83771.74±192.22回肠 Ileum673.56±121.44700.27±158.92674.56±150.95绒毛高度/隐窝深度十二指肠 Duodenum 0.60±0.13 b0.48±0.09 c0.70±0.16 aVillus height/Crypt depth空肠 Jejunum0.74±0.12 a0.67±0.15 b0.55±0.12 c回肠 Ileum0.70±0.17 a0.52±0.12 b0.50±0.13 b
由图1可见:对照组的各肠段肠绒毛结构完整,杯状细胞数量较多,未见明显病理学变化;低剂量组十二指肠与空肠肠绒毛高度降低,杯状细胞减少,其中十二指肠绒毛在高度降低的同时宽度增加;高剂量组十二指肠与空肠绒毛较其余两组稀疏,且基本无杯状细胞,十二指肠腺萎缩,空肠肠绒毛粘连、断裂;在毒素处理的2组中,回肠除绒毛高度降低、绒毛稀疏外,其他形态变化并不明显。

图1 断奶仔猪小肠组织病理切片(×40)Fig.1 Histopathological section of small intestinal tissues in weanling piglets (×40)
3 讨论
玉米是畜禽饲料中的主要能量来源,DON是玉米最常见的霉菌污染物之一。由于饲料存放环境的温度、湿度不易控制,使得DON污染问题越发严重。我国饲料卫生标准GB 13078—2017中规定,猪配合饲料中DON最高限量为1 mg·kg-1,而欧盟关于仔猪饲料中DON的最高限量则更少,为0.9 mg·kg-1[9]。已有研究发现,猪在摄入含有0.6 mg·kg-1DON饲料后便可造成一定的器官损伤以及机体炎症反应[10]。本试验采用DON含量为1 mg·kg-1和2 mg·kg-1的饲粮进行试验,以便为饲料的安全性应用提供参照。
动物出现氧化应激的特征为细胞内出现大量活性氧,机体可通过一系列的酶促反应使得活性氧含量下降,动物机体内的抗氧化剂包括ROS代谢酶,如SOD、GSH-Px以及CAT等[11],此外还包括活性氮(RNS),如NO等[12],而MDA则是脂质过氧化的最终产物,以上这些物质在机体中的含量可以显示动物所受氧化应激的程度。Li等[13]研究发现,3 mg·kg-1DON可使断奶仔猪血清中T-SOD、GSH-Px含量显著降低。Wu等[14]研究发现,4 mg·kg-1DON可以显著增加断奶仔猪肾脏、回肠及空肠组织中的MDA含量,同时可以显著降低血清中CAT的活性。本试验中所得结果与上述研究结果一致。
血清生化指标是检测动物机体是否处在正常内环境之中的重要指标,一旦出现异常则提示相关脏器可能受到不同程度的影响。已有研究发现,高水平的γ-GGT及AST可以反映肝损伤或氧化应激[15],ALP升高可以反映DON诱导的全身毒性所引起的肝脏代谢异常[11]。本试验中,DON处理组血清中AST水平显著下降,但γ-GGT与ALP含量显著升高,这一结果与Wu等[2]、姬长云等[16]研究结果一致。α-AMY与LIP主要存在于胰腺、肠黏膜中,其中α-AMY是判定胰腺炎的重要指标之一[17],LIP是检测肠黏膜完整性的参数[18]。试验中DON污染饲料饲喂仔猪后,仔猪血清中α-AMY、LIP含量均显著上升,表明仔猪胰腺可能受损,同时肠黏膜屏障被破坏。此外,试验中CREA升高说明肾脏可能受到一定程度的损伤。
肠道屏障对动物机体具有保护作用,DAO主要位于肠上皮细胞中,是一种高活性的细胞内酶[19]。肠道黏膜受损,细胞内的DAO可进入血液,最终使血液中DAO含量升高。此外,肠道屏障被破坏后,原本存在于肠腔内的细菌代谢产物D-LA将进入血液,使血液中D-LA含量升高[20]。本试验中,断奶仔猪血清中DAO及D-LA含量随饲料中毒素剂量的增加而升高,这也与Wu和Feng等[14,20]的研究结果一致,说明DON对肠道黏膜的通透性造成一定影响。
有研究发现,饲料中含有12 μg·kg-1DON便可以使绒毛高度与隐窝深度之比降低[21],而2~4 mg·kg-1或更高剂量的DON可使空肠杯状细胞数量减少,空肠及回肠萎缩、肠绒毛变短[8,13,22]。本试验中,饲料含1 mg·kg-1DON即导致仔猪小肠肠绒毛高度降低,尤其是十二指肠的绒毛在高度降低的同时宽度明显增加,这可能是由于绒毛通过自身的收缩从而达到恢复自身屏障功能的目的[23]。高剂量组中,虽然十二指肠肠绒毛较其他2组显著增高,但其绒毛密度明显降低,同时上皮层中杯状细胞数量明显减少,且十二指肠腺萎缩,此外,空肠绒毛发生明显粘连,表明2 mg·kg-1DON污染的饲粮可以对肠道造成更加严重的损伤。
综上所述,本试验中所使用的DON浓度可以导致断奶仔猪机体氧化应激,引起部分血清生化指标异常,同时对小肠黏膜形态及肠道通透性也造成一定损伤。试验中所使用的1 mg·kg-1DON为猪配合饲料国家限量标准,但足以使断奶仔猪产生氧化应激并且使肠黏膜及其他脏器受到损伤,因此可推断仔猪配合饲料中霉菌毒素DON的含量应低于1 mg·kg-1。

