醛酮还原酶AKR7A3原核表达条件的优化及酶学活性检测
孙婷婷,孙基丰,周紫薇,褚春旭,张昊
(长春理工大学 生命科学技术学院,长春 130022)
AKR作为NADPH依赖的氧化还原酶[1]家庭成员当中的一种,AKR家族的存在十分广泛,在原核和真核生物当中都存在该种类型的酶[2]。文献表明人源AKR家族种类已发现了15个[3]AKR酶家族主要参与生物机体内醛酮类化合物的代谢过程,并在醛类和相关化合物的解毒时期发挥着不可忽视的作用。AKR家族酶的底物主要有脂肪族和芳香族的醛/酮类的化合物[4]。所以该酶在生成激素、药物的分解排出、炎症反应、解毒等生物活动中有着不可忽视的作用[5]。AKR大多以37kDa的单体类型出现在细胞浆中[6-8]。不同种类间的分布以及作用是不一样的,比如说AKR6家族能够控制K+通道的开放,AKR1、AKR6、AKR7三个种类在哺乳动物机体中均有表达,其功能是参加生物的生命代谢过程[9]。有关报道显示,AKR7亚类型中的成员AKR7A2和AKR7A3主要参加肝脏对黄曲霉毒素的解毒的过程,其中AKR7A3主要是参与肝脏中AFB1类的毒性解除作用[10]。但是关于AKR7A3酶学活性的相关研究很少。
大肠杆菌是科研实验中最常用的高效表达异源蛋白的原核表达工具,其优点在于操作简便,培养条件简单[11]。但并不是所有外源遗传物质都能够在这种表达体系中进行有效表达[12],主要由于不同的遗传物质有不同构造、mRNA的稳定性[13]、翻译、折叠、宿主细胞蛋白酶的降解作用,大肠杆菌密码子在原核和真核基因使用上的区别,以及蛋白质对宿主的产生相对的毒性[14]等因素。因此,本文对于人源AKR7A3基因序列进行相应的密码子优化,构建原核表达体系,优化表达条件,获得最大产量的可溶性酶蛋白,再通过酶促动力学实验,获得最优酶活性条件。本文实验结果将为后续AKR7A3研究提供实验基础。
1 材料与方法
1.1 AKR7A3基因合成
从GENE BANK里面获取AKR7A3全序列,选取相应酶切位点,由上海生工合成并优化得到AKR7A3-pET15b质粒。
1.2 菌株和试剂
大肠杆菌(Escherichia coli)表达菌株BL21(DE3),由本实验室制备并保存;IPTG(异丙基硫代半乳糖苷)配成100mg/mL浓度备用。低相对分子质量蛋白Marker和SDS-PAGE试剂购自宝生物工程大连公司(进口分装);其他试剂均为国产分析纯试剂。
1.3 AKR7A3原核表达
将重组质粒AKR7A3-pET15b和pET 15b空载体分别进行诱导表达,于37℃培养至OD600约为0.6,加入IPTG诱导5h。菌体离心后弃上清,得到的菌体沉淀用100μL PBS重悬后进行分离纯化。蛋白样品分别加入100μL 2×SDS PAGE上样缓冲液,沸水中处理5min,12000rpm/min瞬时离心后取20μL上清进行SDS聚丙烯酰胺凝胶电泳。以pET 15b空载体和未加IPTG的AKR7A3-pET15b菌为对照鉴定目的基因AKR7A3的表达情况。
1.4 温度对重组菌AKR7A3表达的影响
BL21-pET15b-AKR7A3在转速180rpm、5h、诱导剂终浓度为1mM/L条件不变,温度分别为37℃、30℃、24℃、16℃的环境下进行表达。将其菌体进行收集、超声破碎,将得到的上清进行SDS聚丙烯酰胺凝胶电泳检测。
1.5 转速对重组菌AKR7A3表达的影响
BL21-pET15b-AKR7A3在温度 37℃,5h,诱导剂终浓度为1mM/L条件不变,转速分别为110rpm、130rpm、150rpm、180rpm的条件下进行表达。将其菌体进行收集、超声破碎,离心使用上清进行SDS聚丙烯酰胺凝胶电泳检测。
1.6 时间对重组菌AKR7A3表达的影响
BL21-pET15b-AKR7A3在37℃、180rpm,诱导剂终浓度为1mM/L条件不变,表达时间分别为5h、10h、16h、20h的条件下进行表达。将其菌体进行收集、超声破碎,离心使用上清进行SDS聚丙烯酰胺凝胶电泳检测。
1.7 诱导剂浓度对重组菌AKR7A3表达的影响
BL21-pET15b-AKR7A3在37℃、180rpm,5h条件不变,诱导剂终浓度分别为0.40mM/L、0.60mM/L、0.80mM/L、1.00mM/L环境下进行表达。将其菌体进行收集、超声破碎,离心使用上清进行SDS聚丙烯酰胺凝胶电泳检测。
1.8 醛酮还原酶AKR7A3酶活性动力学检测
1.8.1 最佳反应温度确定
酶反应体系300μL;DL-甘油醛作为底物;NADPH作为体系辅酶;2%的乙腈为共溶剂;100mM/L PBS为反应的缓冲溶液;PH需要控制在7.0;设置反应温度为20℃、25℃、30℃、37℃以及40℃,反应时间达到5分钟,反应后在340nm处测定吸光数值。
1.8.2 最佳反应PH值确定
酶反应体系300μL;DL-甘油醛为底物;NADPH作为体系辅酶;2%的乙腈为共溶剂;100mM/L PBS为反应的缓冲溶液;反应温度设置为37℃;将其PH值设置为5.00、6.00、7.00、8.00以及9.00,反应时间达到5分钟,反应后在340nm.处测定吸光数值。
1.8.3 最佳反应NADPH辅酶浓度确定
酶反应体系300μL;DL-甘油醛为底物;NADPH作为体系辅酶;2%的乙腈为共溶剂;100mM/L PBS为反应的缓冲溶液;反应温度为37℃;PH设置为7.00,NADPH辅酶浓度设置为0.10mmol/L、0.15mmol/L、0.20mmol/L、0.30mmol/L、0.40mmol/L,反应时间达到5分钟,反应后在340nm处测定吸光数值。
1.8.4 最佳反应底物浓度确定
酶反应体系300.00μL;DL-甘油醛为底物;NADPH作为体系辅酶;2%的乙腈为共溶剂;使用100mM/L PBS作为反应的缓冲溶液;反应温度为37℃;PH控制在7.0;底物浓度分别为2.00mmol/L、4.00mmol/L、 6.00mmol/L、 8.00mmol/L、10.00mmol/L,反应时间达到5分钟,反应后在340nm处测定吸光数值。
1.8.5 最佳加酶量确定
酶反应体系300μL;DL-甘油醛为底物;NADPH作为体系辅酶;2%的乙腈为共溶剂;100mM/L PBS作为反应的缓冲溶液;反应温度为37℃;PH控制在7.00;酶的用量分别为16ng、40ng、64ng、80ng、96ng几个梯度,反应时间达到5分钟,反应后在340nm处测定吸光数值。
1.8.6 最佳反应底物确定
酶活反应体系300uL;DL-甘油醛作为底物;NADPH作为体系辅酶;2%的乙腈作为共溶剂;100mM/L PBS作为反应的缓冲溶液;反应温度为37℃;PH控制在7.0;底物分别为睾丸酮、孕酮、DL-甘油醛、雌二醇、甲睾酮、雌酮,反应时间达到5分钟,反应后在340nm处测定吸光数值。
2 结果与分析
2.1 BL21-pET15b-AKR7A3表达菌构建结果
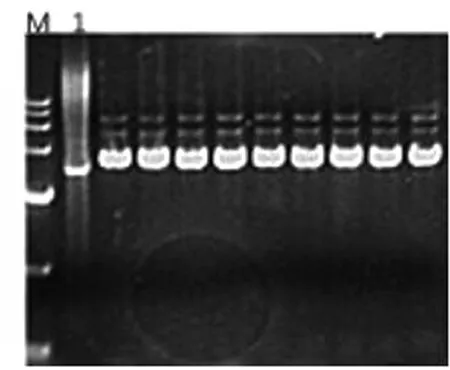
图1 BL21-pET15b-AKR7A3质粒鉴定
图1中可以看出,M为15000marker,1泳道为空的pET-15b载体,其余条带均比1泳道高。证明在氨苄青霉素平板上挑选的单菌落均成功转入pET15b-AKR7A3质粒,并说明AKR7A3的表达载体已成功构建,能用于后续实验。
2.2 AKR7A3蛋白表达结果
图2中可以看出,M为15000marker,1泳道为BL21-pET15b-AKR7A3表达菌的上清液,其中目的蛋白醛酮还原酶AKR7A3大量表达,其大小约为36kDa。4泳道为NPI-1流出液,其中无目的蛋白条带,说明醛酮还原酶AKR7A3与镍柱充分结合。2,3泳道为洗脱后流出液,其中3泳道无杂蛋白,蛋白纯度能够达到99%。
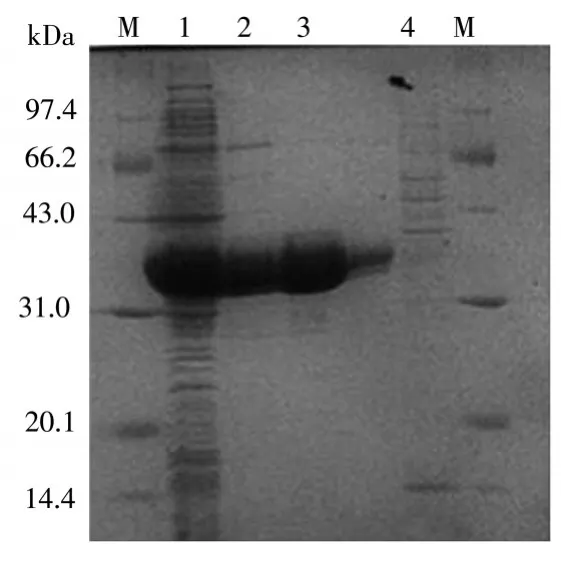
图2 AKR7A3蛋白表达SDS-PAGE电泳图
2.3 表达温度优化结果
在图3中可以看出,醛酮还原酶AKR7A3在温度为37℃、30℃、24℃、16℃环境下的表达情况。其中4泳道温度为16℃,其上清中醛酮还原酶AKR7A3表达量是最多的。
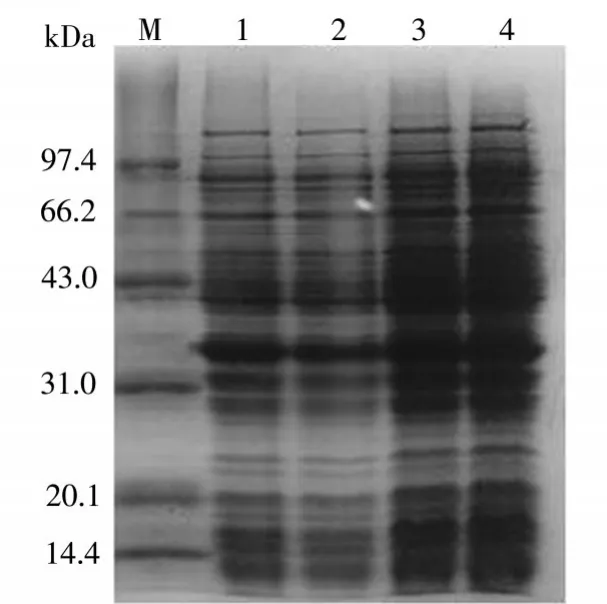
图3 温度优化结果
2.4 表达转速优化结果
图4中可以看出,醛酮还原酶AKR7A3在转速分别为110rpm、130rpm、150rpm、180rpm条件下的表达情况。1泳道是转速为110rpm,上清中的醛酮还原酶AKR7A3表达量最多。
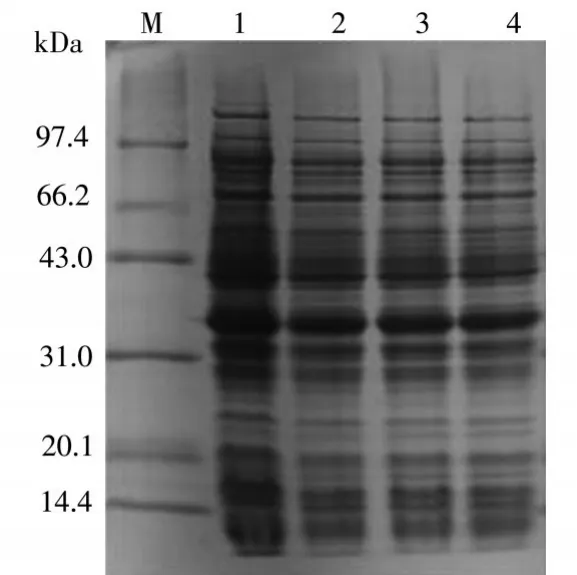
图4 转速优化结果
2.5 表达时间优化结果
在图5可以看到,醛酮还原酶AKR7A3表达时间分别为5h、10h、16h、20h条件下的表达情况。其中4泳道为20h,上清中的醛酮还原酶AKR7A3表达量是最多的。
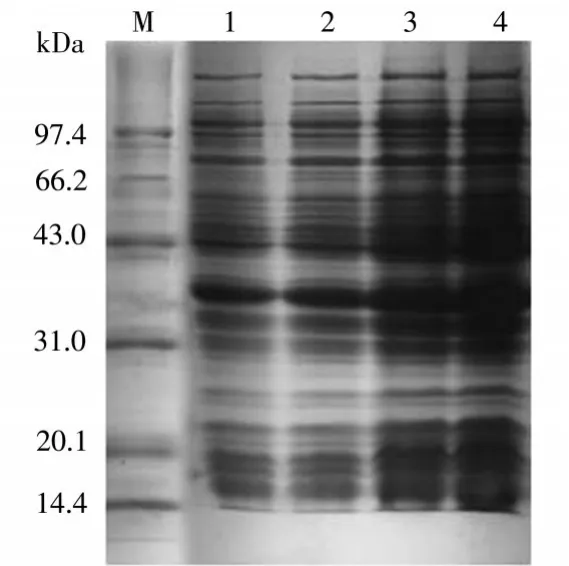
图5 表达时间优化结果
2.6 诱导剂IPTG浓度优化结果
在图6中可以看到,醛酮还原酶AKR7A3在诱导剂终浓度分别为0.40mM/L、0.60mM/L、0.80mM/L、1.00mM/L条件下的表达情况。4泳道诱导剂浓度为1.0mM/L,上清中的醛酮还原酶AKR7A3表达量是最多的。

图6 表达时间优化结果
2.7 醛酮还原酶AKR7A3酶活性检测
从温度、PH、底物、NADPH、酶量等因素优化来看,测得最佳动力学参数如下:
在不同温度(20℃、25℃、30℃、37℃、40℃)下检测AKR7A3酶活力,结果表明在37℃时酶活力最高,如图7(a)。在不同PH值(5.00、6.00、7.00、8.00、9.00)下检测AKR7A3酶活力,结果表明在PH=7酶活力最高,如图7(b)。不同NADPH浓度(0.10、0.15、0.20、0.30、0.40mmol/L)下检测AKR7A3酶活力,结果表明在0.2mmol/L时酶活力最高,如图7(c)。在底物不同浓度(2.00、4.00、6.00、8.00、10.00mmol/L)下检测AKR7A3酶活力,结果表明在2.00mmol/L时酶活力最高,如图7(d)。在不同加酶量(16.00ng、40.00ng、64.00ng、80.00ng、96.00ng)下检测AKR7A3酶活力,结果表明在100μL时酶活力最高,如图7(e)。在不同种类反应底物下检测酶活力,结果表明睾丸酮>雌酮>孕酮>甲睾酮>DL-甘油醛,但是在雌二醇为底物时醛酮还原酶检测AKR7A3酶活力显著小于其他底物,原因是由于雌二醇中没有醛基/酮基,无法在醛酮还原酶的作用下进行相关反应。如图7(f)。
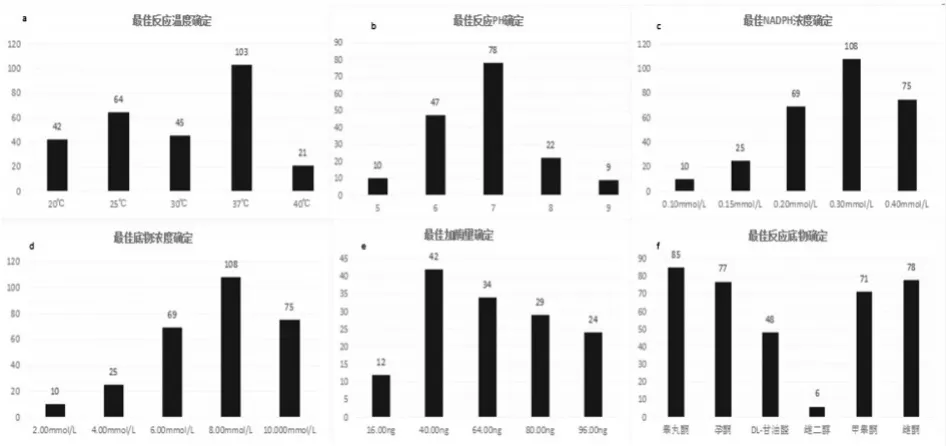
图7 最佳酶活性确定
综上所述,在 37℃;PH=7;NADPH 浓度0.2mmol/L;底物浓度2.00mmol/L;加酶量100μL;睾丸酮为底物时酶活力最高。
3 结论
本文为了能够使得人源醛酮还原酶AKR7A3在该大肠杆菌BL21中正常表达,在GEN BANK中查找人源AKR7A3基因序列,依照大肠杆菌表达的相关特征,对人源基因序列进行密码子的相应优化。合成优化后的醛酮还原酶AKR7A3基因序列,构建了AKR7A3-pET15b载体。使用大肠杆菌BL21作为宿主菌进行表达,并对AKR7A3表达的温度、转速、表达所需时间和诱导剂浓度等表达条件进行优化。实验得到最优的表达条件为16℃、110rpm/h、20小时以及诱导剂浓度达到1.00mM/L。在优化后BL21-pET15b-AKR7A3能够大量表达可溶性好、活性高、纯度达99.0%的醛酮还原酶AKR7A3。酶活性动力学检测结果表明,在37℃;PH=7;NADPH 浓度 0.2mmol/L;底物浓度2.00mmol/L;加酶量100μL;睾丸酮为底物时酶活力最高。
后续将在此基础上,将通过基因重组大量制备AKR7A3酶蛋白,进行酶激活剂及抑制剂的相关研究,从而筛选出对醛酮还原酶AKR7A3高效酶激活剂及抑制剂,为将来研究醛酮还原酶AKR7A3与相关癌症发生与发展的基础研究、以及及诊断与治疗药物研究提供实验基础。

