禽类性别调控机理研究进展
胡玉琼,许发琼,郑恒博,白丁平, 李 昂
( 福建农林大学 动物科学学院,福建 福州350002)
家禽业是畜牧业的重要组成部分,对满足消费者对蛋、肉等产品的需求具有重要意义。家禽的许多经济性状与性别直接相关,蛋禽中仅需饲养雌性个体就能获得良好的经济效益;肉禽生产中雄性个体生长速度快、饲料报酬高,饲养雄性个体的经济效益最为理想。因此,若能实现家禽的性别控制,将对家禽生产具有重要的意义。
禽类和哺乳动物的性别主要由性染色体决定[1],性染色体上的性别决定基因开启性别分化,调节性腺分化为卵巢或睾丸[2]。研究发现禽类性别分化机理与哺乳动物不同,在哺乳动物中性染色体XX代表雌性,XY代表雄性,而在禽类中ZZ代表雄性,ZW代表雌性,且在禽类中未发现睾丸决定因子(SRY)[3]。此外,类固醇激素(如雌激素、雄激素)在禽类性别分化过程中扮演着重要角色,雌激素影响性腺发育为卵巢,雄激素影响性腺发育为睾丸,而雌激素由雄激素在芳香化酶的作用下转化而来[4]。由此表明基因和激素共同调节禽类的性别分化。
1 性别分化
1.1 性腺发育过程
性别分化是受精卵在性染色体的基础上,经外界因素的影响发育成睾丸或卵巢的过程。禽类性别分化的过程分为多个时期,孵化至第3.5天时观察到性腺发育;孵化至第3.5~5.5天时性腺根据性染色体的不同开始出现差异;孵化至第6.5天时从组织学水平上观察到性腺分化,裹在髓质部的雄性性腺开始形成曲精细管索,同一时期雌性性腺外层的皮质层开始增殖变厚;孵化至第8天时雌性右侧的卵巢开始退化,左侧卵巢明显大于右侧,而雄性中左侧睾丸稍大于右侧[5]。禽类性腺形成过程中,原始生殖细胞(PGC)起重要作用。禽类PGC起源于外胚层,在孵化第3天之前,PGC通过血液迁移至生殖嵴,并有65%~70%定居于生殖嵴,含有PGC皮质区的生殖嵴分化为卵巢,含有PGC髓质区的生殖嵴分化为睾丸[6]。
1.2 性腺发育过程中基因的表达
禽类早期胚胎的中性生殖腺具有两性分化潜能,最终受遗传基因调控分化为雌性或雄性生殖腺。雄性家禽中DMRT1和HEMGN均位于Z染色体上,DMRT1在孵化至第3.5天开始表达,在DMRT1调控下,HEMGN、SOX9、AMH基因开始表达[7]。DMRT1、HEMGN、SOX9和AMH是睾丸发育的关键调控因子[8]。雌性家禽中HINTW和FET1均位于W染色体上,HNITW(ASW和WPKCI)在孵化至第4.5天开始表达,孵化至第6.5天达到表达峰值[9];FET1在孵化至第4.5~6.5天时特异表达决定禽类性别分化[10]。此外,常染色体上某些基因也参与到性别分化过程,如SOX9、AMH、FOXL2、SF1均在性腺分化过程中表达(见图1)[2]。
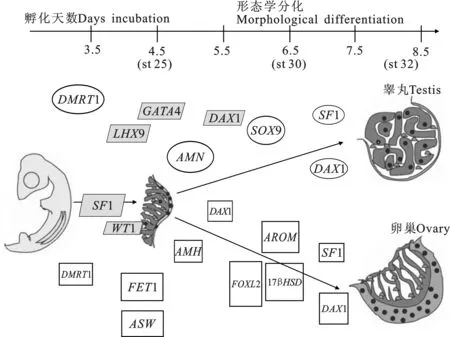
图1 鸡胚性腺发育和性分化过程中基因表达谱[2] 鸡胚孵化至6.5 d之前,雌、雄性腺处于中性状态。:雄性特异表达的基因;:雌雄个体表达量相 近的基因;:雌性特别表达基因。基因表达量用图形面积 大小表示。Fig.1 The expression profiles of gonad development and sexual differentiation in chicken embryo[2] Before embryo incubation to 6.5 days, the gonad of both male and female were in neutral state.: Male-specific genes;:A gene whose expression is similar in both sexes;: Female- specific genes. The area represents gene expression level
2 性别调控基因
2.1 与Z染色体关联的睾丸发育相关基因
2.1.1DMRT1DMRT1(doublesex and mab-3-related transcription factor) 主要影响雄性动物生殖器官的发育,在非脊椎动物和脊椎动物中高度保守。脊椎动物中DMRT1对睾丸分化至关重要,在小鼠胚胎期性腺中过表达DMRT1,会促进睾丸发育,抑制卵巢发育[11]。DMRT1旁系同源基因也被证实与性别分化有关,如青鳉鱼Y染色体上DMY/DMRT1bY[12]、非洲爪蟾W染色体上DMW[13]。该类基因均属于DM域基因,通过基因重复和易位( 青鳉),重复和缺失(非洲爪蛙),或失去一个等位基因(鸟类),从而参与调控动物性腺分化过程[13]。
在Z染色体剂量假说中,DMRT1被认为与鸟类雄性性腺分化相关,是性别决定候选基因。DMRT1位于Z染色体上,在W染色体上未发现DMRT1同源体[14]。DMRT1最早在鸡胚孵化至第3.5天开始表达,且在雌、雄性腺中呈剂量差异性表达,在雄性性腺中表达量约为雌性中的2倍[2],干扰DMRT1表达后雄性性腺有向雌性性腺发育趋势[15]。借助逆转录病毒感染使DMRT1过量表达,从而抑制芳香化酶的产生,促使雄性相关基因表达,抑制雌性相关基因表达,进一步证实DMRT1是决定性腺发育成睾丸的重要基因之一[7]。研究发现用AI(芳香化酶抑制剂)处理性别分化前的鸡胚,在雌性(ZW)反转为雄性的鸡胚中发现DMRT1大幅度上调[16-17];孵化前用乙烯雌酚处理鸡胚,发现DMRT1在雄性(ZZ)反转为雌性的鸡胚中大幅度下调[18]。由此表明DMRT1为禽类性腺分化所必需,可能通过剂量补偿机制影响芳香化酶的产生,进一步对禽类的性别分化发挥作用。
2.1.2HEMGNHEMGN(hemogen)位于禽类Z染色体,是雄性胚胎中睾丸分化基因,在DMRT1之后SOX9之前表达[10]。如果在雌性鸡胚(ZW)中过表达HEMGN,会引起雄性标志基因DMRT1和SOX9表达上调,使雌性标志基因芳香化酶基因和FOXL2表达下调[19]。若在鸡胚中较早表达DMRT1会引起HEMGN异位表达[7],由此可见DMRT1与HEMGN之间存在某种反馈机制,通过两种基因的互相作用共同维持着雄性性腺的发育。
2.2 与W染色体关联的卵巢发育相关的基因
2.2.1FET1FET1(female-expressed transcript 1)位于W染色体短臂的常染色质中,在Z染色体上无同源序列,主要在雌性鸡胚早期阶段的皮质表达,是禽类卵巢决定候选基因[20]。FET1只在性别分化期雌性鸡胚左侧性腺中显著表达[16]。FET1的时空表达表明其在卵巢发育过程中起重要作用。
2.2.2HINTWHINTW(histidine triad nucleotide-binding protein W)位于禽类W染色体上,也被称作ASW和WPKCI[20-21],在雌性胚胎中高度表达[22]。HINTW编码HIT核酸连接蛋白,该编码产物与 Z染色体上HINTZ基因所编码的蛋白相比缺失组氨酸三联体(histidine triad,HIT)框,无法催化AMP与赖氨酸结合。相反HINTZ编码蛋白具有HIT框,并且HINTW与HINTZ结合形成HINTZ/HINTW异二聚体可抑制HINTZ发挥功能,从而起始雌性鸡胚性腺分化过程[23]。在芳香化酶抑制剂处理的鸡胚中发现HINTW表达上调,但未能阻止ZW个体雄性化[16],三倍体的研究证实WPKCI在鸟类性别决定过程中并不处于主导地位[24]。由此可见HINTW虽与性别分化相关,但不是禽类雌性决定基因,可能直接或间接与DMRT1互相作用, 从而影响禽类性别分化。
2.3 常染色体上性腺发育相关基因
2.3.1 影响睾丸发育相关的基因SOX9(SRY related HMG box,SOX)在睾丸支持细胞中特异性表达,对决定脊椎动物的性别起一定作用[25-26]。在缺失SRY基因的雄性小鼠中过表达SOX9,小鼠睾丸能正常发育[27];但抑制正常XY雄性小鼠中SOX9表达,会使小鼠发育为雌性表型[28]。在正常XX雌性小鼠中过表达SOX9,会使小鼠发育为雄性表型[29]。鸡基因组中无SRY,但SOX9在孵化至第6.5天在雄性髓质索中表达[30],且鸡体内的SOX9表达一旦启动将引起睾丸支持细胞分化,使其最终发育为雄性个体[31]。
AMH(antimullerian hormone)是一种二聚体糖蛋白,属于转化生长因子-β家族[26],是哺乳动物早期睾丸发育的标志,在睾丸支持细胞中合成和分泌,引起雄性缪勒氏管退化,并在性别分化中扮演着重要角色[32]。孵化至5.5天之前,AMH在鸡胚中开始表达,且雄性表达量高于雌性[33]。借助RNA干扰抑制鸡胚性腺中AMH表达,会影响鸡胚中肾和性腺的生长,但不影响决定睾丸生长发育基因DMRT1和SOX9表达,且睾丸发育正常[34]。相反用逆转录病毒转染使雌性家禽(ZW型)胚胎期AMH过量表达,雌性禽(ZW)胚胎期性腺中发育出类睾丸结构,但该结构中无睾丸支持细胞,雄性禽(ZZ)胚胎期性腺中出现类似的现象,两侧均缺少睾丸支持细胞和性腺类固醇激素[35]。综上所述,AMH在鸡胚内虽不是早期睾丸的激活剂,但通过影响性激素的产生,从而影响性腺的发育。
2.3.2 影响卵巢发育相关的基因CYP19A1(cytochrome P450 19A1,P450arom)是芳香化酶合成基因,主要在禽类雌性胚胎性腺中表达[36],表达时间与禽类卵巢形成时间(孵化第6.5~7.0天)一致[37]。CYP19A1位于常染色体上,其表达产物芳香化酶在雌性生殖腺的髓质中表达,且在卵巢发育过程中表达量持续增加[38]。芳香化酶在雄激素转化为雌二醇的过程中起关键作用,雌二醇只存在于雌性胚胎性腺中,是禽类卵巢发育的必需激素[39]。由此可见,抑制CYP19A1的表达会干扰雄激素转化为雌二醇,进一步阻止禽类卵巢的发育,使雌性个体有可能发育为雄性个体。研究证实利用芳香化酶抑制剂处理鸡胚,可使雌性反转为雄性[40]。相反在雄性鸡胚中过表达芳香化酶,会抑制DMRT1和SOX9等雄性基因表达,从而使正常雄性鸡反转为雌性表型鸡[41]。
FOXL2(female-expressed transcript 1) 在卵泡的颗粒状细胞中特异性表达,对卵泡发育起重要作用。FOXL2能与SOX9增强子元件结合导致SOX9表达沉默,抑制睾丸的分化[42]。研究表明FOXL2与CYP19A1均在卵泡颗粒细胞中表达,且FOXL2表达先于CYP19A1[43];FOXL2与CYP19A1之间存在反馈调节,在胚胎期抑制CYP19A1会使FOXL2表达量降低[44]。SF-1(Steroidogenic factor 1)属于孤核激素受体家族,与类固醇激素合成密切相关[45],在脊椎动物早期阶段的性腺和肾上腺发育中起重要作用[46]。SF-1在早期发育的鸡胚两性生殖嵴中均有表达,并且在卵巢中的表达高于睾丸[47]。当性腺分化(孵化9.0 d)后,SF-1在左侧卵巢的表达量高于右侧退化的卵巢和睾丸[48]。SF-1可与FOXL2结合调节卵巢甾体生成和正常卵泡的发育[49]。在人、鱼和鸡胚中SF-1通过与CYP19A1启动子结合调节CYP19A1的表达,SF-1对CYP19A1的表达起调控作用[36,50-51]。由此说明FOXL2、SF-1可能直接或间接调控芳香化酶的生成,从而调控雌激素的产生,进而影响雌性性腺发育。
3 展 望
禽类性别分化不仅受性别决定基因调控,并且还受性激素调控,因此,禽类的性别决定机制较为复杂。禽类中与性染色体关联的基因(DMRT1、HEMGN、FET1、HINTW)影响着性腺分化,位于常染色体上的基因(SOX9、AMH、CYP19A1、FOXL2、SF-1)也参与了性腺的发育。这些基因之间存在某种关系,构成一种复杂的调控网络,与性激素共同参与禽类的性别分化。随着分子生物技术的发展,可以利用高通量测序、基因敲除及基因编辑等技术进行基因功能方面的深入研究,以最终明确禽类性别分化机制,并将其应用到实践中,从而更好地控制家禽性别,提高养禽业经济效益。

