URI在胃癌组织的表达及对顺铂诱导的胃癌细胞凋亡的影响
卞慧琴,谷雨,2,陈瑾楠,王倩,吕耀娟,郑其平,谷俊侠
(1.江苏大学医学院,江苏镇江212013;2.江苏大学附属人民医院血液科,江苏镇江212001)
胃癌是全球高发的恶性肿瘤,据统计,2013年全球约有84万人死于胃癌,其中发展中国家占77%,且主要集中于中国[1-2]。胃癌确诊时很多已属中晚期,主要采用手术联合化疗进行治疗。由于化疗耐药的产生,患者术后复发和转移率高,预后不良[3]。前折叠素家族(PDFs)的非传统成员非经典前折叠素RPB5相互作用因子(unconventional prefoldin RPB5 interactor,URI)是一个多功能蛋白,影响细胞的多种生物学行为,如真核基因转录及哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)营养敏感通路的调控、维持基因组DNA稳定性等[4-7]。近年发现 URI具有癌基因的特性[8-11]。我们前期的体外实验证实URI能促进胃癌细胞的增殖与迁移,增强对多柔比星的耐药性,促进肿瘤细胞存活[12]。这提示URI在胃癌细胞中起癌蛋白的作用。一个原癌基因是否在某种肿瘤中发挥作用,需要有该基因在肿瘤组织中扩增或突变的依据。URI在胃癌组织中是否扩增及过度表达目前并不清楚。本研究应用胃癌组织芯片检测了胃癌组织URI的表达并分析其与临床特征的相关性,并通过体外实验分析URI对顺铂诱导的胃癌细胞凋亡的影响,以探讨URI在胃癌发生发展中的意义。
1 材料与方法
1.1 材料
1.1.1 组织芯片及细胞株 胃癌生存期组织芯片(HStm-Ade180Sur-09)购自上海芯超生物科技有限公司。芯片包含90例手术切除病理确诊为胃癌患者的组织标本,包括胃腺癌84例,其中黏液腺癌3例,腺癌中含部分印戒细胞癌5例,腺癌中含部分黏液腺癌2例;印戒细胞癌5例,其中伴部分黏液腺癌1例;高级别上皮内瘤、癌变1例(此例为瘤和癌都含有的病例,取样点经病理确认为癌变组织)。每例癌和癌旁组织各一个点,共180个点。
90例患者术前均未接受化疗放疗,其中男67例,女21例,年龄44~86岁,平均年龄67.3岁。病理分级:Ⅰ、Ⅱ级28例,Ⅲ级61例;肿瘤直径:>5 cm 47例,≤5 cm 40例;胃癌转移64例,未发生转移24例;TNM分期:TNM1、TNM2共33例,TNM3、TNM4共48例;手术时间在2009年12月至2010年6月,随访至2016年6月,随访期间死亡病例60例,生存病例30例;其中缺失的病例为资料不详的病例。
人胃癌细胞株MGC-803和SGC-7901由江苏大学朱伟教授赠予。
1.1.2 主要试剂及仪器 DMEM培养基(美国Hyclone公司);胎牛血清(以色列 BI公司);兔抗人URI单克隆抗体(美国 Proteintech公司);小鼠/兔IgG-SABC免疫组化染色试剂盒(SA 1020)、DAB显色试剂盒(AR1022)和 Mayor's苏木素(AR0005)购自武汉博士德生物公司;Hiperfect转染试剂(美国QIAGEN公司);URI siRNA-A片段(前期从siRNAA、siRNA-B、siRNA-C中筛选出来的干扰效果最好的片段)、无关序列片段(苏州吉玛公司);顺铂(美国Selleckchem公司);流式细胞仪、FITC Annexin-V凋亡检测试剂盒(美国BD公司);兔抗人GAPDH抗体(苏州睿瀛公司);HRP标记羊抗兔IgG(美国CST公司);荧光定量PCR试剂盒、荧光定量PCR仪(美国Bio-Rad公司);凝胶成像系统(Gene公司)。
1.2 方法
1.2.1 组织芯片URI检测 采用辣根过氧化物酶法进行组织芯片免疫化学染色,主要步骤:60℃烤片;二甲苯及梯度乙醇脱蜡;枸橼酸盐缓冲液热修复;3%H2O2阻断内源性过氧化物酶;5%BSA封闭液37℃湿盒封闭;4℃湿盒一抗孵育过夜;37℃湿盒二抗孵育;SABC放大;DAB显色,见明显棕色即终止;苏木素复染;脱水;中性树脂立即封片。
组织芯片中URI的表达量由病理学专家在未知URI蛋白性质的情况下盲法进行镜检分析获得,高倍镜(400×)下每个组织点随机选取5个视野计数目标细胞并评分,胃癌组织中选取上皮组织癌细胞计数,癌旁组织中选取正常上皮和良性腺瘤细胞计数,分别判读URI的胞质、胞核染色的染色强度和染色阳性率。细胞染成淡黄色至棕黄色即判断为阳性,染色强度评分标准:阴性为0分;1+为1分;2+为2分;3+为3分。染色阳性率评分标准:阴性为0分,1% ~25%为1分;26% ~50%为 2分;51%~75%为3分;76%~100%为4分。最后以“染色强度评分”和“染色阳性率评分”的乘积为总评分进行分组,胞质表达总评分≤6为低表达组,总评分>6为高表达组;胞核表达总评分≤0为低表达组,总评分>0为高表达组。
1.2.2 细胞培养 胃癌细胞 MGC-803和 SGC-7901在含10%胎牛血清的DMEM培养基中,置于含5%CO2的37℃培养箱中恒温培养,取对数生长期细胞用于后续实验。
1.2.3 细胞转染 取状态良好的对数生长期细胞接种于6孔板,将细胞分为空白组、无关序列组和siRNA URI干扰组,待细胞融合率达70%左右时,无关序列组和siRNA URI干扰组经Opti-MEM与Hiperfect转染试剂混合物分别转染无关序列片段和URI siRNA-A干扰片段,空白组加入等体积Opti-MEM培养基,混匀后置于5%CO2、37℃培养箱中培养。24 h或48 h后提取RNA或蛋白进行后续实验。
1.2.4 qRT-PCR检测转染后细胞URImRNA表达量 细胞转染24 h后收取各组细胞,按照RNA提取步骤提取RNA,紫外分光法测定RNA浓度,根据RNA浓度计算出逆转录所需RNA体积,DNA酶处理后以25℃5 min,42℃30 min,85℃5min反应条件逆转录合成cDNA。将含有2μL cDNA的20μL逆转录体系进行扩增,反应条件为95℃热启动3 min,95℃变性10 s,56℃退火延伸30 s,其中变性和退火延伸共40个循环。扩增产物的特异性由溶解曲线判定,相对定量分析采用2-△△CT法分析。每次实验取3个复孔平均值,取3次独立实验的结果应用GraphPad Prism 7.0进行分析,并绘制柱状图。
1.2.5 蛋白质印迹法检测URI蛋白表达 细胞转染48 h后收集细胞,加入提前配制的细胞裂解液裂解细胞,提取总蛋白,测定浓度;加入5×上样缓冲液和β-巯基乙醇混合物煮沸变性,置于-20℃保存。配制10%聚丙烯酰胺凝胶;提取的蛋白以70 V电泳至标准参照物分开后,再以100 V电泳至结束;4℃条件下350 mA恒流电转膜90 min;5%脱脂牛奶封闭1 h;加入兔抗人URI抗体(1∶1 000)和兔抗人GAPDH抗体(1∶3 000),4℃孵育过夜;TBST洗膜15 min,重复3次;加入兔二抗(1∶5 000),37℃孵育1 h;TBST洗膜3次,每次15 min;ECL显影凝胶成像系统检测结果,每组实验至少重复3次。
1.2.6 流式细胞仪检测细胞凋亡 取对数生长期两类胃癌细胞接种于6孔板,分别设定空白组、siRNA URI干扰组以及顺铂处理的未转染组、无关序列组、siRNA URI干扰组,待细胞融合率达50%~70%时进行细胞转染,48 h后加入含顺铂的培养基诱导细胞凋亡。通过预实验我们选择在细胞多数存活的情况下能导致细胞DNA最大限度损伤的顺铂浓度诱导细胞凋亡,MGC-803细胞为 10μmol/L、SGC-7901细胞为5μmol/L,作用12 h。
胰酶消化细胞收集于EP管,PBS洗涤细胞,取约1×106个细胞,重悬于1 mL 1×结合缓冲液中,混匀后取100μL细胞至流式管中,依次加入5μL FITC AnnexinV和PI,室温避光孵育15 min,检测前每管中加入400μL 1×结合缓冲液,以阳性单染细胞作为对照,1 h内检测,每组实验重复3次。
1.3 统计分析
应用SPSS 22.0进行统计分析。通过配对非参数Wilcoxon检验法分析URI在癌及癌旁组织间的表达差异;URI的表达与临床特征间关系的分析采用Fisher确切概率法;生存率比较采用log-rank检验;多组数据分析采用Levene进行方差齐性检验,若方差齐,则用单向方差分析,若有统计学意义,则进行两两之间比较,两两之间比较采用Bonferroni进行校正,否则用非参数分析,数据用均值±标准差(±s)表示,P<0.05为差异有统计学意义。
2 结果
2.1 URI在胃癌组织的表达及其与临床特征的关系
由于实验过程中脱片、取材等因素的影响,芯片中6例组织点无法判读,最终结果由84例病例共168个点判读统计所得。90例中6例癌和癌旁共12个点被排除,包括 A1,E3,F5,A9,H15,J13点及其对应的癌旁点(图1)。

图1 胃癌组织芯片判读范围
统计结果表明,URI在胃癌组织细胞胞质中的表达明显高于癌旁组织(P<0.05),胃癌组织细胞胞核URI染色总评分均值比癌旁组织高,但差异无统计学意义(P>0.05)。见表1和图2。

表1 URI在胃癌及癌旁组织表达的差异性n=84
进一步分析显示,URI在胃癌组织细胞胞质中的表达与患者性别相关(P<0.05),而与年龄、肿瘤大小、病理分级、有无转移及TNM分期等无关(P>0.05),见表2。采用log-rank检验对胃癌患者URI高、低表达组间的生存率进行比较,结果显示,胃癌组织胞质(χ2=1.888,P>0.05)及胞核(χ2=3.587,P>0.05)URI高、低表达组间患者生存率差异均无统计学意义。
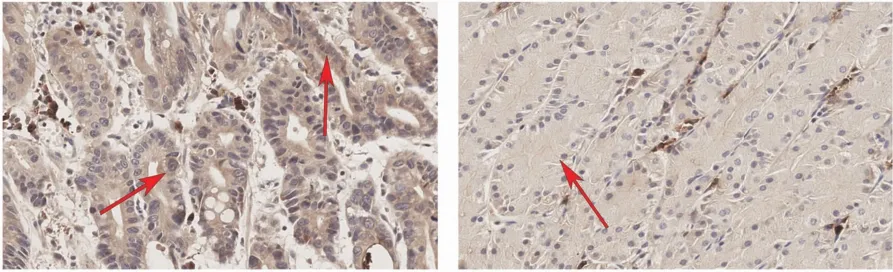
图2 胃癌及癌旁组织URI的IHC染色(×400)

表2 胃癌组织URI表达与临床特征的关系
2.2 URI基因敲低细胞株的验证
qRT-PCR结果显示,URI siRNA-A片段转染24 h后,两种细胞株URImRNA的表达较无关序列转染组显著降低(P<0.01,图3A);蛋白质印迹检测结果显示,URIsiRNA-A片段转染48 h,细胞URI蛋白的表达显著低于无关序列组(P<0.01,图3B)。以上结果表明URI基因敲低表达的两类胃癌细胞株构建成功。
2.3 敲低URI促进顺铂诱导的细胞凋亡
流式细胞术检测结果显示,在MGC-803(图4)和SGC-7901(图5)两株细胞中,未经顺铂处理时,URI siRNA组细胞凋亡率与空白组相比无显著性差异;经顺铂诱导后,URIsiRNA组相较于无关序列组凋亡比例(早期凋亡+晚期凋亡)明显增加(P<0.01)。

图3 两类胃癌细胞URIm RNA和蛋白的表达
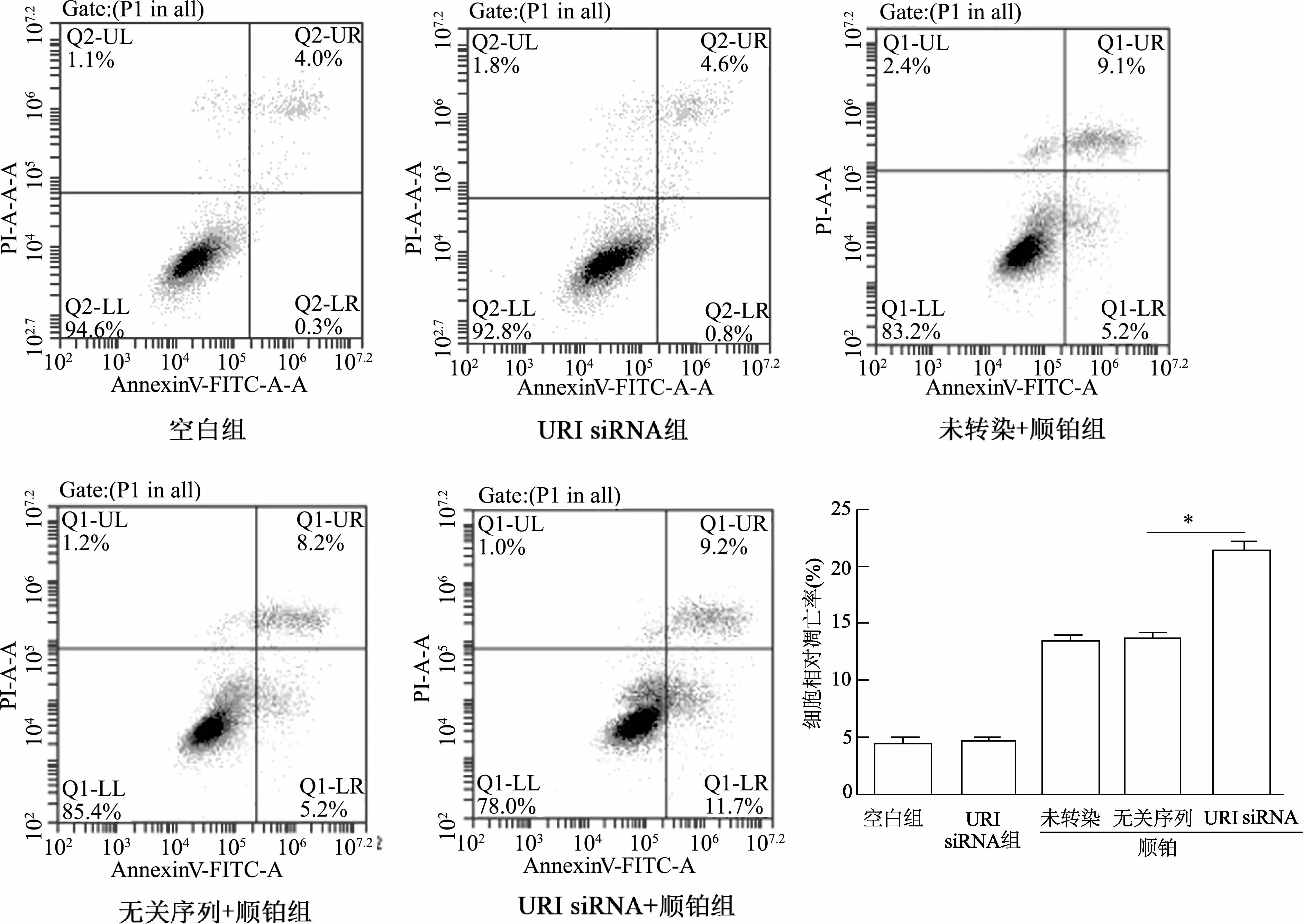
图4 URI对MGC-803胃癌细胞凋亡的影响
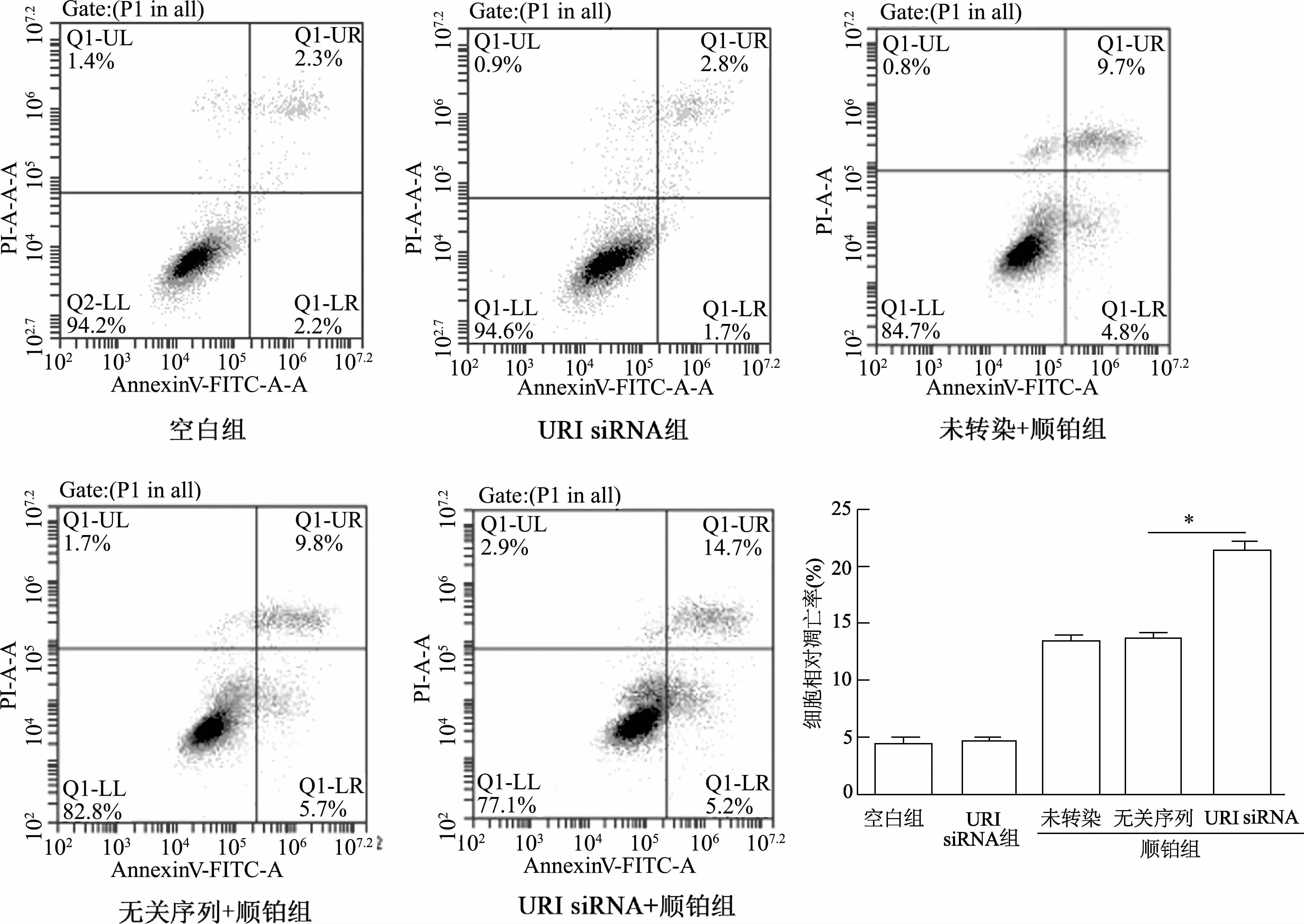
图5 URI对SGC-7901胃癌细胞凋亡的影响
3 讨论
哺乳动物的URI高度保守,广泛存在于细胞胞质、胞核和线粒体中[5,13],并参与组成多种蛋白复合物[4,14]。目前认为URI参与了营养敏感的mTOR通路的调节,但对其与疾病的关系所知甚少。最早基于卵巢癌和肝癌的研究提示URI是一个癌基因[8-9]。我们参与了肝癌的研究[9],此后我们对宫颈癌和胃癌细胞的研究也支持URI具有癌蛋白性质[12,15-16]。原癌基因的扩增或表达活性的增强是癌基因活化的一种机制,本研究中我们发现URI在胃癌组织细胞胞质中的表达明显增加,提示URI同胃癌的发生发展有关。真核细胞中普遍存在PI3K/AKT/mTOR通路,该通路的活化状态影响细胞多种重要生理过程,AKT磷酸化后作用于多种下游底物,包括 mTOR、survivin、Bcl-2、BAD等,影响细胞生长代谢、增殖、凋亡及细胞周期等[17]。URI是mTOR信号通路的磷酸化的靶,参与了对雷帕霉素敏感的信号通路转录的调节。研究发现URI在卵巢癌高表达,并通过抑制PP1γ的活性,持续活化mTOR下游通路,并通过负反馈系统增强S6K1的生存信号,促进卵巢癌细胞的生存,抑制凋亡[8]。mTOR感受营养状态、调节细胞生长的作用主要在胞质中进行,因此我们推测URI主要在胞质中与mTOR通路相互作用,而不是作为转录因子在胞核中发挥作用。
URI的高表达同患者生存期及年龄、肿瘤大小、病理分级、转移、TNM分期等没有显著相关性,提示URI可能主要涉及胃癌的发生机制而不影响胃癌预后。而胃癌组织胞质URI的表达在男女性之间差异有统计学意义,其意义有待进一步研究。Tummala等[10]的动物实验已证实URI参与了肝癌发生机制。持续表达外源性URI的小鼠在8周时出现不同程度肝纤维化,24~54周时出现肉眼可见的腺瘤和早期肝癌,但在第8周停止小鼠URI表达后小鼠肝纤维化减轻,同时肝癌的形成受到抑制,表明URI的持续表达可促进癌前病变和早期肝癌的发生。
原癌基因激活后可通过抑制细胞凋亡、促进细胞存活使细胞发生恶性转化。其中Bcl-2是重要的抑凋亡基因,而Bax的激活促进细胞凋亡。在凋亡信号刺激下,凋亡通路的Caspase-3激活,切割聚腺苷二磷酸 核糖聚合酶(poly-ADP-ribose polymerase,PARP),诱发凋亡。本实验室前期研究中发现在多柔比星作用下,URI能增强Bcl-2的表达并降低Bax的水平,并能增加 Cleaved Caspase-3和 Cleaved PARP-1的水平[12]。顺铂是胃癌化疗常用药物,其导致的DNA双链和单链断裂将诱导细胞凋亡。通常各种因素导致的DNA损伤将激活细胞周期检查点,使细胞阻滞在G1期,以便修复DNA损伤,如损伤不能修复,细胞将发生凋亡[18]。如果受损细胞不能经凋亡清除,DNA损伤的积累有可能使细胞发生恶性转化形成肿瘤。我们通过在两株胃癌细胞中敲低URI的表达,发现URI也能够抑制顺铂诱导的胃癌细胞凋亡,进一步显示URI可能通过抑制或减少细胞凋亡参与了胃癌的发病。
我们将在后续研究中通过建立胃癌动物模型,进一步深入探索URI在胃癌发病中的作用机制。

