磁性载银滤料吸附痕量Hg0再生动力学特性分析
赵 艳,刁永发,周发山,沈恒根
(东华大学 环境科学与工程学院,上海201620)
汞(Hg)是一种具有强挥发性、易迁移性和环境持久性的剧毒污染物。目前,煤燃烧是人为汞排放的主要来源之一,烟气中汞排放比重达到89.52%,单位发电量排入大气环境中的汞量约38.72μg[1]。在较高的烟气温度下主要以Hg0的形态排放,而Hg0难溶于水,且不易被氧化还原,因此,燃煤汞脱除的关键在于Hg0的脱除。在目前的燃煤汞脱除方法中,活性炭及其改性产品的脱除效果较好且技术成熟,然而该方法的脱除成本较高,使用受到限制。贵金属银(Ag)的纳米粒子与Hg0可发生反应生成可逆的银汞齐,对Hg0具有很好的吸附性能。由于生成的银汞齐在惰性气体中易受热分解,可使吸附剂得以再生,循环使用可降低成本,该类Hg0脱除的方法逐渐受到了研究人员的广泛关注。Magdalena等[2]以合成沸石为载体,将纳米Ag负载其上,Ag可与沸石中Na+交换,对Hg0具有较高的吸附性能。Xu等[3]制备了石墨烯载银吸附剂,提高了对Hg0的吸附效率。况敏等[4]研究了活性炭纤维和载银活性炭纤维对Hg0的吸附-再生性能,表明再生过程中载银活性炭纤维相对于活性炭纤维的汞溢出温度范围更广且汞脱附率更高。另外,研究发现铁基吸附剂对Hg0的氧化也具有催化作用。Wu等[5-6]研究证明,纳米铁基吸附剂具有较好的脱除Hg0的能力。孙青柯等[7]以Fe3O4为载体和Ag为活性物质,制备了Fe3O4-Ag脱汞吸附剂,对Hg0的脱除效果较好,脱除能力达到90%以上,由此表明具有高活性的纳米Ag颗粒与Fe3O4结合可增强脱除Hg0的能力。
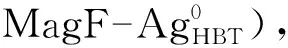
1 试 验
1.1 试验材料和试剂
试验材料为HBT滤料。 选用的试剂为氨水(NH3·H2O)、三氯化铁(FeCl3)、七水硫酸亚铁(FeSO4·7H2O)、乙醇(C2H5OH)、盐酸(HCl)、甲苯(C7H8)、硝酸银(AgNO3)和硝酸(HNO3),表面活性剂为十六烷基三甲基溴化铵(C19H42BrN)、十二烷基苯黄酸钠(C18H29NaO3S),皆为分析纯。
1.2 材料的制备
采用共沉淀法制备纳米Fe3O4,粒径为10~20 nm,分散性较好[11]。制备流程如下: (1)分别称取33.79 g FeCl3·6H2O和34.75 g FeSO4·7H2O,溶于500 mL去离子水中,加入HBT滤料3 g,搅拌;(2)将溶液加热并保持恒温30 ℃,往里滴加质量分数为25%的NH3·H2O溶液,调节溶液pH值至8~9之间;(3)水解完全后,继续搅拌1 h,加入一定量的表面活性剂,反应30 min后用去离子水反复洗涤至中性;(4)将样品置于80 ℃真空干燥箱中干燥2 h,得到磁性HBT滤料样品。
配制银浓度为500 mg/L的银氨溶液,用浓度为2%的稀氨水调节溶液的pH值至9~10之间,将磁性HBT滤料浸入银氨溶液中,在20 ℃恒温水浴中振荡24 h,之后在120 ℃氮气氛围下加热还原6 h,使Ag(NH3)2+充分还原为Ag单质,得到磁性载银HBT滤料。
1.3 试验装置
固定床脱汞试验系统如图1所示,由N2和Hg0蒸气组成模拟烟气。Hg0的浓度通过调节恒温水浴温度进行控制;吸附反应温度的大小采用电加热器控制;通过Mercury Instruments公司生产的VM 3000型烟气测汞仪对痕量Hg0浓度进行在线实时检测,其精度为0.1 μg /m3;系统吸附反应后的废气经处理后排放。
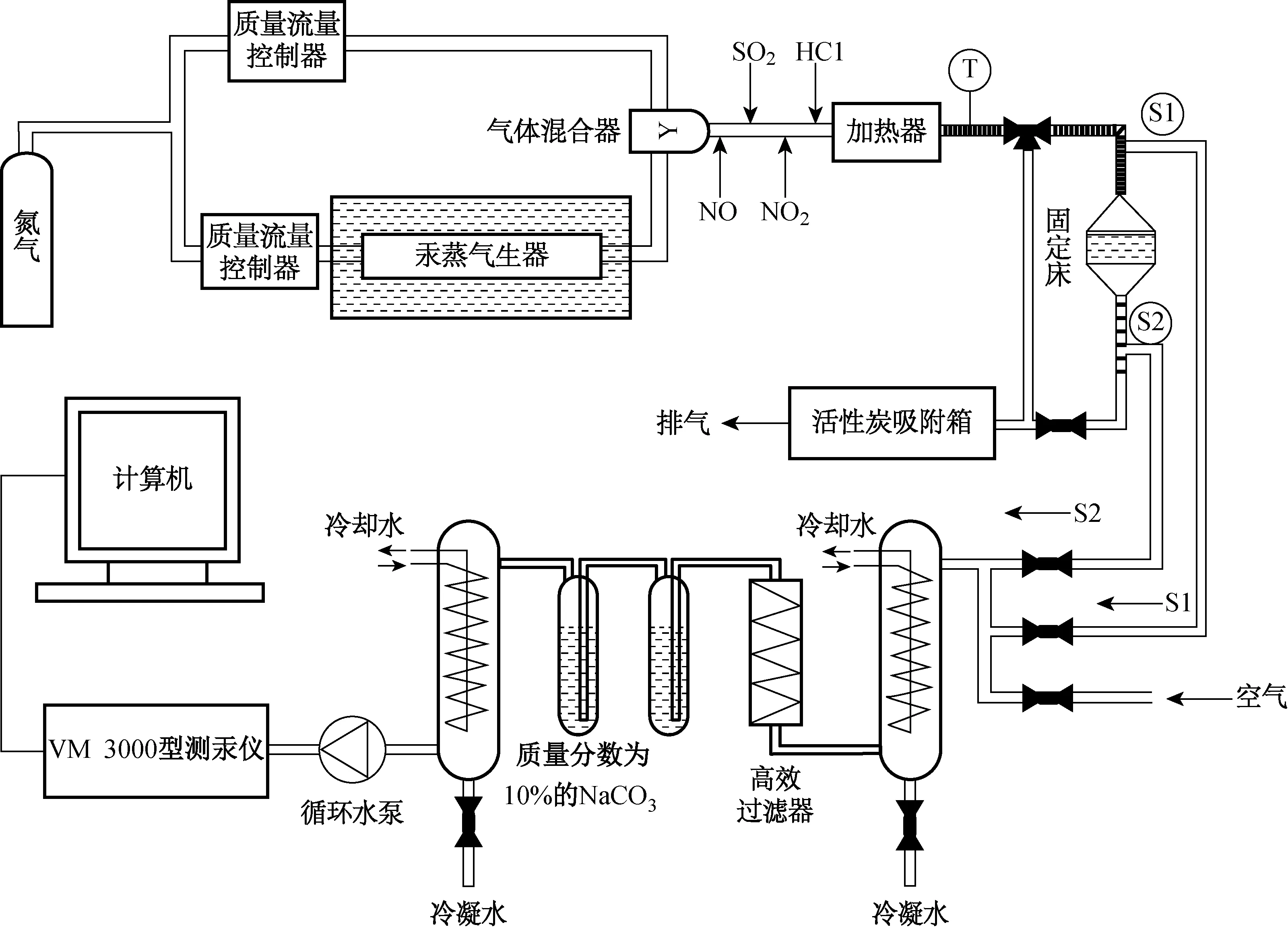
图1 固定床脱汞试验系统图Fig.1 Fixed bed mercury removal experiment system diagram
1.4 试验表示方法
t时刻单位质量的滤料所吸附痕量Hg0的总量(μg/g)用q表示,其计算表达式如式(1)所示。
(1)
式中:m为吸附剂的质量(g);Q为单位时间内吸附剂层的气体流量(m3/min);t为模拟烟气流经滤料的时间(min);ψ为t时刻的穿透率。
2 试验结果与讨论
2.1 X射线荧光光谱(XRF)分析
HBT滤料是由玻璃纤维、聚苯硫酸迷纤维和聚酰亚胺短纤维材料按照非织造技术,经过复杂的加工工艺制作而成的,为增强其耐腐蚀性和憎水性,在外表面用聚四氟乙烯(PTFE)乳液浸泡[12],各纤维层均不含有金属元素,包括Fe、Ag等元素。
为测定HBT滤料的磁性载银过程是否成功,采用日本岛津生产的XRF-1800型波长色散型X射线荧光光谱仪对其元素进行分析测试。仪器最大扫描速度为300 (°)/min;可检测元素范围为9F~92U,检测范围浓度为0.000 1%~100%,局部分析功能分析直径为500 μm。测试结果如表1所示。

表1 磁性载银HBT滤料元素分析数据Table 1 Element analysis data of %
由表1可知:磁性载银HBT滤料中Fe元素质量分数为6.83%,是在共沉淀法磁化磁性滤料时负载到滤料上的;Ag元素质量分数为5.97%,说明对磁性滤料进行纳米银负载是成功的。
2.2 吸附等温线
2.2.1 吸附等温线试验
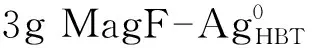
由图2可知,吸附反应温度对磁性载银HBT滤料吸附Hg0的吸附量有较大影响。随着吸附反应温度的升高,磁性载银HBT滤料对Hg0的吸附量先增大后减小,在120 ℃时吸附量达到最大。由此表明,温度过高或过低均不利于Hg0的脱除,在80 ℃时,由于参与吸附反应的分子数目和能量不足,物理吸附占主导地位;当温度升高至120 ℃时,分子间的作用力和能量增强,对Hg0的化学吸附增强,即Hg0与磁性载银HBT滤料表面的银结合生成银汞齐,促进了对Hg0的吸附;温度继续升高至200℃,能量的增加使银汞齐的解吸能力增强[13],最终导致对Hg0的吸附量降低。另外,高温会导致磁性载银HBT滤料表面的部分短纤维焦结,包裹了负载在滤料上的纳米银颗粒[14],减少了吸附活性位,降低了脱汞能力。

图2 磁性载银HBT滤料吸附Hg0的等温线Fig.2 Adsorption isotherms of Hg0
2.2.2 吸附等温线拟合
(2)医学生沟通能力评估量表[3]从自我评价,对环境的适应,沟通的行为方式,沟通主动性以及与病患及其家属的沟通能力五个维度,21个项目综合评估现代医学生沟通能力水平。每题各有5各选项,按照Likert 5级量表法,分为0分(从来不)、1分(很少)、2分(有时)、3分(经常)、4分(大部分)。比较不同性别、不同年级、不同专业和不同课程基础及沟通能力差异程度。
采用Langmuir和Freundlich吸附等温模型对磁性载银HBT滤料吸附痕量Hg0的过程进行拟合。 Langmuir吸附等温模型描述了吸附质在吸附剂表面的单分子层吸附,Freundlich吸附等温式为经验公式,可描述不均匀表面的吸附过程[15],两者的线性公式分别如式(2)和(3)所示。
(2)
(3)
式中:qeq为Hg0吸附平衡量的试验值(μg/g);ceq为吸附平衡时Hg0浓度(g/m3);k为Langmuir吸附平衡常数(m3/g);kf和n为Freundlich经验常数。磁性载银HBT滤料对Hg0的Langmuir和Freundlich吸附等温模型如图3和4所示,拟合所得参数如表2所示。
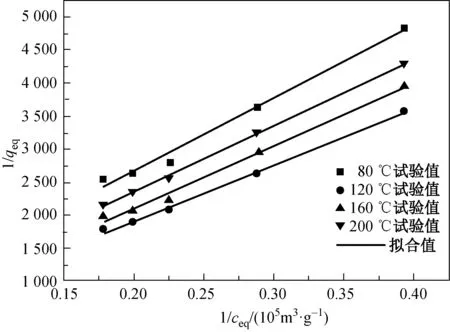
图3 磁性载银HBT滤料吸附Hg0的Langmuir等温模型Fig.3 Langmuir adsorption isotherm model of Hg0 onto
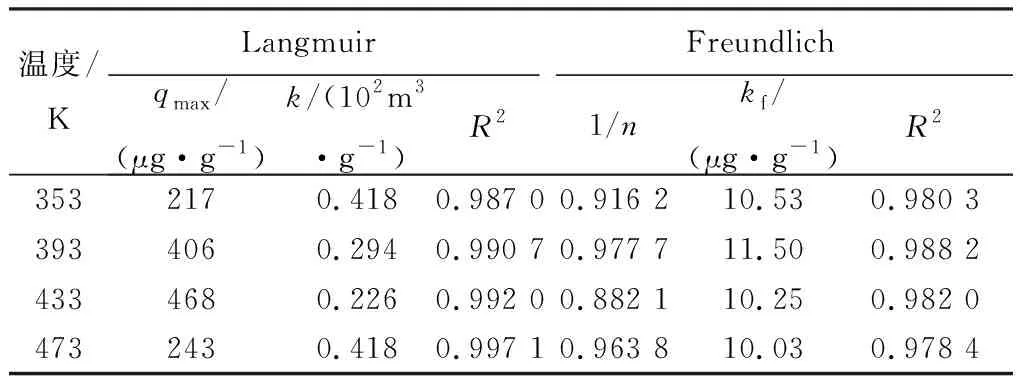
温度/KLangmuirFreundlichqmax/(μg·g-1)k/(102m3·g-1)R21/nkf/(μg·g-1)R23532170.4180.987 00.916 210.530.980 33934060.2940.990 70.977 711.500.988 24334680.2260.992 00.882 110.250.982 04732430.4180.997 10.963 810.030.978 4
由图3和4可知,随吸附反应温度持续升高,滤料表面有限的吸附活性位点并不能吸附更多的Hg0。由表2可知:Langmuir模型对磁性载银HBT滤料吸附Hg0过程的拟合相关度R2更高,说明Langmuir模型能更准确地描述该吸附行为,即磁性载银HBT滤料对Hg0的吸附为单分子层吸附;Freundlich模型中n>1,说明Hg0易于被磁性载银HBT滤料吸附。
2.3 磁性载银HBT滤料的再生
2.3.1 再生次数对磁性载银HBT滤料脱汞效果的影响
为了降低磁性载银HBT滤料脱除痕量Hg0的使用成本,采用热解法对吸附Hg0后的磁性载银HBT滤料进行Hg0的脱除,即通过加热使得生成的银汞齐分解,将Hg0从磁性载银HBT滤料微孔中溢出,使磁性载银HBT滤料获得再生。当再生温度为240 ℃时,对其进行了5次吸附-再生循环脱Hg0效率的试验,结果如图5所示。
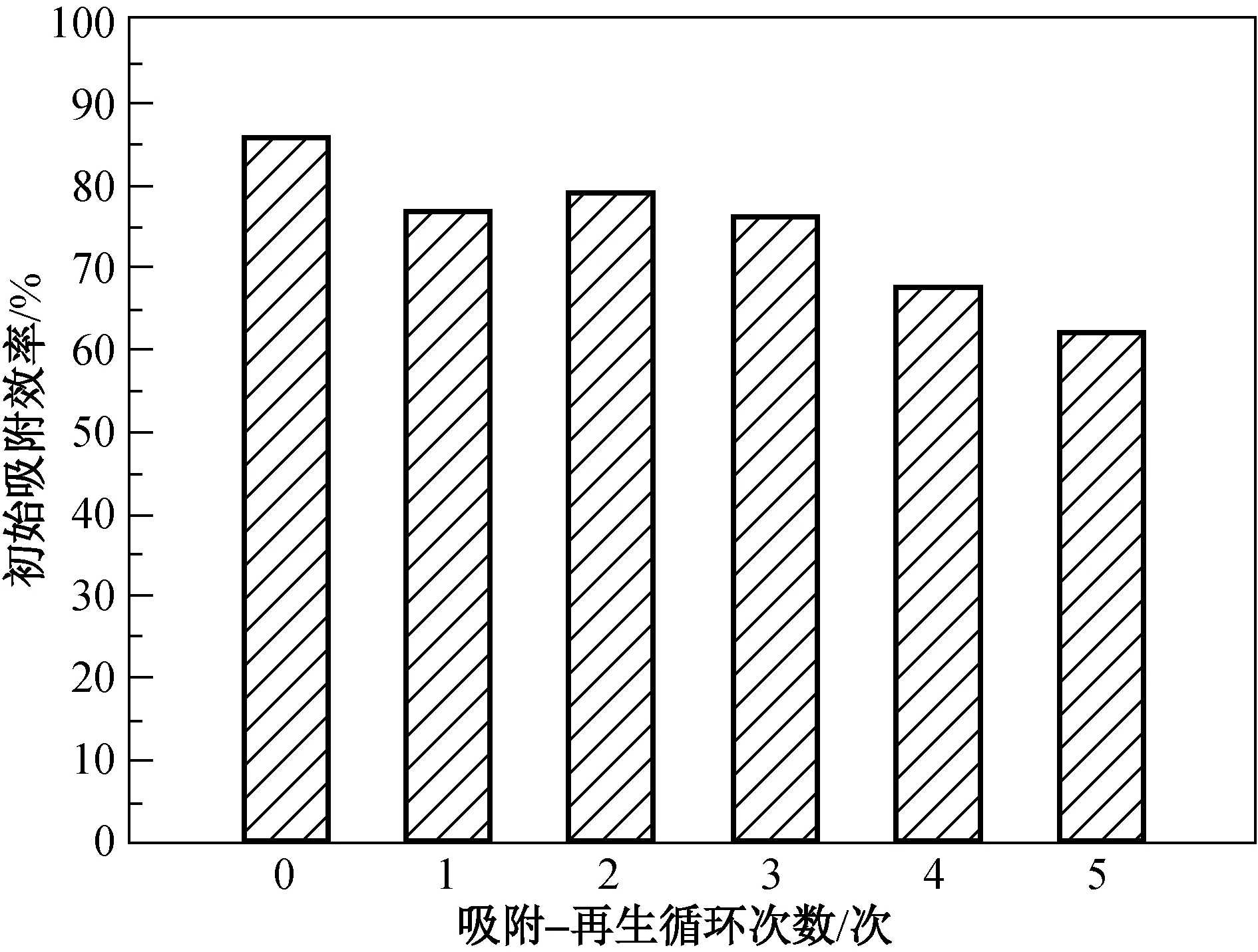
图5 再生次数对磁性载银HBT滤料脱汞性能的影响Fig.5 Effect of regeneration times on mercury removal performance of
由图5可知,磁性载银HBT滤料在第1次加热再生后,初始吸附效率降低,当第2次加热再生后吸附效率有所升高,在第4次加热再生后初始吸附效率下降幅度有所增加,经过5次加热再生后,初始吸附效率仍保持在61.75%。造成前两次变化的原因可能为: 第1次再生后磁性载银HBT滤料表面吸附态的汞没有完全脱附,占据着吸汞的活性位,因此初始吸附效率会有所降低;在经过第2次加热再生后,磁性载银HBT滤料在惰性气体氮气的保护下受热,引起表面的Ag2+转化为Ag0,以及部分内部的Ag0转移到表面,从而又提高了对汞的脱除能力[16-17],初始吸附效率有所提高。
2.3.2 再生过程前后的吸附动力学分析
为了测定磁性载银HBT滤料对Hg0吸附-再生前后动力学曲线,将入口Hg0浓度设定为44.3 μg /m3,在温度80和120 ℃条件下,对磁性载银HBT滤料进行首次和5次循环再生后吸附Hg0动力学分析,分析温度因素对吸附行为的影响。
准一级动力学方程[19]如式(4)所示。
ln(qeq-qt) =lnqeq-knt
(4)
准二级动力学方程如式(5)和(6)所示。
(5)
(6)
式中:qeq为Hg0吸附平衡量的试验值(μg/g);qt为t时刻Hg0在滤料上的吸附量(μg/g);kn为吸附准一级动力方程的速率常数(1/min);h为初始吸附速率(μg/(g·min));km为准二级速率方程的速率常数(g/(μg·min))。在惰性气体氮气氛围下,吸附-再生前后吸附动力学的拟合结果如图6和7所示,计算的动力学参数分别如表3和4所示。

(a)准一级动力学拟合
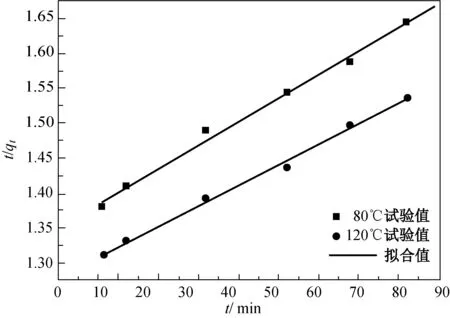
(b)准二级动力学拟合图6 磁性载银HBT滤料首次吸附Hg0的动力学拟合Fig.6 Kinetic fitting of the first adsorption of Hg0 by
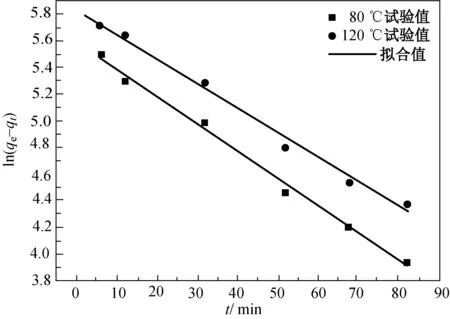
(a)准一级动力学拟合
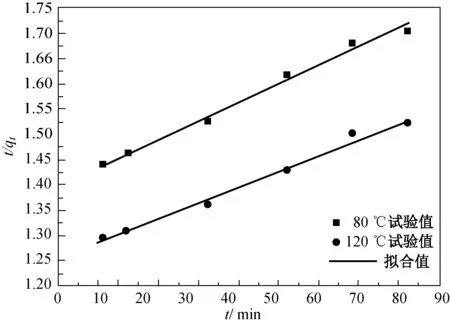
(b)准二级动力学拟合图7 磁性载银HBT滤料5次吸附后的动力学拟合Fig.7 Kinetic fitting of after five times adsorption表3 准一级和准二级吸附动力学模型确定 的首次吸附Hg0的动力学参数 Table 3 Quasi-first-order and quasi-second-order adsorption kinetic model to determine the kinetic parameters of the first time adsorption of Hg0

温度/℃准一级准二级qeq/(μg·g-1)kn/min-1R2qeq/(μg·g-1)km/(106g·μg-1· min-1)R280452.140.0330.987 3363.257.960.991 5120543.920.0300.985 9454.836.500.996 3
由表3可知,在Hg0初始浓度为44.3 μg /m3,吸附反应温度分别为80和120 ℃的试验条件下,通过准二级动力学模型拟合计算的相关系数R2更接近1,说明准二级动力学模型能更准确地描述磁性载银HBT滤料首次吸附Hg0的过程,所计算的吸附量更接近试验所得吸附量。当吸附温度为120 ℃时,通过准二级动力学模型计算的吸附量为454.83 μg/g,相比温度为80 ℃时的吸附量大,符合试验计算结果。通过qeq和km计算出吸附过程中的初始吸附速率h,当温度为80 ℃时,吸附速率h为1.05 μg/(g·min),当温度为120 ℃时,吸附速率h为1.34 μg/(g·min)。磁性载银HBT滤料的吸附速率主要是受吸附质Hg0与吸附剂滤料之间的电子转移的化学作用所控制[15]。

表4 准一级和准二级吸附动力学模型确定

3 结 语
本文对袋式除尘器中常用耐高温HBT滤料进行磁性载银处理,考察磁性载银HBT滤料在不同温度、不同Hg0入口浓度时对痕量Hg0的吸附性能,进行吸附等温分析,并考察其再生性能及再生前后的动力学拟合分析,结论如下:
(1)通过X射线荧光光谱分析可知,磁性载银HBT滤料中Ag元素质量分数为5.97%,Fe元素质量分数为6.83%,磁性载银过程是成功的。
(2)吸附反应温度对磁性载银HBT滤料的Hg0吸附量有较大影响,随着吸附反应温度的升高其对Hg0的吸附量先增加后减小。
(3)相对Freundlich模型,Langmuir模型能更好地描述磁性载银HBT滤料对Hg0的吸附行为,说明磁性载银HBT滤料对Hg0的吸附为单分子层吸附。
(4)在240 ℃再生温度下,磁性载银HBT滤料经过5次再生后的初始吸附效率仍保持在61.75%,具有较好的再生性能。
(5)准二级动力学模型能更准确地描述磁性载银HBT滤料首次吸附Hg0的过程,而准一级动力学模型能更确切地描述其5次再生后吸附Hg0的过程。

