光生物反应器内CO2传输与微藻固碳性能强化
胡自明,夏 奡,黄 云,廖 强,付 乾,朱 恂
光生物反应器内CO2传输与微藻固碳性能强化
胡自明1,2,3,夏 奡1,2*,黄 云1,2,廖 强1,2*,付 乾1,2,朱 恂1,2
(1.重庆大学低品位能源利用技术及系统教育部重点实验室,重庆 400030;2.重庆大学工程热物理研究所,能源与动力工程学院,重庆 400030;3.中国电力工程顾问集团西南电力设计院有限公司,四川 成都 610021)
CO2气体可为微藻光合作用提供必需的碳源,CO2在藻液中的混合、溶解及传输特性显著影响了微藻的生长固碳.在微藻光生物反应器中,气泡在藻液中的生长、脱离、聚并、上升等动力学行为主要由气体分布器决定.本文以气体分布器为研究对象,研究在不同孔径及孔间距下对15%(/) CO2气体在悬浮液中的气泡行为、CO2溶解与混合特性以及对微藻生长固碳的影响.结果表明:气泡上升速度随气体分布器孔径及孔间距的减小而减小,导致CO2气泡在藻液中停留时间增加,强化了CO2溶解传输,CO2体积传质系数提高了143%,混合时间降低了24%,最终使微藻生物质浓度提高18.8%,固碳速率提高23.2%.
气体分布器;孔尺寸;气泡;CO2传递;微藻
CO2是微藻进行光合作用的主要碳源,废水中含有微藻生长所需的氮磷营养元素,因而微藻可通过生物固碳缓解温室效应并净化污水[1-3].微藻细胞通过利用CO2和光能进行光合作用合成有机物并释放氧气实现光合固碳[4].微藻悬浮式培养常用的反应器分为开放式反应器与封闭式反应器,可以通过对光、营养物质、供碳方式等各方面进行调控,提高微藻的生长以及固碳效率[5-6].在光生物反应器中,一定浓度的CO2气体通过气体分布器产生气泡进入到微藻悬浮液中,提供微藻生长所需碳源,静止的悬浮液由于气泡的上升运动而形成剪切力驱动藻液循环流动.在气泡的上升过程中,CO2分子先后穿过气膜和液膜,从气泡内扩散进入藻液中并溶解, 接着被游离的藻细胞所捕获,通过光合作用产生有机物实现对CO2的固定[7].由于藻细胞会吸附在气液相界面上,这种气泡携带现象会影响着微藻在反应器内的分布,进而影响微藻生长[8].因此,光生物反应器内的气液两相流动特性同时影响着CO2的传递过程与微藻的分布状况,进而影响微藻的光合固碳.
作为产生气泡的鼓气装置,气体分布器的结构会显著影响气泡生长、脱离、聚并、上升等动力学行为,进而影响反应器内的液相的湍流混合与CO2传递过程[9].目前光生物反应器中多采用由高温煅烧而成的氧化铝气体分布器和水产养殖中常用的矿砂气泡石,但其表面结构粗糙,容易滋生微生物,而且气孔容易堵塞,加之孔隙度大小不一,出气不均匀,亟待更高效的气体分布器用于微藻培养中[10],使气泡分布尽可能均匀以避免出现死区导致局部藻液沉降,同时要求生成气泡上升过程剪切力不能过大而对藻细胞造成损伤.通过对布置在反应器底部的布气孔板的结构尺寸优化可以显著降低气泡对藻细胞的携带作用并提高微藻生物质产量[9],但是全局鼓泡受限于特定的反应器结构,在大尺寸微藻反应器中应用有局限性.射流震荡气泡发生器等新型气体分布器可以显著降低气泡的直径,进而提高微藻生长速率[11-13],然而对悬浮液中的气泡行为、CO2溶解特性及藻细胞混合特性仍需要进一步深入研究.
由于气体分布器的结构能显著影响气泡的浮升行为与反应器的混合特性,进而影响气液传质、藻细胞分布与藻细胞对光能及碳源的利用[14],因此对光生物反应器中气体分布器的结构进行优化对微藻的生长及固碳具有重要意义.本文以易于与反应器组合的管式气体分布器为研究对象,研究不同孔尺寸及间距的气体分布器对15%(/)CO2气体在悬浮液中的气泡行为、CO2溶解与混合特性以及对微藻生长固碳性能的影响,为微藻大规模培养中的气体分布器设计提供实验指导,提高微藻生物固碳和减排CO2效率.
1 材料与方法
1.1 实验系统
实验系统如图1所示,其主要由平板式光生物反应器、气体供应系统以及数据采集与测试系统组成.气体供应系统主要由N2和CO2气瓶、压力表、质量流量计等组成.纯CO2(99.99%)和N2完全混合得到浓度为15%的CO2气体,经气体分布器进入到装有微藻悬浮液的平板式光生物反应器中,形成气泡流为微藻生长提供碳源.微藻悬浮液的浓度由其光学密度OD680nm进行表征,使用紫外可见分光光度计(TU1901,680nm波长段)进行测量.其中,平板式反应器由有机玻璃板加工制作,其内部空腔尺寸为160mm×40mm×240mm(长×宽×高),实际工作体积为1.2L.管式气体分布器由橡胶管(管长160mm,外径9mm,内径6mm)加工而成,出气孔口单排等间距均匀分布在管壁上.

图1 实验系统示意 Fig.1 Schematic of the experimental system
1.2 实验测量方法
1.2.1 气泡动力学行为 气泡动力学行为通过可视化实验获得,该实验部分由冷光源、高速摄像仪以及数据存储系统等构成,高速摄影仪(Phantom V5.1)捕捉记录气泡的生长、脱离及上升过程,拍摄帧率为1000fps,拍摄分辨率为1024pixels×720pixels,利用 Matlab软件对得到的图像进行编程处理,首先将图形处理为灰度图,再按照Candy算子提取气泡边界从而得到气泡的脱离直径与上升速度等特征参数[15].气泡的生成时间从连续拍摄3s的3000张照片中获取.气泡在溶液中的停留时间根据上升速度进行折算.实验中随机选择15个气泡进行特征参数的提取,取其算数平均值.
1.2.2 溶解的CO2浓度 溶解CO2浓度采用溶解CO2传感器(InPro5000i/120Mettler Toledo)在线测量.先将99.99%的氮气通入纯水或一定浓度的微藻悬浮液中,通气0.5h以去除溶液中的溶解二氧化碳.再向反应器中通入15%CO2的混合气,维持溶液温度为25℃,在线测量60min内反应器中溶解的CO2浓度的变化,每30s记录一次数据.
1.2.3 体积传质系数 CO2气体的体积传质系数是表征CO2传质能力的重要参数,其物理意义为气体通过气液相界面进入气相或者液相的扩散速率,可根据文献中的气液传质方程计算得到[16].
1.2.4 混合时间 混合时间是表征反应器宏观混合程度的主要参数,混合气经气体分布器在光生物反应器中形成气泡流,带动溶液循环流动,影响着反应器内的湍流混合状态.其定义为注入示踪剂后,溶液浓度达到最终稳定浓度值95%的时间[17].其测量方法为在通气条件下,在反应器的一侧加入盐酸(12%,/)调节水溶液的pH值(到3.1±0.1),在另一侧加入碱性示踪剂(每1L的溶液中加入0.12mL的浓度为4mol/L的氢氧化钠).加入示踪剂后开始计时,记录pH值达到最终稳定值的95%时所需的时间,即为溶液的混合时间.
1.2.5 微藻培养 实验中使用的藻种为普通小球藻(,FACHB-31),采用改进版的BG11(Blue-Green Medium)培养基[18].
使用平行排布的荧光灯作为微藻生长的光源,并进行24h连续光照,其光照强度采用辐照计(FZ-A)进行测量,实验中微藻生长的光照强度均为120 μmol/(m2·s),CO2混合气浓度和通气流量由气体质量流量计(FMA-2606A, Omega, Switzerland) 进行控制,其CO2浓度为15%,通气流量为120mL/min,通气率(air volume/culture volume/min)为0.1vvm,运行温度由人工恒温室控制在25°C.初始接种时,光生物反应器内微藻浓度为0.10g/L.
微藻生物质浓度测量时取10mL藻液,在离心机(GL-21M)8000r/min的转速下离心10min,去掉上清液,将收获的藻泥置于真空干燥箱(DZF-602) 105℃下烘干24h至恒重,采用分析天平(BP114,sartorius)测得生物质浓度.
藻细胞的总有机碳(TOC)浓度测量时取1mL藻液,用去离子水稀释一定倍率后采用TOC分析仪(Multi N/C 3000analyzer,Analytikjena)进行测量.
微藻悬浮液的溶解CO2浓度、溶解氧浓度(DO)分别由溶解CO2传感器(InPro5000i/120Mettler Toledo),溶氧仪(Seven2Go pro,Mettler Toledo)直接在藻液中进行在线测量.
1.3 微藻生长及固碳评价指标
1.3.1 生物质产率 生物质产率[g/(L·d)]定义为微藻平均每天的生物质浓度的变化量,反映了微藻的生长状况,其计算公式如下[7]:

式中:D为在第d的微藻生物质浓度(g/L),0为初始时刻微藻生物质浓度(g/L).
1.3.2 固碳速率 固碳速率[g/(L·d)]定义为单位时间内单位体积的微藻悬浮液的固定CO2量,其计算公式为[19]:

式中:C为藻细胞中的碳含量(%,/),其值一般为0.507;CO2和C分别为CO2和碳的相对分子质量.
2 结果与讨论
2.1 孔径对气泡行为及CO2溶解和混合特性的影响
通过对微藻悬浮液中气泡行为进行可视化实验,获得了气体分布器的出气孔径对不同浓度微藻悬浮液中气泡的脱离直径、生成时间和上升速度的影响.实验选用孔间距为10mm的不同孔径的气体分布器进行比较.由图2(a),2(b)可知,随孔径的增加,气泡的脱离直径与生成时间也随之增加,这是由于孔径越大,气液相接触线较长,气泡所受表面张力越大,气泡脱离所需的浮升力越大,因而气泡的脱离体积较大[20],生成时间也越长.由于在微藻悬浮液中气泡所受表面张力小于纯水中,且浓度越高表面张力系数越低[15],加之气泡表面富集大量的微藻细胞对CO2气泡的消耗,加速了CO2的跨膜传递与气泡的收缩,因而气泡脱离直径随藻液浓度的增加而降低,气泡生成时间也具有类似规律.
图2(c),2(d)是孔径对气泡上升速度变化的影响,由于孔径越大气泡的脱离直径越大,气泡所受的浮升力也越大,因而孔径越大气泡的上升速度与加速度越大,气泡在溶液中的停留时间则越小.另外在微藻悬浮液中,由于藻细胞在气泡表面的吸附增加了气泡的密度,并且藻液的粘度大于纯水中,这使得气泡的上升所受的相间曳力更大,因而气泡上升速度随藻液浓度的增加而降低.
基于上述气泡行为的研究,对气体分布器孔径对15%CO2气体在微藻悬浮液(OD680nm=1)与纯水(OD680nm=0)中的溶解特性进行了比较.由图3(a)可知,气体分布器的孔径越小,CO2扩散速率越快,溶解所需时间越短,溶解效率也越高.这是由于孔径越小,气泡的脱离直径越小,相同流量下的气液相界面接触面积越大,加之气泡的上升速度越小,相同培养液深度下气泡在溶液中的停留时间越长,促进了CO2从气相到液相的传质.由于微藻细胞对CO2的消耗以及溶液性质的不同,这使得相同时间内在微藻悬浮液中的溶解CO2浓度反而要小于在纯水中.
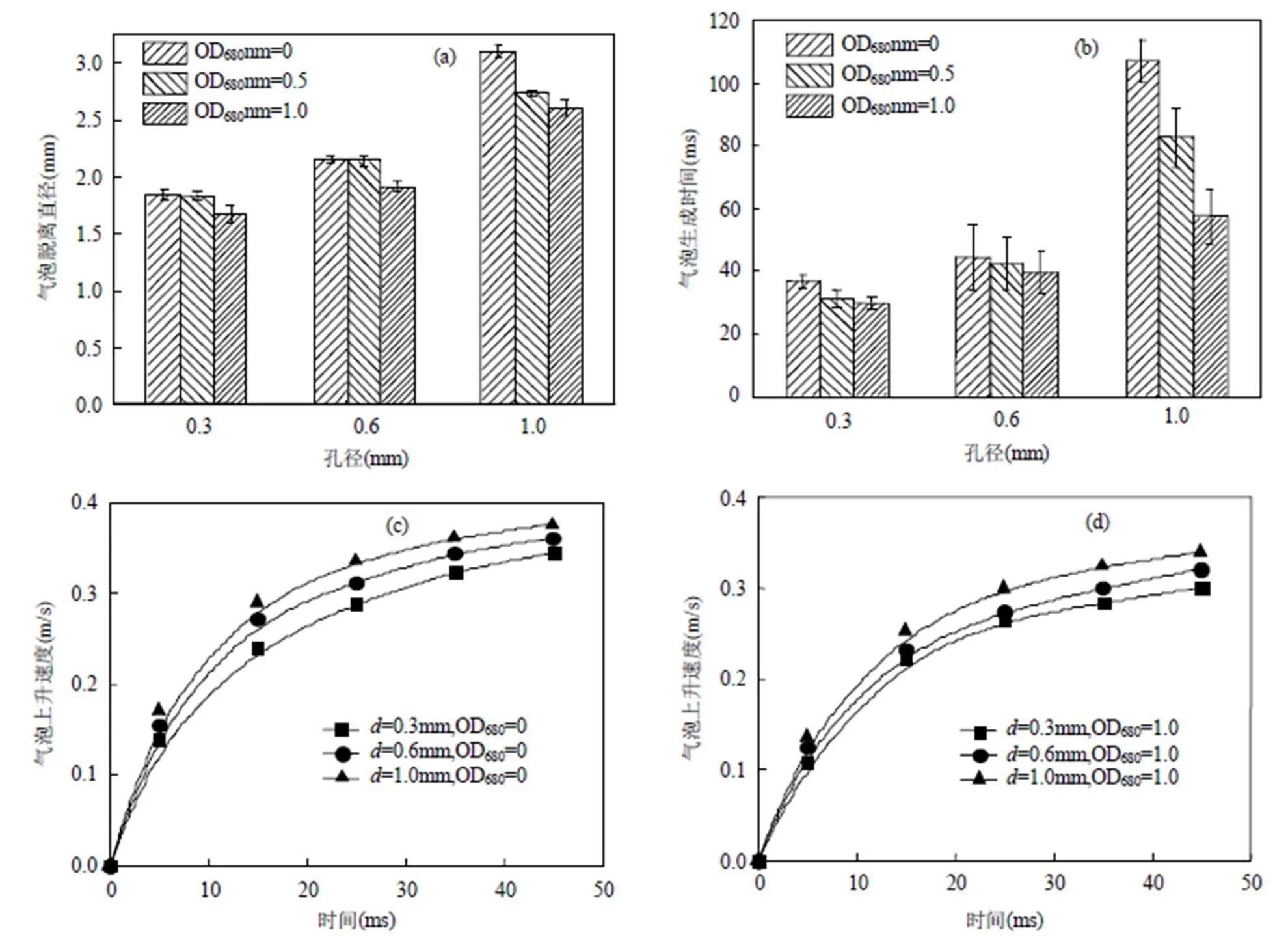
图2 气体分布器中出气孔径对不同浓度微藻悬浮液中气泡的(a)脱离直径, (b)生成时间, (c,d)上升速度的影响
含CO2气泡在微藻悬浮液中不仅仅是提供微藻生长所需碳源,气液两相流动对液相的湍流混合会影响着CO2传递特性,进而影响着微藻的生长及固碳特性.因而CO2的溶解以及微藻悬浮液的混合状况是影响着微藻生长的两个重要因素.图3(b)为孔径对混合时间及体积传质系数的影响.由图可知,在15%CO2的进气浓度和0.1vvm的通气率下,当孔径从1.0mm减小到0.3mm,体积传质系数提高了68.8%,从0.0586min-1增加到0.0989min-1,混合时间降低了11.4%,从35s减小到31s.在鼓泡流中,气泡与液相存在速度滑移,在剪切应力作用下带来一定程度的脉动耗散,影响反应器内的湍流混合状况[21].由此可见,相同流量下小孔径形成的多而小气泡,不仅促进CO2传质与溶解,也促进了反应器内溶液的混合.


图4 不同孔径下气体分布器通气压力随气体流量变化
由图4可见,随着孔径的减小,由于气体分布器的流通面积减小,单个出气孔的局部阻力增加,相同气体流量下通气压力随之增加.同样的孔径下,通气压力与气体流量呈线性关系,而斜率则是由气体分布器的结构所决定的.
2.2 孔间距对气泡行为及CO2溶解和混合特性的影响
基于上述研究,选取最佳孔径=0.3mm,对气体分布器的孔间距对不同浓度微藻悬浮液中气泡的脱离直径、生成时间和上升速度的影响进行了研究.由图5(a),5(b)可知,随孔间距的增加,气泡的脱离直径随之增加,而生成时间是先增加后减小的趋势.这是由于孔间距越大,出气孔口数量越少,相同通气量下单个出气孔口的气体流量增加,气泡所受气体动量力作用增大,使气泡生长加快,气泡体积增加,脱离直径也随之增加,同时由于气泡生长时间较短,随着主气泡的脱离,微小孔口出现许多微小的尾气泡并迅速与主气泡发生聚并,这种气泡涌入现象[22]也造成了气泡的脱离直径变大.当孔间距过小时,单个出气孔口的气体流量较小,气泡脱离直径也较小,同时相邻气孔生成的气泡会发生聚并,在发生聚并前两气泡各自独立生长,一旦表面相互接触,先是相互挤压变形至液膜破裂,在2~3ms内迅速脱离,因而相较于正常生长气泡,聚并气泡的生长时间更短,脱离直径更小.
图5(c),5(d)是孔间距对气泡上升速度变化的影响,由于孔间距越大气泡的脱离直径越大,气泡所受的浮升力也越大,因而孔间距越大气泡的上升速度与加速度也越大,气泡的停留时间越短.同时在藻液中气泡的上升速度要小于在纯水中.
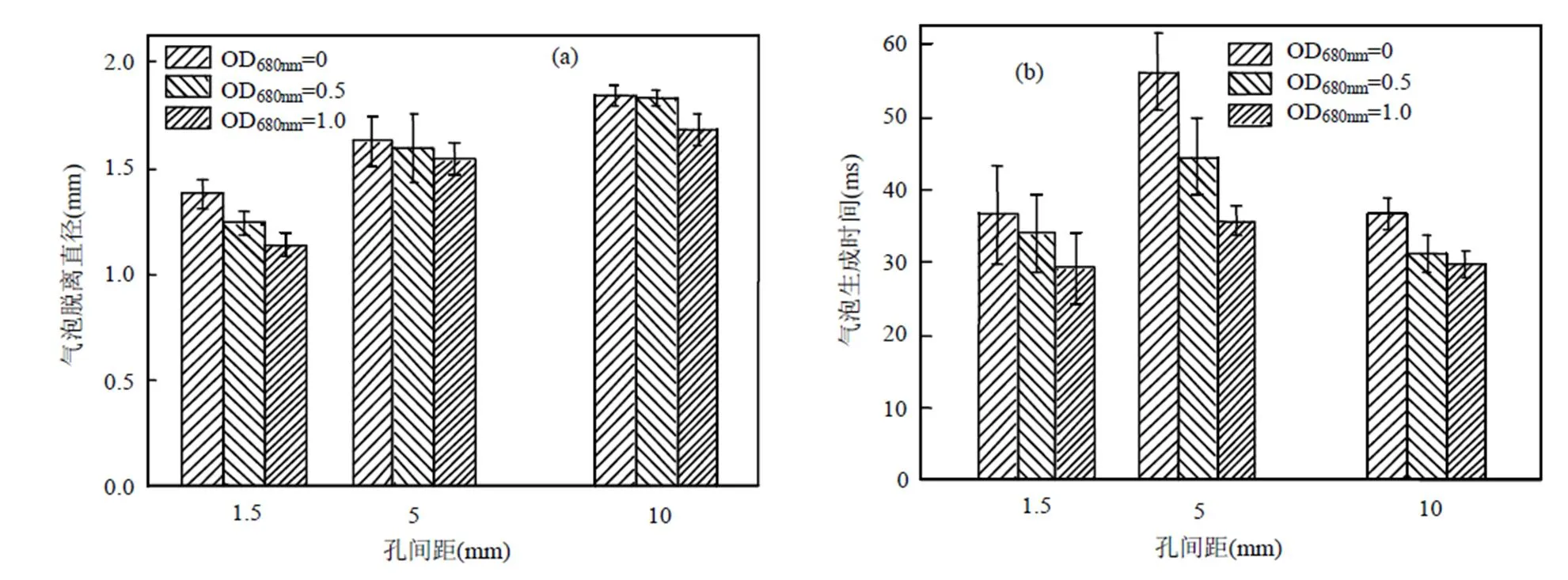

图6 气体分布器的孔间距对(a)15%CO2溶解以及(b)混合时间及体积传质系数的影响
基于上述气泡行为的研究,将气体分布器孔间距对15%CO2气体在微藻悬浮液(OD680nm=1)与纯水(OD680nm=0)中的溶解特性进行了比较.由图6(a)可知,当孔径为0.3mm孔间距为1.5mm时,此时CO2扩散速率最快,溶解所需时间最短,溶解效率也最高.这是由于气体分布器的相邻孔口由于孔间距过小以至于相邻气泡发生聚并,气泡的脱离直径最小,相同流量下的气液相界面接触面积最大,加之气泡的上升速度最小,气泡在溶液中的停留时间最长,促进了CO2从气相到液相的传质.由于微藻细胞对CO2的消耗以及溶液性质的不同,这使得相同时间内在微藻悬浮液中的溶解CO2浓度反而要小于在纯水中.
图6(b)为孔间距对混合时间及体积传质系数的影响.由图6(b)可知,在15%CO2的进气浓度和0.1vvm的通气率下,当孔间距从10mm减小到1.5mm,体积传质系数提高了43.8%,从0.0989min-1增加到0.1422min-1,混合时间降低了13.9%,从31s减小到26.7s.通过对气体分布器的孔间距进行优化,让气泡在独立生长完全之前发生聚并现象,较小的脱离直径、较大的气液接触比表面积与较长的停留时间促进了CO2传质与溶解,且聚并气泡脱离后的震荡对气液界面的扰动增加了反应器内溶液的混合程度.
由图7可见,随着孔间距的减小,开孔数目的增多,气体分布器的流通面积增加,相同通气流量下通气压力随之减小.同样的孔间距下,通气压力与气体流量呈线性关系.
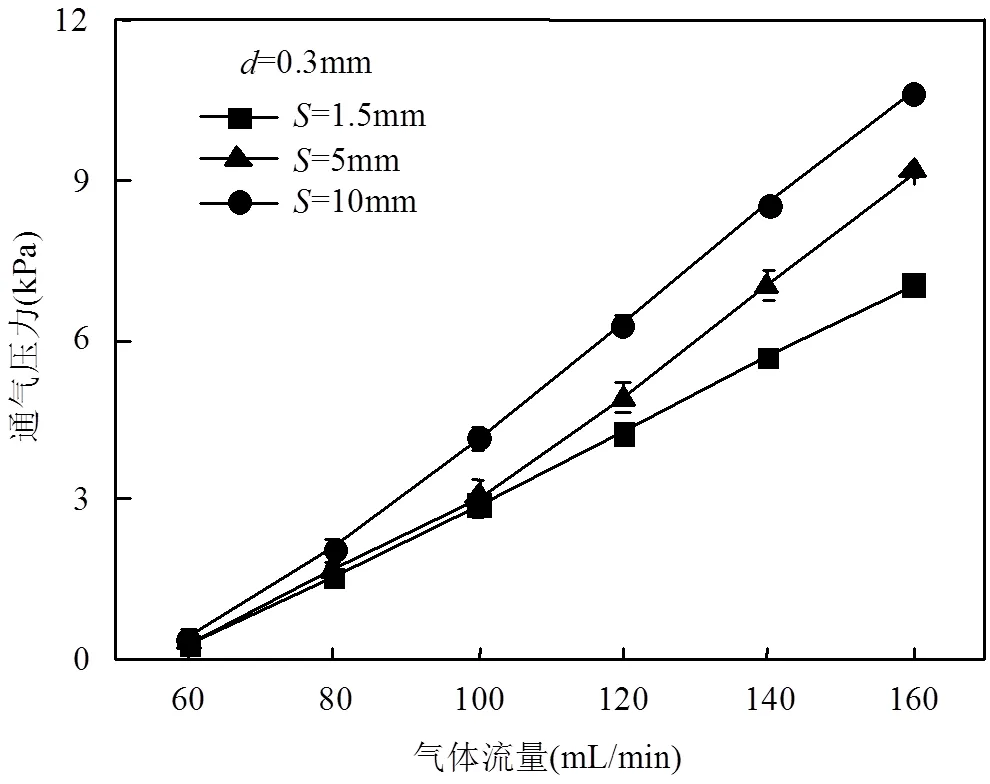
图7 不同孔间距下气体分布器通气压力随气体流量的变化
2.3 气体分布器结构对微藻生长及固碳的影响
由于气体分布器的结构参数对气泡的生长、脱离及上升过程具有较大影响,进而影响光生物反应器内的CO2传递与混合情况,并最终对微藻的生长和固碳性能产生影响.因此,基于前述对气泡行为以及CO2溶解与混合特性的研究,在入口浓度为15%,通气率为0.1vvm通气条件下,对两种管式气体分布器(优化前的孔径=1mm孔间距=10mm与优化后的孔径=0.3mm孔间距=1.5mm)在气升式光生物反应器内进行微藻的生长实验.图8为2种结构参数下对微藻生物质浓度、藻细胞总有机碳浓度和悬浮液溶解CO2浓度、溶解氧浓度的影响.由图8(a)可知,优化后的结构较优化前的生物质浓度提高了18.8%,从2.205g/L增加到2.619g/L,藻细胞总有机碳浓度提高了21.8%,从1120mg/L 增加到1364mg/L.由前述研究可知:气泡脱离直径(OD680nm=0)降低了55.6%,从3.11mm减小到1.38mm ;气泡生成时间(OD680nm=0)降低了65.4%,从107ms减小到37ms;气泡上升速度(OD680nm=0)降低了18.4%,从0.38m/s减小到0.31m/s;气泡停留时间(OD680nm=0)延长了22%,从而促进CO2的传递,使体积传质系数提高了142.7%,从0.0586min-1增加到0.1422min-1.另外,聚并气泡脱离后的震荡对气液界面的扰动增加了反应器内溶液的混合程度,其混合时间降低了23.7%,从35s降低到26.7s,混合程度的增加提高了藻细胞的分布均匀性和光暗循环频率[23],同时缓解了藻细胞的沉降,进而促进微藻生长.因此,使用优化后的气体分布器使微藻具有较高的生物质产率0.546g/(L·d)与较高固碳速率1.015g/(L·d),相比于优化前,分别提高了21.6%与23.2%,如表1所示.由图8(b)可知,经气体分布器结构优化,微藻悬浮液中的溶解CO2浓度较高,而溶解氧浓度大幅下降,即有利于反应物CO2的溶解传递和生成物O2的析出,促进了微藻光合作用正反应的进行.在培养第7d,溶解CO2浓度分别为163与145mg/L,溶氧浓度分别为5.12与2.87mg/L,这是由于较高的体积传质系数有利于藻液中的CO2溶解与氧解析[24].气泡越小,混合越充分,气液传质效果越好,CO2溶解能力越高,对溶解氧的去除能力越高,强化了CO2在藻液中的传递过程,并避免了过多的溶解氧累积对藻细胞光合作用及生长的抑制作用[25].
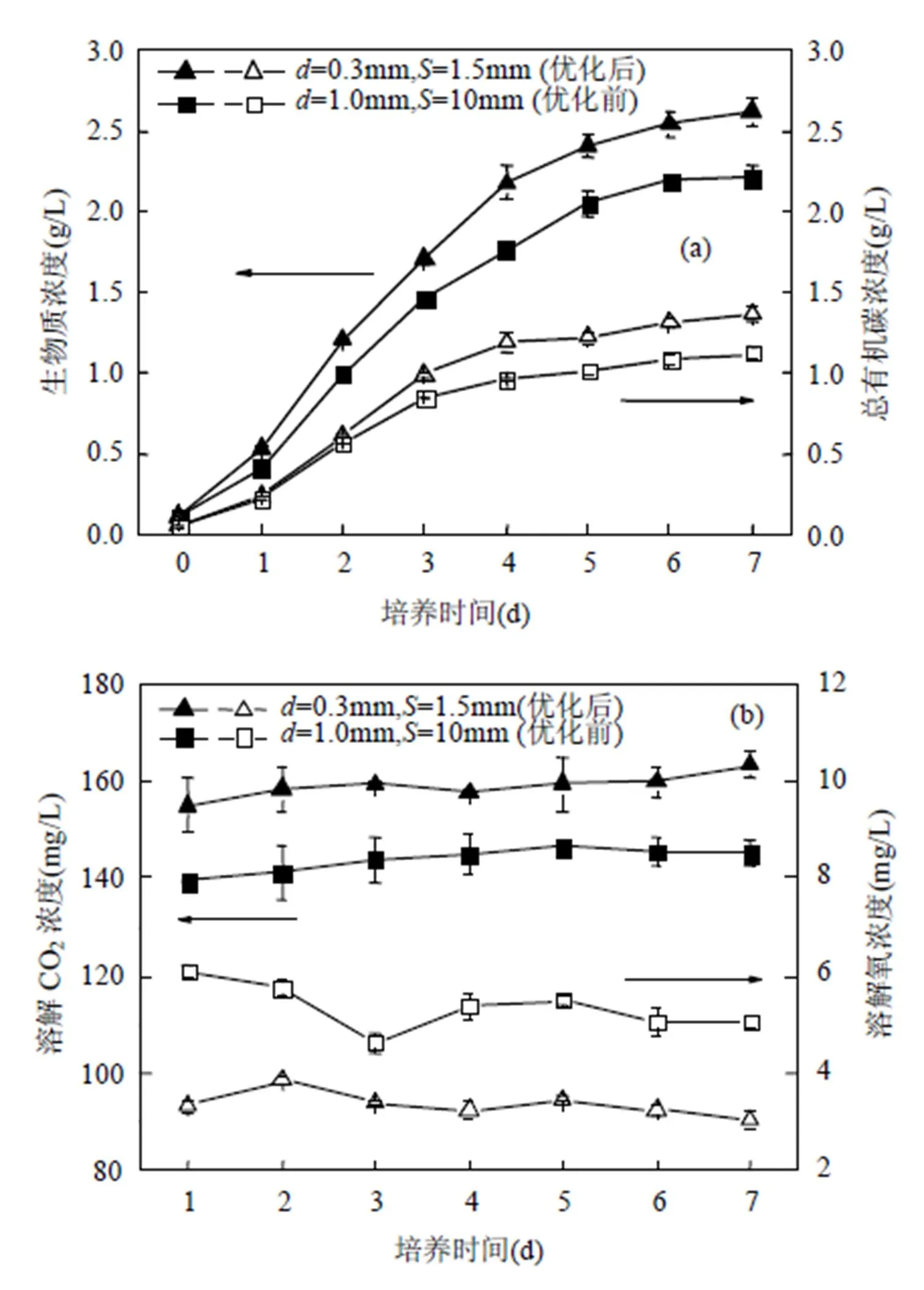
图8 气体分布器结构参数对 (a)微藻生物质浓度和有机碳浓度,(b)悬浮液溶解CO2浓度和溶解氧浓度的影响

表1 气体分布器结构对微藻生长及固碳性能的评价
3 结语
通过对气体分布器的孔径与孔间距等结构参数进行优化,相邻气泡在独立生长完全前发生聚并,使气泡脱离直径减小了55.6%,生成时间降低了65.4%,上升速度下降了18.4%,停留时间增加了22%,使体积传质系数提高了142.7%.同时聚并气泡脱离后的震荡对气液界面的扰动增加了反应器内溶液的混合程度,混合时间降低了23.7%.由于较小的气泡与较高的体积传质系数有利于CO2传递与氧解析,较高的混合程度有利于提高藻细胞的光暗循环和藻细胞分布均匀性,促进了光合作用正反应的进行,因而在最终的微藻培养中使生物质浓度提高了18.8%,固碳速率提高23.2%.由此可知,减小气泡脱离直径,延长气泡停留时间,提高反应器内混合程度是促进CO2传递与微藻固碳的有效途径.
[1] Wijffels R H, Barbosa M J. An outlook on microalgal biofuels [J]. Science, 2010,329:796-799.
[2] Razzak S A, Hossain M M, Lucky R A, et al. Integrated CO2capture, wastewater treatment and biofuel production by microalgae culturing—A review [J]. Renewable and Sustainable Energy Reviews, 2013,27:622-653.
[3] 刘 琳,叶嘉琦,刘玉洪,等.好氧污泥—微藻耦合颗粒的培养及特性研究[J]. 中国环境科学, 2017,37(7):2536-2541.
[4] Lam M K, Lee K T, Mohamed A R. Current status and challenges on microalgae-based carbon capture [J]. International Journal of Greenhouse Gas Control, 2012,10:456-469.
[5] Ugwu C U, Aoyagi H, Uchiyama H. Photobioreactors for mass cultivation of algae [J]. Bioresource Technology, 2008,99(10):4021- 4028.
[6] 王日杰,孟范平,李永富,等.内置LED光源平板型光生物反应器用于微藻培养—普通小球藻在反应器中的固碳产油性能探究[J]. 中国环境科学, 2015,35(5):1526-1534.
[7] Singh S K, Sundaram S, Sinha S, et al. Recent advances in CO2uptake and fixation mechanism of cyanobacteria and microalgae [J]. Critical Reviews in Environmental Science and Technology, 2016,46(16): 1297-1323.
[8] Chen Y M, Liu J C, Ju Y H. Flotation removal of algae from water [J]. Colloids and Surfaces B: Biointerfaces, 1998,12(1):49-55.
[9] Huang Y, Zhao S, Ding Y, et al. Optimizing the gas distributor based on CO2bubble dynamic behaviors to improve microalgal biomass production in an air-lift photo-bioreactor [J]. Bioresource Technology, 2017,233:84-91.
[10] 张 齐,高 振,黄 和,等.氧化铝气体分布器应用小球藻培养的研究[J]. 中国生物工程杂志, 2011,31(3):61-65.
[11] Zimmerman W B, Zandi M, Bandulasena H C H, et al. Design of an airlift loop bioreactor and pilot scales studies with fluidic oscillator induced microbubbles for growth of a microalgae[J]. Applied Energy, 2011,88(10):3357-3369.
[12] Ying K, Gilmour D J, Shi Y, et al. Growth enhancement ofby microbubble induced airlift loop bioreactor (ALB)—the relation between mass transfer and growth rate [J]. Journal of Biomaterials and Nanobiotechnology, 2013,4(2):1-9.
[13] Yang Z, Cheng J, Liu J, et al. Improving microalgal growth with small bubbles in a raceway pond with swing gas aerators [J]. Bioresource Technology, 2016,216:267-272.
[14] Carvalho A P, Meireles L A, Malcata F X. Microalgal reactors: a review of enclosed system designs and performances [J]. Biotechnology Progress, 2006,22(6):1490-1506.
[15] 赵 莎,丁玉栋,廖 强,等.微藻悬浮液中CO2气泡生长及脱离特性研究[J]. 工程热物理学报, 2013,V34(3):526-529.
[16] Li S, Luo S, Guo R. Efficiency of CO2fixation by microalgae in a closed raceway pond [J]. Bioresource Technology, 2013,136:267-272.
[17] Pruvost J, Pottier L, Legrand J. Numerical investigation of hydrodynamic and mixing conditions in a torus photobioreactor [J]. Chemical Engineering Science, 2006,61(14):4476-4489.
[18] Sun Y, Liao Q, Huang Y, et al. Integrating planar waveguides doped with light scattering nanoparticles into a flat-plate photobioreactor to improve light distribution and microalgae growth [J]. Bioresource Technology, 2016,220:215-224.
[19] Tang D, Han W, Li P, et al. CO2biofixation and fatty acid composition ofandin response to different CO2levels [J]. Bioresource Technology, 2011,102(3):3071- 3076.
[20] VanKrevelen D W, Hoftijzer P J. Studies of gas-bubble formation- Calculation of interfacial area in bubble contactors [J]. Chemical Engineering Progress, 1950,46(1):29-35.
[21] Luo H P, Al-Dahhan M H. Verification and validation of CFD simulations for local flow dynamics in a draft tube airlift bioreactor [J]. Chemical Engineering Science, 2011,66(5):907-923.
[22] Xie J, Zhu X, Liao Q, et al. Dynamics of bubble formation and detachment from an immersed micro-orifice on a plate [J]. International Journal of Heat and Mass Transfer, 2012,55(11/12): 3205-3213.
[23] Huang J, Li Y, Wan M, et al. Novel flat-plate photobioreactors for microalgae cultivation with special mixers to promote mixing along the light gradient [J]. Bioresource Technology, 2014,159:8-16.
[24] Babcock R W, Malda J, Radway J A C. Hydrodynamics and mass transfer in a tubular airlift photobioreactor [J]. Journal of Applied Phycology, 2002,14(3):169-184.
[25] Mendoza J L, Granados M R, de Godos I, et al. Oxygen transfer and evolution in microalgal culture in open raceways [J]. Bioresource Technology, 2013,137:188-195.
Enhancement of CO2transfer and carbon fixation by microalgae in photobioreactor.
HU Zi-Ming1,2,3, XIA Ao1,2*, HUANG Yun1,2, LIAO Qiang1,2*, FU Qian1,2, ZHU Xun1,2
(1.Key Laboratory of Low-grade Energy Utilization Technologies and Systems, Ministry of Education, Chongqing University, Chongqing 400030, China;2.Institute of Engineering Thermophysics, College of Energy and Power Engineering, Chongqing University, Chongqing 400030, China;3.Southwest Electric Power Design Institute Co., Ltd., Chengdu 610021, China)., 2018,38(10):3967~3974
Gaseous carbon dioxide can provide an essential carbon source during microalgal photosynthesis. Mixing, dissolution and transportation characteristics of carbon dioxide have significant impacts on the growth of microalgae. In a photobioreactor, the behaviors of carbon dioxide bubbles during growth, detachment, coalescence and rising are significantly affected by the gas distributor. In this study, the effects of orifice diameter and spacing of the gas distributor on 15% CO2bubble behaviors, dissolution and mixing characteristics of carbon dioxide as well as performances of microalgal growth and carbon dioxide fixation have been investigated. The rising velocity of bubble was reduced with decreasing orifice diameter and spacing, thereby increasing the retention time of carbon dioxide in microalgal suspension. As the parameters of gas distributor were optimized, the gas-liquid mass transfer coefficient was improved by 143%, the mixing time was reduced by 24%, the concentration of microalgae was increased by 18.8%, and the carbon dioxide fixation rate was enhanced by 23.2%.
gas distributor;orifice size;bubble;CO2transfer;microalgae
X172
A
1000-6923(2018)10-3967-08
胡自明(1994-),男,安徽马鞍山人,重庆大学硕士研究生,主要从事微藻光生物反应器内气液两相流动及传质强化研究.发表论文1篇.
2018-03-27
国家重点研发计划(2016YFB0601002);国家自然科学基金资助项目(51606020, 51561145013)
* 责任作者,夏 奡, 研究员, aoxia@cqu.edu.cn; 廖 强, 教授, lqzx@cqu.edu.cn

