加速溶剂萃取和净化-气相色谱-串联质谱法测定典型污染场地土壤中多氯联苯残留
田丙正,张 敏,张付海,胡雅琴,王 鑫,赵 彬
安徽省环境监测中心站,安徽 合肥 230071
多氯联苯(PCBs)是联苯在高温下氯化形成的化合物,因其有良好的电绝缘性、耐热性和惰性而广泛用于电力、塑料、油漆等行业[1]。PCBs具有低水溶性、化学稳定性、生物毒性、难降解性、生物蓄积性和远距离迁移等特点[2-3],被列入《斯德哥尔摩公约》持久性有机污染物名单,并被划为优先控制污染物[4]。环境中PCBs的来源主要是含PCBs产品(如电容器和变压器等)历史使用、封存、拆卸过程中的泄露,已污染地表环境(土壤和水体)的再释放,含氯废弃物的焚烧大气沉降,高污染土壤或沉积物中PCBs的释放[5]。目前中国PCBs 污染场地主要有使用含PCBs产品的厂家、下线PCBs设备临时存储场地、含PCBs设备的拆解点、含PCBs设备储存库及其周边地区等,这些场地均会因含PCBs 物质的泄漏而导致周围土壤和水体受到PCBs污染。含PCBs工业废物的堆放封存和填埋是造成土壤PCBs污染的主要原因之一。
经济发达的华东地区是我国使用含PCBs电力设备最多的地区之一,是PCBs典型污染地区。该地区的含PCBs报废设备和含PCBs污染物主要以山洞封存、地下封存、厂区暂存3种形式贮存,其中地下封存是将含PCBs废物封在水泥槽后埋入地下。由于当时这些填埋或封存场地大多未做好合理完善的防渗措施,有的填埋坑内已发现有大量积水,大量设备出现了内部液体泄漏的现象,对周围环境的土壤和水体造成一定程度的污染。有研究表明,该地区局部点位土壤已存在不同程度的PCBs污染[6-9]。而且该地区的填埋场和封存场均已到达使用年限,潜在的环境污染日益严重[10],急需加紧对其进行清理处置,以减少环境危险。污染场地土壤样品基体复杂,样品的提取、净化和测定成为目前污染土壤中PCBs残留分析的难点。土壤中PCBs的提取方法主要有索氏萃取、超声萃取和加速溶剂萃取等。索氏萃取过程繁琐耗时,超声萃取效率有待提高,加速溶剂萃取(ASE)具有萃取效率高、溶剂用量少、耗时短、全自动化和回收率高等优点,在土壤目标物的提取中获得越来越广泛的应用[11]。土壤中PCBs的净化方法主要有固相萃取柱法、浓硫酸磺化法等。固相萃取柱法操作繁琐[12],浓硫酸磺化法回收率偏低[13]。土壤中PCBs测定主要有气相色谱法、气相色谱-质谱法[14]、高分辨质谱法。气相色谱只能通过保留时间定性,气相色谱-质谱法的选择离子模式可一定程度去除干扰,但在样品基质复杂时,仍受到样品基质的干扰。对于土壤基质比较复杂的样品,气相色谱法和气相色谱-质谱法很容易出现假阳性的结果。高分辨质谱法仪器昂贵,易受污染,不适合大批量基质复杂样品分析。气相色谱-三重四极杆串联质谱法在抗干扰能力、准确度和灵敏度等方面具有十分明显的优势,特别适合基质相对较为复杂样品中痕量化合物的定性定量分析。目前土壤中PCBs的提取、净化和测定均存在一定困难,建立快速准确的先进分析技术对环境中PCBs污染调查和防控具有重要意义,同时把该地区作为典型污染场地使用气相色谱-串联质谱法测定PCBs残留的研究鲜有报道。本文运用网格法对华东某典型污染场地进行采样,采用加速溶剂萃取同步净化-气相色谱-三重四极杆串联质谱法,建立典型污染场地中7种指示性PCBs的测定方法,对污染场地区域PCBs的含量及分布特征进行研究,分析土壤中7种指示性多氯联苯的总体残留特征,对土壤中PCBs的污染状况进行研究,探讨典型污染场地土壤中PCBs对环境的影响。
1 实验部分
1.1 仪器与试剂
Bruker 450GC-320MSMS气相色谱仪和三重四极杆串联质谱仪,美国;戴安ASE-300加速溶剂萃取仪,美国;四环LGJ-25冷冻干燥机,中国;LabTech MultiVap-8全自动定量浓缩仪,美国。
7种PCBs标准贮备液为PCB28(2,4,4′-三氯联苯)、PCB52(2, 2′,5,5′-四氯联苯)、PCB101(2, 2′,4,5,5′-五氯联苯)、PCB118(2, 3′,4,4′,5-五氯联苯)、PCB153(2, 2′,4,4′,5,5′-六氯联苯)、PCB138(2, 2′,3,4,4′,5′-六氯联苯)、PCB180(2, 2′,3,4,4′,5,5′-七氯联苯),各组分质量浓度均为10.0 mg/L,美国,替代物为PCB13813C12(40 mg/L,美国);正己烷、丙酮、二氯甲烷等,色谱纯,美国;硅藻土、弗罗里硅土,0.150~0.250 mm。
1.2 样品采集与前处理
选取了华东某典型PCBs污染场地(电容器封存点)为采样地点,参照《土壤环境监测技术规范》(HJ/T 166—2004)和《农田土壤环境质量监测技术规范》(NY/T 395—2012),运用网格法布设31个采样点位(图1): ①背景点区域(1#);②封存点外围区域(2#~14#);③封存点边沿区域(15#~30#);④封存点内区域(31#)。上述区域每个采样点位按五点法分别采集表层20 cm的土壤样品并混合为1个,得到31个混合样品。土壤样品以铝膜包裹放入棕色玻璃瓶内,密封后4 ℃低温冷藏。
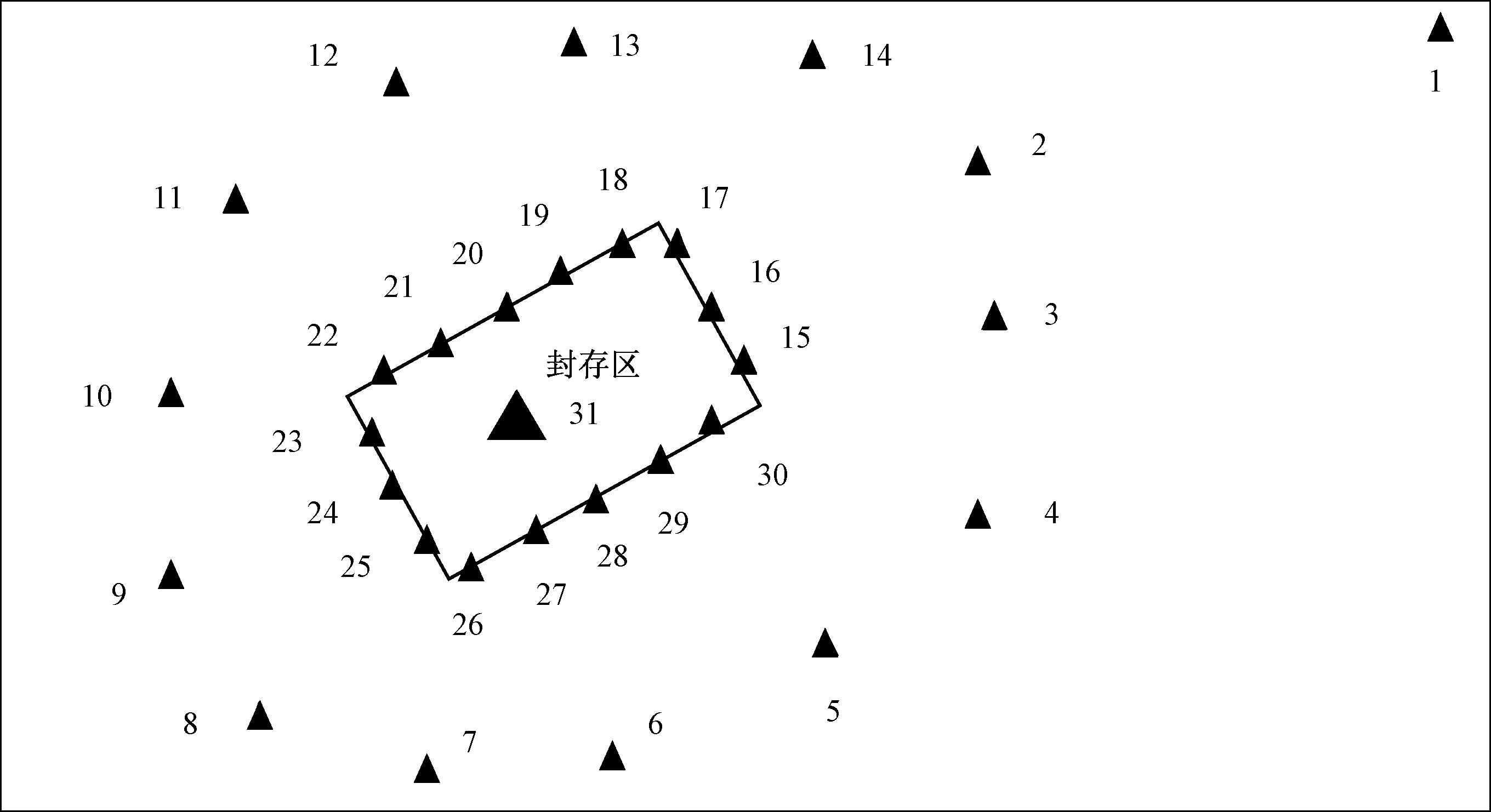
图1 污染场地土壤采样点位示意图Fig.1 Soil sampling sites in the polluted area
将采集的土壤样品除去植物根茎等杂物后放入冷冻干燥机中,冷冻过夜,再干燥48 h,研磨过0.250 mm筛后装入棕色瓶保存待用。称取5 g左右的待测样品,加入3 g硅藻土和3 g弗罗里硅土与样品混匀,然后填装至33 mL萃取小池中,加入替代物后进行萃取。ASE条件:提取溶剂为正己烷/丙酮(体积比1∶1)混合溶液,萃取温度100 ℃,压力10.342 MPa,静态提取5 min,循环2次,淋洗体积为萃取池体积的60%,氮气吹扫时间为60 s。萃取完成后,将萃取液浓缩至1.0 mL,待上机分析。
1.3 色谱和质谱条件
气相色谱仪条件:DB-5HT MS毛细管柱(15 m×250 μm×0.1 μm),进样口温度270 ℃,进样体积1.0 μL,选择不分流压力脉冲方式进样,载气为高纯氦气(99.999%),柱流速为1.2 mL/min。
程序升温:初始温度50 ℃,以15 ℃/min升温至150 ℃,再以10 ℃/min 升温至260 ℃,保持1 min。
质谱仪条件:电离方式为EI,离子源温度 260 ℃,传输线温度280 ℃,腔体温度 40 ℃,离子源能量70 eV,溶剂延迟5 min,碰撞气氩气为0.266 Pa,检测器电压1 kV,多反应监测方式(MRM),7种PCBs的质谱分析参数见表1。
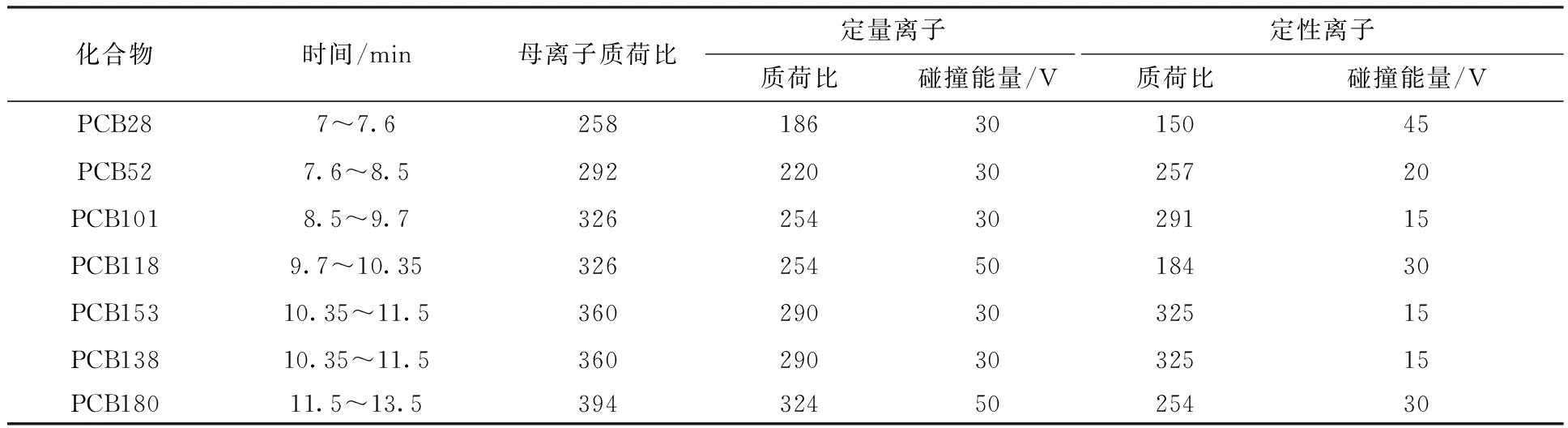
表1 7种PCBs质谱分析参数Table 1 MS parameters for analysis of 7 PCBs
2 结果与讨论
2.1 加速溶剂萃取条件和净化条件的优化
研究了不同溶剂对7种PCBs提取效率的影响,正己烷/丙酮(体积比1∶1,下同)、二氯甲烷/丙酮(体积比1∶1,下同)、二氯甲烷/正己烷(体积比1∶1,下同)、100%丙酮和100%正己烷均可作为萃取溶剂对7种PCBs进行提取,土壤中7种PCBs提取效率如图2所示。从图2可见,单一溶剂的提取效率比混合溶剂要差。考虑到二氯甲烷毒性较大,最终选择正己烷/丙酮(体积比1∶1)作为萃取溶剂。

图2 萃取溶剂对7种PCBs提取效率的影响Fig.2 Effects of solvent on the extraction efficiency of 7 PCBs
研究了不同萃取温度对7种PCBs提取效率的影响,结果如图3所示。从图3可见:发现萃取温度由70 ℃升至100 ℃时,提取效率增加明显;但当温度由100 ℃升至110 ℃后,提取效率增加缓慢。因此,选择萃取温度为100 ℃较为合适。
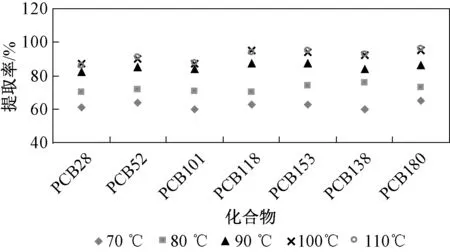
图3 萃取温度对7种PCBs提取效率的影响Fig.3 Effects of temperature on the extraction efficiency of 7 PCBs
分别称取1~5 g弗罗里硅土填装至ASE萃取小池中,考察不同用量的弗罗里硅土作为净化剂的净化效果。结果表明,净化效果随净化剂用量的增加而变好;但净化剂用量过多,回收率有所下降。综合考虑可靠的回收率和净化效果,最终选择弗罗里硅土净化剂的用量为3 g,此时土壤中7种PCBs的回收率为85.4%~97.0%。
2.2 色谱柱的选择
PCBs分析常用色谱柱有弱极性色谱柱(DB-5、DB-XLB等)和中等极性色谱柱(DB-1701等)。采用上述常用色谱柱(30 m)对7种PCBs进行测定,发现在3种色谱柱上均能对7种PCBs单体实现良好分离。由于DB-1701色谱柱和DB-XLB色谱柱选择性高,而DB-5色谱柱应用范围更广、使用寿命长、可耐受更高的温度,所以本研究选用DB-5色谱柱对PCBs进行分离。气相色谱串联质谱法一般常用长度30 m的色谱柱,7种PCBs在此长度的DB-5色谱柱上需要25 min才能实现所有组分的良好分离,且需要较高的柱温,六氯联苯和七氯联苯的灵敏度也较低。而在15 m 长的DB-5色谱柱上,7种PCBs仅需12.5 min即可实现良好分离,高氯代联苯的灵敏度有较大提高。这是因为,高氯代联苯沸点较高,在15 m长的色谱柱上比在30 m长的色谱柱上保留时间较短,峰形较尖锐,响应值较大,所以在满足色谱分离要求的情况下应选用较短的色谱柱。本方法最终选择了长度15 m、内径250 μm和0.1 μm薄液膜耐高温的DB-5色谱柱,可提高分析效率和灵敏度,适合实际样品大批量的测定。
2.3 串联质谱条件的优化
采用多反应监测模式(MRM)测定目标化合物,在MRM中一级质谱选择特定质荷比的离子,在碰撞池中生成碎片离子,再选择特定的碎片离子通过二级质谱进行定性定量。串联质谱能提供足够的化合物信息用于定性分析,定性更为准确;特征母离子和子离子一一对应,通过监测多个离子对可以去除大部分背景干扰,一般出现与碎片离子多个离子对质荷比完全相同的干扰物几率很小,定量时背景更低。气相色谱-三重四极杆串联质谱法相当于在气相色谱-质谱法基础上增加了子离子的质谱信息,增强了定性能力,二级质谱图比一级质谱图更加简单,最大程度排除了基体干扰,可以有效排除干扰和解决假阳性问题,同时测定的准确性和灵敏度得到较大提高。质谱条件主要从扫描时间范围、母离子、子离子、碰撞能量等进行优化。先进行质谱全扫描模式的初步分析,可确定每种化合物的扫描时间范围,还可得知每种PCB主要的母离子碎片为(M)、(M+2)和(M+4),考察各碎片离子的相对丰度,选择一级质谱图中质荷比大且丰度高的2~3个离子初定为母离子。经过碰撞诱导解离(CID)使母离子裂解产生子离子,每种PCB一般以失去1个氯原子或2个氯原子形成(M-Cl)或(M-2Cl)。在母离子产生的二级质谱碎片离子中,选择2~3个响应最好的碎片离子作为子离子,从而确定响应最好的离子对(母离子/子离子)组合。对每一选定的离子对优化碰撞能量,分别以10、15、20、25、30、35、40、45、50、55、60 V进行实验。对扫描峰宽和驻留时间进行优化可以提高测定灵敏度,扫描峰宽为8 amu、驻留时间为0.25 s时能满足要求。优化后的质谱分析参数详细结果见表1。7种PCBs质量浓度为10 μg/L的标样在优化后的质谱条件下的MRM图见图4。
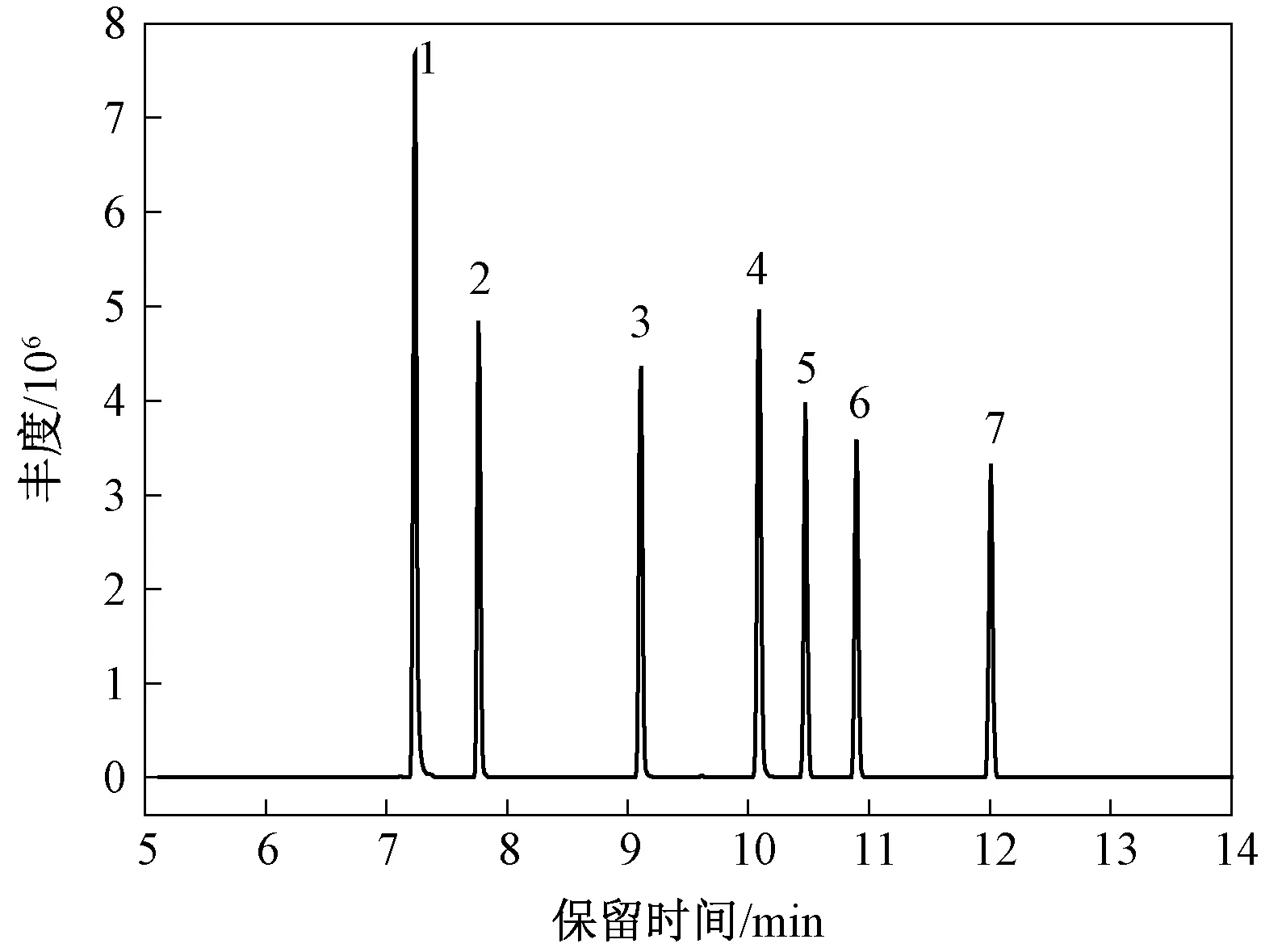
1. PCB28; 2. PCB52; 3. PCB101; 4. PCB118;5.PCB153; 6.PCB138; 7.PCB180图4 7种PCBs标样的MRM图Fig.4 MRM TIC of 7 PCBs standard samples
2.4 标准曲线、方法检出限、准确度和精密度
将7种PCBs标准贮备液分别配制成0.1、1、5、10、50、100 μg/L标准系列,以各组分的峰面积(y)对质量浓度(x,μg/L)绘制标准曲线,得到7种PCBs的线性回归方程及其相关系数,见表2。结果表明,在0.1~100 μg/L质量浓度范围内,该方法的线性关系良好,7种PCBs的线性相关系数(r)为0.999 80~0.999 99,完全满足定量分析的要求。根据检出限的确定方法[15],对浓度值为估算方法检出限值2~5倍的样品进行多次平行测定,按公式MDL=t(n-1,0.99)×S计算方法检出限。在5 g不含目标化合物的空白土壤样品中加标质量浓度为0.020 μg/kg进行检出限测定,测定7次,检出限计算结果见表2。结果显示,7种PCBs的检出限为0.004~0.010 μg/kg,测定下限为0.016~0.040 μg/kg。《土壤和沉积物 多氯联苯的测定 气相色谱-质谱法》(HJ 743—2015)采用气相色谱-单四极杆质谱法测定土壤中PCBs,当取样量为10 g、采用选择离子扫描模式时,多氯联苯的检出限为0.4~0.6 μg/kg。取样量同为10 g时,本方法采用气相色谱-三重四极杆串联质谱法的检出限比HJ 743—2015中气相色谱-单四极杆质谱法低114~240倍,提高了2个数量级,说明本方法具有很高的灵敏度。采用实际土壤样品进行基体替代物加标量为20.0 μg/kg,其平均回收率为91.8%。对空白土壤样品进行加标回收实验,平行测定6次,计算结果见表2,回收率分别为84.8%~97.3%,相对标准偏差(RSD)为2.4%~8.5%。

表2 7种PCBs的线性方程、相关系数、检出限、回收率和精密度Table 2 Regression equations, correlation coefficients, detection limits, recovery and precision of 7 PCBs
2.5 实际样品测定
2.5.1 研究区土壤中多氯联苯浓度分析
在采集的31个点位土壤样品中,7种指示性PCBs的检出率为100%,质量分数为0.096~3 661 μg/kg,各点平均值为307 μg/kg。各采样点中,31#为封存点内样品,质量分数为3 661 μg/kg;1#为背景点区域样品,质量分数为0.096 μg/kg;2#~14#为封存点外围区域样品,质量分数为1.18~65.7 μg/kg,均值为17.5 μg/kg;15#~30#为封存点边沿区域样品,质量分数为16.3~728 μg/kg,均值为352 μg/kg。 每个采样点土壤样品中PCBs质量分数见图5。
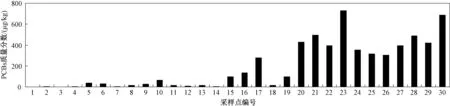
图5 污染场地土壤中各采样点PCBs质量分数Fig.5 Concentrations of PCBs from soil sampling sites of the polluted area
封存点内的含量是封存点边沿的10.4倍,是外围周边土壤的209倍,表明封存点中很大程度存在PCBs泄露。《土壤环境质量 建设用地土壤污染风险管控标准(试行)》(GB 36600—2018)第一类用地中PCBs的土壤污染风险筛选值为140 μg/kg,封存点外围区域13个采样点均未超出建设用地第一类用地中PCBs的土壤污染风险筛选值140 μg/kg。但封存点边沿区域16个采样点中有12个超过限定值140 μg/kg。以封存点内点位土壤中PCBs残留最高,与封存点相近的部分点位残留较其他位置高,封存点边沿区域采样点PCBs含量明显高于封存点外围区域采样点,可能是因为这些采样点距离封存点较近所致,说明封存点边沿土壤已经受到PCBs污染,只是现状还是以点污染为主,根据浓度分布的不同,可以看出污染范围已经呈现扩散态势。虽然各采样点PCBs污染浓度均未达到《含多氯联苯废物污染控制标准》(GB 13015—2017)中PCBs的污染控制标准(50 mg/kg),但也应及时研究风险管控措施,阻止污染趋势进一步扩大。
从结果看,各点平均含量远高于我国背景地区/农村中PCBs的土壤背景值(0.424 μg/kg)[16]和全球土壤背景值(5.41 μg/kg)[17],其中有64.5%(20个)的测试土壤的PCBs残留量高于瑞典土壤中PCBs的指导值20 μg/kg。与国内外相关土壤比较,郑群雄等[18]报道长江三角洲某废旧电容器封存点土壤中PCBs质量分数为2.01~5 201.20 μg/kg,平均值为229.38 μg/kg;在泰国某电容器封存点周边土壤的PCBs质量分数为0.095~370 mg/kg,平均值为78 mg/kg[19],该污染场地土壤样品中PCBs含量高于国内某些封存点土壤样品,但远低于国外平均值。与这些区域相比,本污染场地土壤中PCBs含量处于中等浓度水平。
2.5.2 研究区土壤多氯联苯的组成特征
土壤PCBs的组成与其来源和同系物性质有关,各种PCBs单体的组成特征见表3。
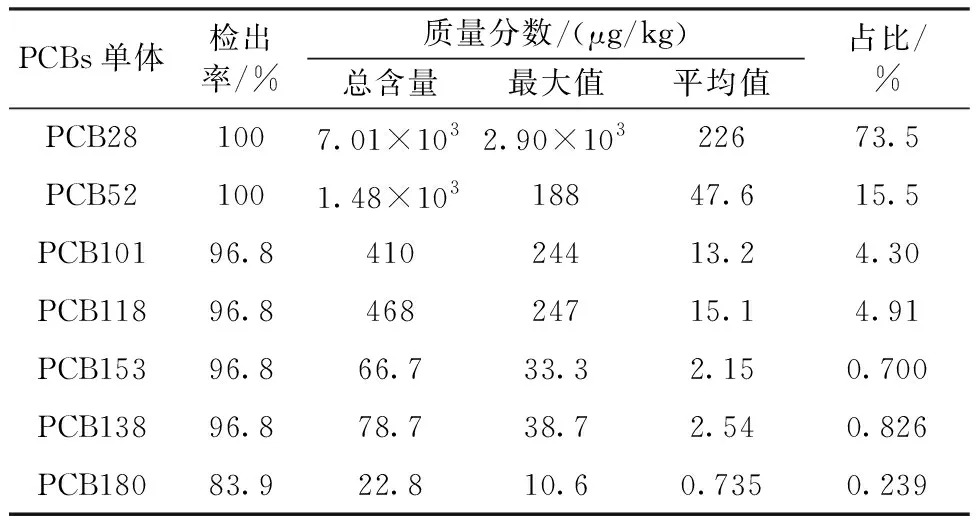
表3 污染场地土壤中PCBs同系物组成特征Table 3 Composition of PCBs congenersin soil of the polluted area
7种PCBs同系物中,各单体均有不同程度的检出。三氯联苯PCB28、四氯联苯PCB52、五氯联苯PCB101和PCB118检出率高,残留量也很高;而六氯联苯PCB153和PCB138、七氯联苯PCB180检出率较高,但残留量较小。检出量最高的是PCB28,其质量分数平均值为226 μg/kg,占PCBs总量的73.5%,三氯联苯PCB28的普遍检出和高残留量可能与我国生产和进口的PCBs大部分是三氯联苯有关。三氯联苯主要用于电流生产、传输所需的电容器中,这些产品的历史使用会使PCBs在环境中长期残存。 其他残留量较高的几种PCBs同系物有PCB52、PCB101和PCB118,在PCBs总量中占比分别为15.5%、4.30%、4.91%。高氯代苯检出量很低,主要在封存点内区域和封存点边沿区域这些离污染源较近的点位,封存点外围周边土壤中几乎没有相应物质的检出,这主要是因为高氯代化合物水溶性极低,挥发性较弱,吸附性更强,较容易在土壤中长期积累,难以与空气交换和迁移,也难以自然降解,因而主要在污染源附近检出。
将土壤中PCBs浓度按氯取代数的同系物进行统计,可以得到封存点区域各采样点土壤PCBs同系物的分布图,如图6所示。
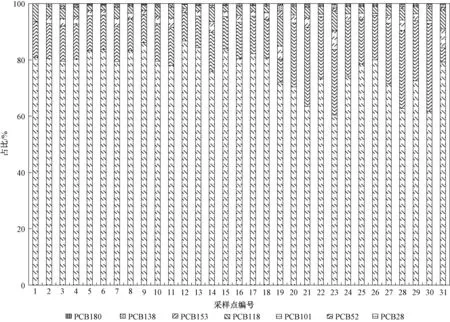
图6 污染场地各采样点土壤中PCBs同系物的分布Fig.6 Distributions of PCBs congeners from soil sampling sites of the polluted area
该电容器封存点土壤中PCBs以三氯联苯、四氯联苯、五氯联苯为主(图7),三者占PCBs总量的98.2%。这与国内用于电容器包括进口电力设备的介质油主要是低氯取代的PCBs相一致。封存点内区域样品(31#)最主要的组分为三氯PCBs,占79.2%,其次是五氯PCBs,占13.4%,接下来是四氯PCBs,占5.13%。封存点边沿区域样品(15#~30#)最主要的组分为三氯PCBs,占69.5%,其次是四氯PCBs,占22.3%,再次是五氯PCBs,占6.65%。封存点外围区域样品(2#~14#)最主要的组分为三氯PCBs,占82.0%,其次是四氯PCBs,占12.3%,再次是五氯PCBs,占4.77%。背景点区域样品(1#)PCBs总残留量很少,最主要的组分为三氯PCBs,占81.0%,其次是四氯PCBs,占12.7%,再次是五氯PCBs,占6.33%。封存点边沿区域采样点低氯代PCBs比例下降,高氯代PCBs比例升高,可能是来源不同,也有可能是由于不同氯代PCBs挥发能力不同,低氯代PCBs挥发而随大气迁移,而高氯代PCBs更易停留在本地土壤中富集,迁移能力较弱,说明封存点边沿土壤已受到污染。
本污染场地土壤样品中PCBs主要单体分布和报道的长江三角洲某废旧电容器封存点土壤[18]、某典型电力电容器污染土壤[20]和长江三角洲某电子垃圾拆解区土壤中PCBs污染[1]的研究结果相似,PCBs单体以三氯联苯、四氯联苯、五氯联苯为主,尤以三氯联苯PCB28、四氯联苯PCB52、五氯联苯PCB101和PCB118残留量最高。但与报道中的长江三角洲典型地区农田土壤中多氯联苯残留量和检出率最高的分别是PCB138和PCB180等单体[9]明显不同,原因可能是来源不同,也可能是PCBs在环境迁移转化过程中不同的环境因素相互作用,其分布和组成发生了变化。
土壤中不同PCBs化合物的毒性不同,可以PCBs毒性效应为基准研究不同点位土壤样品的污染水平。LONG等[21]提出PCBs毒性效应低值(ERL,22.7 μg/kg)和毒性效应中值(ERM,180 μg/kg),当目标污染物浓度低于ERL 值时,引起生态风险概率小于10%;当目标污染物浓度高于ERM值时,引起生态风险概率大于50%;当目标污染物浓度介于两者之间时,引起生态风险概率为10%~50%。此研究结果已被美国环保署采用,成为美国的国家标准,该标准因简便易行而得到广泛应用[22-23]。本文研究区土壤31个点位中有20个点的PCBs含量大于ERL值,有13个点的PCBs含量均大于ERM 值,从各点平均含量来看,该污染场地土壤中PCBs的毒性效应评估处于中等水平,说明土壤已经受到一定程度的PCBs污染。
3 结论
建立了加速溶剂萃取同步净化-气相色谱-三重四极杆串联质谱法测定污染场地土壤中7种指示性多氯联苯的方法,将土壤样品萃取和净化合二为一,有效排除干扰和解决假阳性的问题,灵敏度得到很大提高。该方法具有前处理简便、灵敏度高、重现性和准确度好等特点,适合基质较为复杂的土壤中多氯联苯的测定,也适用于土壤中其他持久性有机物(如多溴联苯醚、多环芳烃等)的监测,并为其提供借鉴和参考。
运用网格法采集了华东某典型污染场地土壤中31个土壤样品,分析了该场地土壤中7种指示性多氯联苯的残留特征。7种PCBs的检出率为100%,检出范围为0.096~3 661 μg/kg,各点平均质量分数为307 μg/kg。各采样点中PCBs的残留程度存在很大的差异,局部点位受到了较重污染,封存点边沿区域的部分点位残留较其他位置高。土壤中PCBs同系物以三氯联苯、四氯联苯、五氯联苯为主, PCB28、PCB 52、PCB101和PCB 118是最主要的单体,它们的含量占PCBs同系物总量的98.2%。部分采样点位PCBs含量较高,虽都没达到相关标准限值,但有趋势表明PCBs在封存点已出现扩散迹象。该污染场地土壤PCBs主要是低氯代联苯污染,土壤中PCBs的毒性效应评估处于中等水平,污染以点源污染为主,且已有较大程度扩散,必须及时采取针对性的措施进行环境风险管控。

