东亚飞蝗和刺腿食蚜蝇内生酵母菌多样性分析
刘开平,韦玉梅,熊 杰,孙燕飞,雷勇辉
(1.石河子大学生命科学学院,新疆 石河子 832003;2.石河子大学农学院,新疆 石河子 832003)
蝗虫属直翅目,全世界种类超过10 000种,我国有1 000余种。蝗虫主要包括飞蝗和土蝗,飞蝗在我国有东亚飞蝗〔Locusta migratoria manilensis(Meyen)〕、 亚 洲 飞 蝗〔Locusta migratoria migratoria(Linnaeus)〕和西藏飞蝗〔Locusta migratoria tibitensis(Chen)〕3 种,其中东亚飞蝗分布范围最广,具有繁殖能力强、食量大、迁飞、抵抗不良环境能力强等特点,一旦爆发成灾,常常导致颗粒无收,给农业生产和社会稳定造成严重危害[1]。刺腿食蚜蝇是常见的昆虫天敌,以幼虫捕食蚜虫而著称[2],在农业生态系统中是一种益虫。
近年来,昆虫体内共生菌的研究越来越引起国内外研究者的重视。在长期的协同进化过程中,昆虫与其体内的共生菌建立了密切的互利共生关系,内共生菌是宿主昆虫生长发育及适应性的重要调控因子[3]。有研究表明,刺吸危害的同翅目昆虫,如蚜虫、飞虱、叶蝉等,体内普遍存在内共生菌。大多数同翅目昆虫的共生菌,除了在短期的卵巢感染阶段外,很少情况下在菌胞(Mycetocyte)外发现;蚜虫共生菌的种类主要有初级共生菌布赫纳氏菌(Buchnera aphidicola)和若干次级共生菌,如沙雷氏菌 (Serratia symbiotica)、立克次氏体(Rickettsiaspp.)、沃尔巴氏菌(Wolbachiaspp.)、U型共生肠杆菌(egiella insecticola)、T 型共生肠杆菌 (Hamil-tonella defensa)等[4],但目前关于昆虫共生酵母菌的研究鲜为报道。在“昆虫·共生菌”这一共生关系研究中,共生菌的离体培养至关重要[5],而传统可培养方法对昆虫内生菌不同分类水平菌群结构的多样性难以进行全面深入研究,随着分子生物学技术的发展,高通量测序技术已开始逐步应用于微生物多样性研究。26S rDNA的D1/D2区域的序列保守程度适中,长度适中(约600 bp),可以作为酵母菌种级水平鉴定指标,在微生物高通量测序研究中应用广泛。对大量子囊菌酵母26S rDNA的D1/D2区域的序列进行分析发现,同种但不同菌株之间该区核苷酸替换率低于1%,通过对该序列的研究可以将假丝酵母属(Candida)绝大部分种区分开[6]。对卵块培养法分离得到的褐飞虱体内的两株菌的26S rDNA D1/D2区序列测序分析,发现分别与解脂假丝酵母(Yarrowia lipolytica)和嗜盐梗孢酵母(Sterigmatomyces halophilus) 具 有 100% 和99.8%序列相似性[7]。至今,国内外尚无有关东亚飞蝗和食蚜蝇体内的酵母共生菌的离体培养报道,这严重阻碍了该类共生菌的生理生化特性实验的开展。而作为单细胞个体,其常规的形态分类又受到很大的限制,从而使得该类共生菌的分类研究至今止步不前。
本研究首次采用Illumina MiSeq高通量测序方法对2种昆虫酵母菌26SrDNA进行分析,探讨农业害虫东亚飞蝗及益虫刺腿食蚜蝇这两种不同类型昆虫内生酵母菌的多样性差异,并为农业害虫防治和特殊环境下的特殊微生物资源利用提供思路。
1 材料与方法
1.1 试验材料
在石河子市分别采集东亚飞蝗和刺腿食蚜蝇2种昆虫各30只,采样信息见表1。

表1 不同采样点地理因子
1.2 东亚飞蝗和刺腿食蚜蝇内生菌基因组DNA提取及测序
将所得样本昆虫用酒精进行表面消毒后用无菌水清洗,再用研钵在无菌间研磨成匀浆,然后将所得原液与无菌水按1∶1比列混合,并用0.45 µm的滤膜进行抽滤,然后利用试剂盒提取基因组DNA (Powersoil®DNA isolation kit)。根据Kurtzman等[8]的方法,用通用引物NL-1和NL-2 PCR扩增酵母26S rDNA的D1/D2区域。PCR扩增体系(50 µL):dd H2O 38 µL,10×Taq E Buffer 5 µL,dNTPs(2.5mmol/L)4 µL,引物NL-1 和NL-4各1 µL,混匀,再分别加入模板DNA 0.5µL,Taq聚合酶(5 U/ L)0.5 µL,混匀后稍微离心。然后按照程序94℃,1 min;53℃,1 min;72℃,1 min 20 s进行36个循环。PCR产物用1%的琼脂糖凝胶电泳检测鉴定,用Axygen DNA凝胶回收试剂盒(Axygen,美国)进行割胶回收。送样至上海派森诺生物科技有限公司对样品26S rDNA D1/D2区进行高通量测序,利用Illumina(MiSeq)平台,对获得的序列进行OTU归并划分,每个OTU的代表序列用于分类地位鉴定,在属水平对菌群进行聚类分析,根据聚类结果分析东亚飞蝗和刺腿食蚜体内酵母群落丰富度的差异。
1.3 多样性分析
基于OTU聚类结果,利用Mothur软件计算东亚飞蝗和刺腿食蚜蝇体内酵母菌Alpha多样性,包括Chao1指数、Ace指数、Shannon指数及Simpson指数[9],作为测序数据量不同样本中物种丰富度比较的依据,也可作为样本测序量合理与否“是否足以覆盖所有类群”的评价标准,得出样本测序深度。并通过SPSS统计分析软件对2个样本的多样性指数差异的显著性分析[10],反映东亚飞蝗和刺腿食蚜蝇体内绝大多数酵母菌的信息。
1.4 物种组成分析
获得的OTU与RDP数据库(Release 11.1,http:// rdpcme.msu.edu/)比对,通过 RDP Classifier鉴定OTU代表性序列的微生物分类地位。各组样品在不同水平的分类比较柱形图是根据QIIME(v1.8.0)软件计算的结果用Origin软件绘制[11]。
2 结果与分析
2.1 东亚飞蝗与刺腿食蚜蝇酵母菌OUT水平分析
在当前的测序量下,2个样本的Chao1曲线与Shannon曲线(图1)都接近平台期,说明增加测序数据无法再找到更多的OTU,这表明选取的样本测序量能够充分反映待测样本酵母菌菌群结构的合理性及多样性。
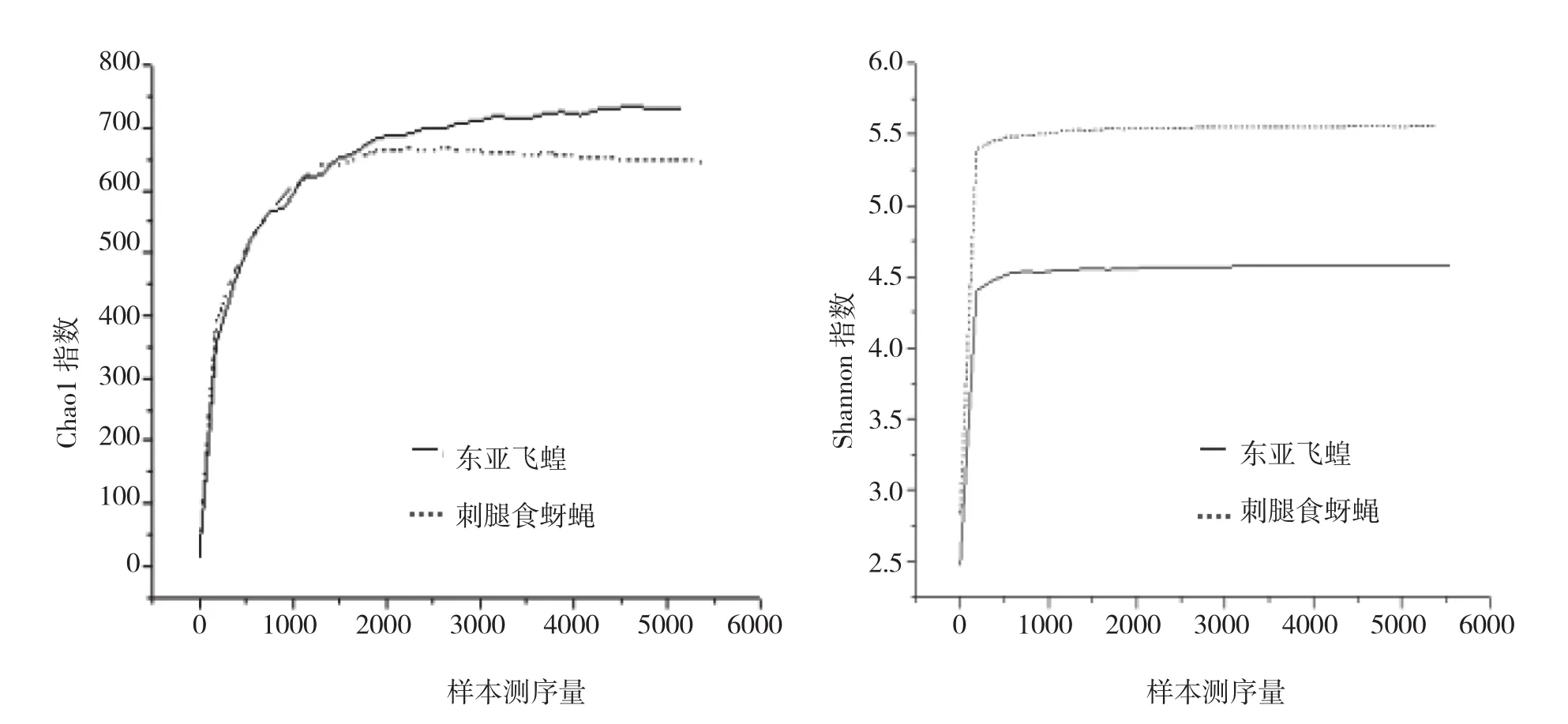
图1 Shannon指数和Chao1指数稀释曲线
两个样本共检测到126 728条reads,其中子囊菌亚门(Ascomycota)32 695条,担子菌亚门(Basidiomycota)20 150条,测序长度集中在270~300 bp之间。2个样品共产生906个OTU,去除丰度值低于全体样本测序总量0.001%的OTU,并去除稀有OTU,用于后续的一系列分析。OTU划分并对分类地位鉴定的统计结果(表2)显示,在各分类水平上东亚飞蝗体内酵母菌OTU数目均高出刺腿食蚜蝇。由vene图(图2)可知东亚飞蝗体内特有229个OTU,刺腿食蚜蝇体内特有259个OTU,二者共有418个OTU。
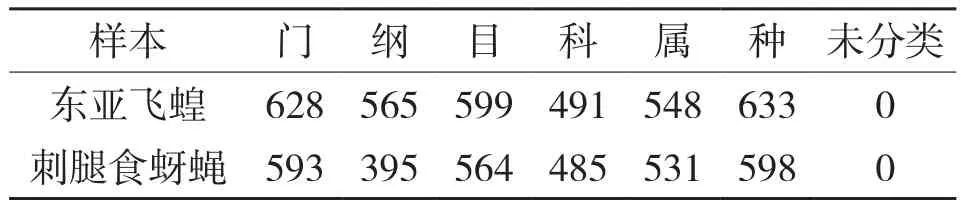
表2 OTU划分和分类地位鉴定结果

图2 东亚飞蝗和刺腿食蚜蝇共有OTU vene图
2.2 东亚飞蝗与刺腿食蚜蝇酵母菌Alpha多样性分析
对2个样本的Simpson指数、Shannon 指数、Chao1 指数、Ace指数进行Alpha多样性及差异显著性分析表明,东亚飞蝗的Chao1、Ace指数比刺腿食蚜蝇大,而Shannon指数、Simpson指数比刺腿食蚜蝇小(表3),说明东亚飞蝗样本存在着稀有OTU的概率更大,而刺腿食蚜蝇样本中群落的均匀度和丰富度更好,且优势物种明显。通过T假设检验,发现两个样本各多样性指数的统计参数值(t)均小于假设检验显著水平为0.01时的参考值(t0.01),表明东亚飞蝗和刺腿食蚜蝇体内酵母菌多样性差异并不显著(表4)。
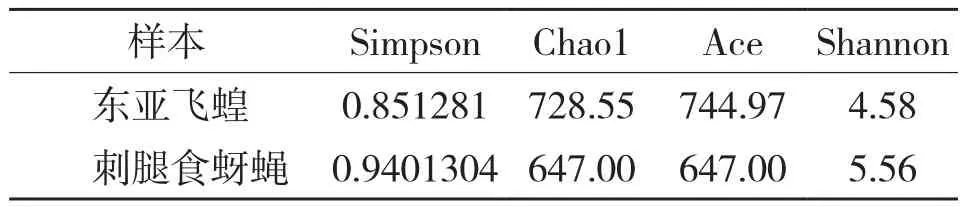
表3 样品的Alpha多样性指数
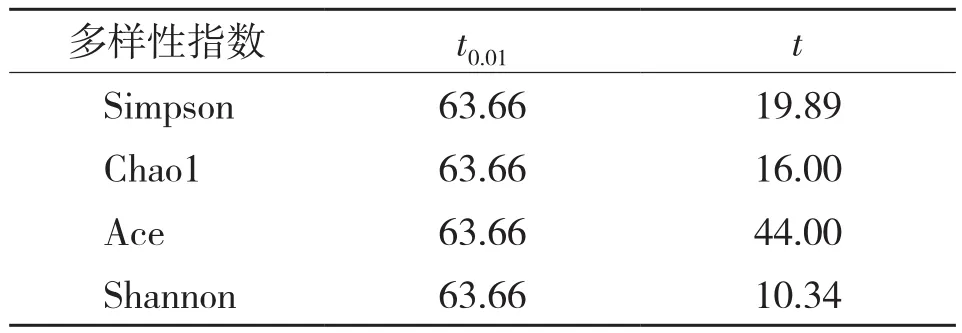
表4 多样性指数差异显著性分析
2.3 东亚飞蝗与刺腿食蚜蝇酵母菌的菌群结构分析
据OTU划分和分类地位鉴定结果,可以获得两个样本在各分类水平的具体组成(表2、表4,图3、图4)。相当于以不同的分辨率查看群落组成结构,比较两个样本在各分类水平所含有的酵母菌类群数量(表5);东亚飞蝗体内酵母菌群共分属于2门6纲11目12科17属73种,刺腿食蚜蝇体内酵母菌群共分属于2门8纲13目16科17属88种。
各分类水平上的数目虽然大体相同,但种类和比例却相差甚大。通过比较分析发现,在门水平上(图3),两个样本的内生酵母菌主要分布在子囊菌亚门和担子菌亚门,东亚飞蝗样本中子囊菌亚门占比例为76.5%,而刺腿食蚜蝇中仅占22.2%,前者较后者高54.3个百分点;东亚飞蝗样本中担子菌亚门占比例为23.5%,而刺腿食蚜蝇中占77.8%,前者较后者低54.3个百分点。在属水平上,两个样本共发现19个属,分别为黑粉菌属(Filobasidium)、毕赤酵母属(Pichia)、假丝酵母属(Candida)、金担子菌属(Aureobasidium)、隐球酵母属(Cryptococcus)、拟威尔嗜杀酵母属(Cyberlindnera)、梅奇酵母属(Metschnikowia)、接合酵母属(Zygosaccharomyces)、Cystofilobasidium、Prototheca、Papiliotrema、掷孢酵母属(Sporobolomyces)、双足纲酵母属(Dipodascus)、Tetrapisispora、Kwoniella、裂殖酵母属(Schizosaccharomyces)、阿卡酵母属(Acaromyces)、威克汉姆酵母属(Wickerhamlella)、Udeniomyces。其中,两个样本共有的属为前15个属,东亚飞蝗特有的属为拟威尔嗜杀酵母属和掷孢酵母属、分别占1.16%和2.91%;刺腿食蚜蝇特有的属为双足纲酵母属(Dipodascus)和阿卡酵母属、均占1.49%;东亚飞蝗体内优势属均为线黑粉菌属和毕赤酵母属、分别占44.77%和34.30%,刺腿食蚜蝇体内优势属也为黑粉菌属、占43.28%;此外,东亚飞蝗和刺腿食蚜蝇体内相差最大的属为毕赤酵母属,前者较后者高28.82个百分点。
统计发现,共有的酵母属中,东亚飞蝗体内含量在1%以上的有6个,分别为线黑粉菌属44.77%、毕赤酵母属34.30%、假丝酵母属(3.49%)、Udeniomyces3.49%、隐球酵母属(Cryptococcus)1.74%、Papiliotrema1.74%;而刺腿食蚜蝇体内含量在1%以上的属有11个,分别为黑粉菌属43.28%、Udeniomyces7.46%、假丝酵母属7.46%、梅奇酵母属5.97%、金担子菌属(Aureobasidium)5.97%、毕赤酵母属4.48%、Cystofilobasidiu4.48%、Protocheca4.48%、Papiliotrema1.49%、Kwoniella1.49%、裂殖酵母属1.49%。此外,东亚飞蝗和刺腿食蚜蝇体内未分类的真菌分别占4.4%和12.6%。

图3 门水平菌群分类学组成和分布
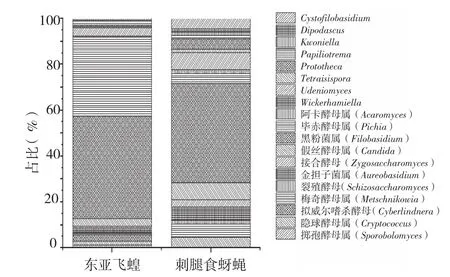
图4 属水平菌群分类学组成和分布

表5 各分类水平的微生物类群数统计
3 结论与讨论
新疆是东西方生物多样性的过渡带。从生态类型划分看,是欧洲夏干带和东亚夏湿带之间的过渡带。石河子地区属于北疆地区典型的寒温带气候,严酷的自然环境成为酵母菌进化的驱动力,因此其酵母菌多样性存在特异性。酵母菌的生存分布受其直接和间接生存微环境特征的影响[12],本研究中2个采样点较近,其生境在同一农业生态系统中高度重合,且东亚飞蝗和刺腿食蚜蝇均为杂食性昆虫[1,13],通过Alpha多样性分析和菌群结构分析发现刺腿食蚜蝇体内内生酵母菌多样性略高于东亚飞蝗,但差异性并不显著,二者的主要差别在于在于其体内特有的酵母。
统计分析发现,拟威尔嗜杀酵母和掷孢酵母只存在于东亚飞蝗体内。掷孢酵母的某些类群是人和植物的病原菌[14],从苹果葡萄等植株的叶片、花以及果实和其他单子叶植物中能够分离得到,并引起植物炎症[15]。昆虫内共生菌不仅能调控宿主昆虫的营养代谢和生殖代谢,还能协助昆虫抵御生物、非生物胁迫,提高昆虫对化学农药的抗性及对寄主植物的适应性等[16]而掷孢酵母某些菌株具有细胞分化抵抗逆境的特点,可作为研究发育调控和抗逆机制的潜在模式生物[17]。有研究表明其抗药性近年来也有增加趋势,导致传统的化学药物对蝗虫防治日渐式微[18-19]。在同一自然生境中,刺腿食蚜蝇体内并未发现掷孢酵母。表明蝗虫内掷孢酵母的的抗性机制可能是导致极端环境条件下蝗虫抗性增加的原因之一。掷孢酵母既是某些农林经济作物的病原菌,又可能是蝗虫抗性增加的调控因子。而野生的嗜杀酵母能够产生一定量的嗜杀因子以抵抗病原真菌的感染而不对自身产生作用[20-21],这在一定程度上解释了为何蝗虫体内存在病原真菌而不被感染。目前嗜杀酵母已广泛应用于食品工业[22]。本研究并未对掷孢酵母对蝗虫抗性调控的分子机理以及嗜杀因子的药理进行深入研究,也并未见相关报道,因此通过对其进一步研究可为相关农业病虫害的综合性治理提供新思路。
本研究通过荧光定量原位测序技术对酵母进行聚合酶链式反应转录间隔区限制性片段多态分析(PCR-ITS—RFLP)并进行了变性凝胶电泳分析,结果表明DGGE不适用于酵母种群多样性的定量测定,而PCR—ITS-RFLP所得结果不能完全反映样本酵母菌群结构多样性[23],但高通量测序技术能够检测和鉴定出更多的酵母类群[24]。本研究利用26S rDNA D1/D2区域序列的高通量测序,分析2种昆虫内生酵母菌种群结构,结果充分反映了2种具有不同生态功能昆虫内生酵母菌多样性的特征,为新疆丰富酵母菌资源的开发利用奠定了基础。但本实验所选NL1和NL2引物还检测到枝孢属(Cladosporium)、拟南芥属(Arabidopsis)等其他非酵母微生物类群,针对昆虫内生酵母高通量测序的引物选择有待进一步研究加以改进。

