应变及应变率评价心房颤动中左房功能新进展
邢雪柯 朱凯 许玲 练春燕 陈丽娜 综述 刘慧 审校
(哈尔滨医科大学心脏彩色超声心动图室,黑龙江哈尔滨150000)
心房颤动(atrial fibrillation,Af)是严重的心房异常电活动形式,也是临床最常见的心律失常之一。流行病学资料表明,全球有3 350万人患有Af,占世界人口的0.5%,欧洲与美国的Af患病率相似,而亚洲患病率明显低于美国。据估计,美国约有200万人患有阵发性或持续性Af,到2050年Af患者将达到1 200万,中国Af的患病率为0.77%~2.8%。近年来Af相关的发病率和死亡率正逐年增长,特别男性Af患病率明显增加,发生Af的风险是女性的1.5倍,这可能与人口老龄化,人均寿命延长所致的高血压、糖尿病的发病率增加相关。Af有着巨大临床影响,Af可引起血流动力学异常,严重时导致血栓栓塞、卒中、左室功能障碍、心功能降低,甚至心力衰竭等疾病[1]。Af以患病率高、致残率高、死亡率高为临床特点,使患者的生活质量深受影响。
1 斑点追踪技术:左房应变及应变率
斑点追踪技术是在二维视图下通过非多普勒方法对心肌形变进行客观的定量分析。近年来,已经证实了斑点追踪技术有着重要的可行性和可重复性。与传统组织多普勒技术相比,斑点追踪技术具有不受角度依赖性及低回声影响等优点。原本斑点追踪技术的发展是用来研究心室功能,但是近年来因斑点追踪技术在评估左房功能方面有着潜在的重要价值,被广泛用于评估心房功能,尤其是心房长轴应变及应变率。应变及应变率分别可表示某一处心肌的形变及形变率,对检测心肌纤维化、肌溶解、肌纤维混乱等十分敏感。在Af、心力衰竭、高血压等多种疾病中,心房长轴应变及应变率都可定性、定量地评价心房功能。每个新发Af的患者在定期随访中均行经胸超声心动图检查,特别关注左房的结构、大小、功能,左室的收缩、舒张功能,以及瓣膜的结构和功能。
1.1 左房应变及应变率测量方法
左房长轴应变及应变率是通过斑点追踪技术在二维切面图像上对心肌组织的斑点图像逐帧进行统计学分析从而鉴别出最匹配的区域。通过对图像的分析来追踪心肌的运动,并把两个相邻斑点回声之间的距离变化程度作为对心肌形变能力的评估。
在患者短暂的屏气及稳定的心电图下,于四腔心和两腔心的左房视图获得传统的二维灰阶超声心动图。一般来说三个连续的心动周期即可记录和评估,但对于Af的患者需要平均测量大约五个连续的心动周期,建议帧频设置在60~80帧/s。使用一种特殊的声学追踪软件对图像进行基于斑点的应变及应变率脱机半自动分析。
左房心内膜主要在两腔心及四腔心视图用点选式进行追踪。心外膜的追踪通常由系统自动获得一个兴趣区,可以手动测量调整其宽度和形状,再由软件分成六个节段,对每一节段的质量结果软件自动进行可取或不可取及进一步相关的可能性的评分。获取的节段中图像质量不佳者将由软件淘汰并自动排除在分析之外。如果患者的图像质量足够好,12个节段均可分析,并且由软件绘制出反映左房功能的长轴应变及应变率曲线。
1.2 左房应变及应变率曲线分析
1.2.1 应变曲线分析
在心房的存储期,由于左房是充盈伸展的状态,故应变曲线呈增加趋势,在左房充盈期末二尖瓣开放前曲线达到第一个正向峰值。二尖瓣开放后左房迅速排空容积减少,应变开始减低,相当于在舒张期时达到一个平稳期。窦性心律的患者一般在平稳期之后出现第二个正向峰值,第二个正向峰值发生在心房收缩期前,较第一个正向峰值小,在心房收缩后曲线以一负向峰值结束(见图1)。
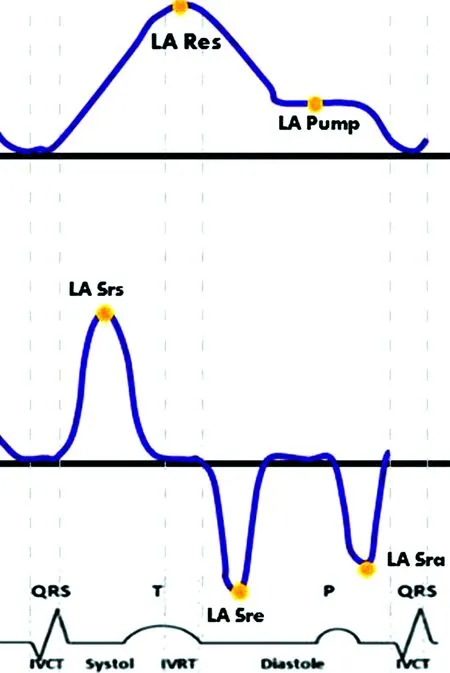
注:上图可见窦性心律患者一个正向峰值、平台期,以一负向峰值结束,及各峰值所对应相对的心动周期;下图可见一正向峰值与两个负向峰值,及各峰值所对应相对的心动周期。
图1左房应变曲线(上)和应变率曲线(下)所对应心动周期
左房通过以下三个功能调整左室的被动及主动充盈:心室收缩期的存储功能、心室舒张早期的管道功能及心室舒张末期的辅助泵功能。窦性心律的患者中,以心电图的R波起点为参考点可以识别出第一个正向峰值为左室收缩期左房应变(left atrial strain during LV systole,LASs),第二个负向峰值为心房收缩期左房应变(left atrial strain during atrial contraction,LASa),以及平稳期为舒张早期左房应变(left atrial strain during early diastole,LASe),分别代表左房的存储、辅助泵及管道功能。Af时认为心房的存储及管道功能降低,辅助泵功能消失。因此在这类患者中,只有收缩期正向应变峰值(LASs,是表现心房的顺应性最重要的应变参数)和舒张期负向应变峰值(LASa)。
1.2.2 应变率曲线
同样,在左房应变率曲线中包括正向峰值的左室收缩期左房应变率(left atrial strain rate during LV systole,LASRs)、第一个负向峰值的心房收缩期的左房应变率(left atrial strain rate during atrial contraction,LASRa),以及第二个负向峰值的左室舒张期的左房应变率(left atrial strain rate during early diastole,LASRe)。软件自动把左房壁分为6个节段,LASs、LASRs的平均值均可用作分析(见图2)。

注:A图可见窦性心律患者一个正向峰值、平台期,以一负向峰值结束;B图可见一正向峰值与两个负向峰值。
图2在2D四腔心视图下测得左房长轴应变曲线A和应变率曲线B
2 Af患者的心房应变及应变率
2.1 心房重塑的评估
Af的心房应变及应变率在流行病学、临床以及经济学等方面均是重要的超声检测参数,可以早期追踪心房结构和功能的改变并预测新发Af。
过去的研究显示,左房容积越大发生Af的风险越高,特别是二尖瓣关闭时左房的最小容积与二尖瓣开放前左房的最大容积被看做是第一个能独立预测Af发生的指标。然而,有研究表明该指标在不同的操作者间有很高的变异性,不适用于Af的预测。在无房性心律失常病史的患者中,当心房结构发生重塑时其泵血功能减低,LASa可以证明Af发展趋势的起始进程,是特异性极强的参数[2]。
Af的典型特征就是心房的重塑,随着胶原纤维在间质的反应性沉积引起大面积纤维化,改变了正常的传导通路,而且心房纤维化呈进行性增加的趋势,进而转变为永久型。故防止心房纤维重塑是治疗基础,对纤维化早期的诊断更有助于指导特定的治疗方案。心血管磁共振成像钆对比剂的对比增强检查是心房纤维化鉴定的重要工具,并且已经明确是可观察组织坏死的方法,注射钆对比剂后,与正常组织相比病变区域毛细血管密度减低,引起钆对比剂流出减少,使得病变区域钆浓度增加,局部信号增强。左房纤维化程度是预测射频导管消融治疗结果的根本依据。然而心脏磁共振成像的价格昂贵,并且钆对比剂的肾损伤等副作用不容小觑。
左房应变及应变率在明确左房应力增加和心肌纤维化方面有很大的意义。Kuppahlly等[3]已经证实心血管磁共振成像钆剂延迟增强对心肌纤维化程度的测量和左房应变结果呈现明显负相关,持续性Af患者比阵发性Af患者负相关性更加明显,这方面可以预测Af持续时间、心房间质重塑和左房机械功能障碍之间的联系。
心室收缩期房室瓣关闭后,左房发挥储存血液的功能。此储存功能受心房舒张及心房腔应力的影响。Af患者应变及应变率降低与左房重塑、左房扩张、间质纤维化增加等相关,这些左房重塑的改变导致了左房应力改变和储存功能的损伤。左房应力增加代表心房顺应性和收缩功能的降低、左房重塑增加,可通过E/e’和左房应变及应变率等非侵入性方法获得。另外在阵发性Af的患者中,左房应变降低,存储功能下降,左房应力明显增加[4]。
2.2 心源性栓塞卒中
缺血性卒中是导致Af患者发病率和死亡率增加的主要原因之一。心房收缩能力的丧失和血流的瘀滞促进了左房血栓的形成,多数发生在左心耳。左心耳是左房解剖结构的一部分,是胚胎期原始左房的残留部分,与左房功能关系密切,当左房功能受损时,左心耳出现收缩、舒张功能的改变,引起排空能力下降,血流速度缓慢,从而导致血栓形成。
左房应变及应变率有双重作用。首先,左房应变及应变率是评估血栓栓塞风险的重要工具。在持续性Af的患者中,左房应变及应变率与卒中风险独立相关,在卒中事件发生前表现为形变降低。在高血压合并阵发性或持续性Af的患者中,左房应变及应变率与心源性栓塞风险呈负相关[5]。其次,左房应变及应变率可以有效地预测左房的血流瘀滞。目前已经证实左房应变及应变率的减低与7 d内新发的因左心耳功能障碍引起的急性缺血性卒中独立相关,若能增加经胸超声心动图在检测左心耳功能不良方面的敏感性,可能对早期诊断血栓形成和卒中预测有一定的作用[6]。左房应变及应变率和CHADS2评分、左房容积之间的联系可以为风险分级提供新的参数。尤其针对出血风险高、应用抗凝治疗困难的患者,如果CHADS2评分高、左房形变差,需要考虑更强的抗凝治疗或小剂量抗凝合并抗血小板治疗。如果患者CHADS2评分低、左房形变好可能只需要抗血小板治疗,从而避免过高的出血风险。
左室充盈压是指心室舒张期左房与左室之间的压力差,反映了左室的前负荷情况,受心肌收缩力、循环血容量、舒张特性等影响。左室充盈压可用E/e’评估;近期发现左室充盈压的升高与阵发性Af的卒中风险相关[7]。在评估患者舒张功能障碍方面左房应变及应变率是一个新兴的附加参数[8]。
由于对左房形变力的降低和卒中风险增加之间关系的研究很少,故其机制并不清楚。磁共振成像相关报道已经证实一种机制是在储存期应变的降低和左房纤维化紧密相关,左房壁纤维化使得储存期左房腔的顺应性降低。左房形变力降低代表了储存期左房顺应性的降低,可能会导致左房血流的瘀滞,因此和血栓栓塞风险增加相关,还需要更多的研究来证实这个机制。另一方面,在明确诊断后大约有25%的缺血性卒中的发生是隐源性的,在这类患者中,以阵发性Af患者发生居多,因此,左房应变及应变率是一个明确心房损害的有用指标,并指导血栓栓塞的病因诊断,故将左房应变及应变率作为一个诊断这类患者的工具[9]。
2.3 瓣膜病及冠状动脉疾病中的Af
二尖瓣瓣膜病是导致Af的一个重要危险因素,尤其是二尖瓣反流引起心房结构的改变,而左房壁及心腔结构的改变最终可引发新的心律失常的发生,在这类患者中仍然没有一个能明确地预测Af进展的方法。已经证实整体左房应变及应变率受二尖瓣反流程度的影响,在既往病史中有阵发性Af发作时这些指标的数值更低,甚至在非可逆性重塑发生前,应变及应变率结果就有预测左房损伤的能力。对于已达到心脏手术标准的重度二尖瓣反流,在评价左房形变损伤的参数中,整体左房应变及应变率表现出与左房纤维化及重塑程度明显相关性[10]。左房应变及应变率用于预测二尖瓣术后患者Af的发生,也可用于明确术前手术风险及预防性治疗的潜在需要。风湿性二尖瓣狭窄的患者中左房应变及应变率亦受到影响,在这类瓣膜病中,无症状的患者可发展为Af,甚至因心室充盈过程中心房功能丧失引起病情进一步发展为肺水肿,在对这类患者进行4年的随访中发现,左房应变及应变率在预测新发Af方面具有良好的特异性及敏感性[11]。主动脉瓣置换术后所发生的Af是严重的并发症之一,可以将整体左房应变及应变率作为预测心房功能障碍及进行危险分层的指标[12]。
冠状动脉术后Af的发生率达50%,是围手术期死亡风险的一个重要因素,有极高的发病率和死亡率。冠状动脉术后Af的发生与死亡率的增加及各种并发症的发生有密切关系,因此对于高风险患者Af特异性预测指标极其重要。由高血压、年龄、手术引起的二尖瓣缺血或负荷过重等因素造成的潜在的心房功能障碍,是术后新发Af的病变基础。左房应变及应变率可检测心肌纤维化异常、肌纤维溶解等异常情况,从而早期明确左房功能障碍,也可作为除了年龄、左房容积等指标外这类患者的术前风险评估指标[13]。
2.4 Af的治疗和随访
Af患者恢复至窦性心律的主要治疗方法有药物复律、电复律、射频导管消融术等,虽然电复律的成功率>90%,但1年内Af复发率>50%。如果复律未见效可行射频导管消融术,射频导管消融术可阻断新发及持续性Af的异常电传导通路。预测复律是否成功的主要指标有:左房大小、年龄、Af类型和CHADS2评分等,许多研究已经证实左房应变及应变率比其他指标在预测射频导管消融后Af复发可能性方面是更好更独立的指标,并且LASRs与年龄呈现负相关,而LASRa与年龄正相关。
由于介入治疗有较高的风险,在选择患者时要更加慎重,左房应变及应变率是合适的筛选指标。心房重塑的程度是Af消融是否成功的重要因素之一。在射频导管消融之前,左房应变及应变率可作为左房是否能够逆转重塑的独立预测指标,对于经过射频导管消融的患者左房应变及应变率的预测价值最高。左房应变及应变率可用于阵发性和持续性Af患者经过射频导管消融后预测是否能维持窦性心律,在射频导管消融术后若左房应变及应变率没有明显的增加,就有心律失常进一步发展的可能[14]。经电复律及射频导管消融治疗后左房应变率立即降低,之后再增加,并在复律后4周达到一个最大值,此种增加趋势与逆转左房重塑的进程相关。在复律6个月之后,维持窦性心律的患者比Af复发患者的左房应变及应变率的数值更高。经过长期随访发现,如果左房应变及应变率严重受损,经射频导管消融后心房纤维化不能逆转并可进一步进展[15]。
2.5 局限性和前瞻性
左房应变及应变率的测量需要清晰的视图和较好的操作技术。由于缺乏心房应变及应变率的分析软件,目前将左室分析软件用于心房的分析。通过使用不同机型进行研究比较发现,不同机型的分析软件采用不同的应变及应变率分析算法,可能使结果有些偏差。而且,在获得左房真实形状时可能受到左房周围结构的信号干扰。正如之前提到的,与窦性心律的患者相比,Af患者测量参数的可靠性和可重复性更低,故需要在5个连续的心动周期下测量。
斑点追踪技术在很多领域的应用逐渐增加。左房应变及应变率的分析软件也正在研究中,随着三维斑点追踪技术的完善,将更充分地用于应变及应变率参数的研究中。三维斑点追踪技术针对Af患者显示出更好的可重复性,不但可分析左房的长轴变形,还可用于圆周、径向和面积应变及应变率的研究[16]。随着这些技术的不断提高完善,对Af的研究也会更加的全面。
3 结论
Af对临床预后影响很大,并且患病率呈逐年上升趋势,对Af患者的血栓栓塞事件及其他并发症如心力衰竭等的风险进行明确评估是非常必要的。超声心动图在这方面发挥着重要作用,特别是斑点追踪技术的新参数如左房应变及应变率在诊断、预测、随访等方面得到了广泛应用,而且对结构改变、心肌纤维化的程度及左房应力方面的定量分析能力有更好的准确性和可重复性。

