抗人CD30单克隆抗体的制备和活性研究
王蓉,李良,张胜华,甄永苏,苗庆芳
抗人CD30单克隆抗体的制备和活性研究
王蓉,李良,张胜华,甄永苏,苗庆芳
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所肿瘤室
制备抗人 CD30 单克隆抗体并进行活性研究,为其作为抗体偶联药物的靶向运输载体提供研究依据。
通过基因工程技术构建真核表达载体 pIZDHL-CD30-IgG,将质粒稳定转染 CHO/dhFr-细胞并筛选,获得稳定表达 anti-CD30-IgG 抗体的细胞株并纯化抗体,通过 HPLC 检测其纯度。ELISA、Biacore 和流式细胞术实验检测 anti-CD30-IgG 的亲和活性;免疫荧光共聚焦实验观察其在肿瘤细胞的内吞情况;利用小动物活体成像技术研究抗体在 NOD/SCID 鼠移植瘤模型中的靶向性。
成功构建了 anti-CD30-IgG 抗体的表达载体,并筛选出稳定表达的单克隆细胞株 CHO-CD30-IgG,纯化后的抗体 anti-CD30-IgG 纯度达到 98% 以上。Anti-CD30-IgG 与重组人 CD30 抗原具有很好的亲和活性,亲和常数为 4.15 × 108L/mol,其可通过肿瘤细胞表面 CD30 受体介导的内吞进入细胞。在 NOD/SCID 小鼠 L540 和 Karpas299 移植瘤模型中,anti-CD30-IgG 可以选择性地富集并滞留在肿瘤部位。
Anti-CD30-IgG 对抗原和肿瘤细胞具有高亲和性和特异性,并且可被内吞进入肿瘤细胞内部,在小鼠体内可选择性靶向并且长时间滞留在肿瘤部位,可作为抗体偶联药物中“弹头”部分的靶向输送载体。
抗原,CD30; 抗体,单克隆; 霍奇金病; 大细胞,间变性
霍奇金淋巴瘤(Hodgkin lymphoma,HL)和间变性大细胞淋巴瘤(anaplastic large cell lymphoma,ALCL)是恶性血液肿瘤且在青少年中发病率较高。随着化疗、放疗等一线治疗技术的发展,HL 和 ALCL 治疗取得了重大进展,但仍有约 10% 的 HL 患者和 40% ~ 60% 的ALCL患者对一线治疗无应答或治疗后复发,需要接受自体造血干细胞移植(autologous hematopoietic stem-cell transplantation,ASCT)[1-2]。虽然 ASCT 在复发性和难治性淋巴瘤的治疗中表现为较好的治愈率,但仍有约 50% 的患者经二次治疗后复发,后续治疗愈加困难[3]。因此,复发性和难治性 HL 和 ALCL 仍是血液肿瘤治疗的重点和难题。
CD30 是肿瘤坏死因子受体超家族(tumor necrosis factor receptor superfamily,TNFRSF)成员之一,属于 I 型跨膜糖蛋白,在多种恶性血液瘤中过表达,包括 HL 和 ALCL[4]。CD30 低表达于非病理状态下活化的 T 细胞、B 细胞表面,而在正常细胞不表达[5]。CD30 在肿瘤细胞的高度特异性和选择性表达使其成为抗体靶向药物的理想靶点,而以 CD30 为靶点的单克隆抗体及抗体偶联药物的发展为 HL 和 ALCL等恶性血液肿瘤的治疗提供了新策略。SGN-30 是靶向 CD30 的嵌合抗体,其通过抗体依赖的细胞吞噬作用(antibody-dependent cellular phagocytosis,ADCP)在体内发挥较好的抗肿瘤效果[6],而抗体偶联药物(antibody-drug conjugate,ADC)SGN-35(brentuximab vedotin,BV)是由 SGN-30 通过连接肽与微管抑制剂 MMAE 偶联而成,已获美国 FDA 批准上市并在临床上取得了突出疗效[7-8]。尽管如此,在复发性或难治性 HL 患者的临床试验中,BV 治疗显示中位无进展生存期不到 10 个月,而五年无进展生存率仅为22%[9-10]。在一项随机、双盲、控烟的三期临床试验中,经 BV 治疗出现外周感觉神经病变的患者占 50% 以上[11]。此外,有报道表明,其“弹头”药物 MMAE 导致的耐药性是患者对 BV 治疗产生耐药性的主要因素之一[12]。因此,以 CD30 为靶点研发新型针对 HL 和 ALCL 的抗体及 ADCs 具有重要意义。
本研究构建了以 CD30 为靶点的抗体 anti-CD30-IgG 并实现了其在 CHO 细胞的高效表达,进一步研究了该抗体与 CD30 抗原和肿瘤细胞的亲和性和特异性,以及其在小鼠移植瘤模型中的肿瘤靶向性,为其作为抗体偶联药物的靶向运输载体提供研究依据。
1 材料与方法
1.1 材料
1.1.1 细胞系 中国仓鼠卵巢细胞 CHO/dhFr-细胞购自美国模式培养物集存库(ATCC);人霍奇金淋巴瘤细胞系 L540 和 L428 购自美国 Creative Bioarray 公司;人间变性大细胞淋巴瘤细胞系 Karpas299 和 SU-DHL-1 购自北京博奥派克生物科技有限公司;人 Burkitt 淋巴瘤细胞系 Raji 由本室传代保存。
1.1.2 主要试剂 T4 DNA 连接酶及限制性内切酶系列产品均购自美国 NEB 公司;DAPI 购自北京索莱宝生物科技有限公司;重组人 CD30 蛋白(Catalog # 6126-CD)购自美国 R&D Systems 公司;胎牛血清(FBS)为美国 Gibco 公司产品;RPMI-1640 培养基为美国 Hyclone 公司产品;FITC 标记山羊抗人抗体购自北京中杉金桥生物技术公司;Alexa Fluor 488 标记羊抗人 IgG(Fcγ特异性)抗体购自美国 Jackson Immuno Research 公司;山羊抗人 IgG(γ 链特异性)、碱性磷酸酶标记山羊抗人 IgG(Fc 特异性)抗体购自 Sigma 公司;BCA 试剂盒和 DyLight 680 抗体标记试剂盒购自美国 Thermo Scientific 公司;尼妥珠单抗购自百泰生物药业有限公司。
1.1.3 耗材 细胞培养瓶、细胞培养板、细胞培养皿、离心管等细胞培养耗材均购自美国 Corning 公司;PD-10 脱盐柱、抗体纯化柱子 Protein G HP 为美国 GE Healthcare 公司产品;超滤离心管购自美国 Millipore 公司。
1.1.4 质粒 抗体表达质粒 pIZDHL 由美国德克萨斯大学西南医学中心刘小云博士惠赠。
1.1.5 实验动物 18 ~ 22 g 雌性 NOD/SCID 小鼠购自北京维通利华实验动物技术有限公司,饲养在 SPF 环境中。所有受试动物均可自由进水和摄食,所有实验均按照国际公认的实验动物照料和使用原则进行。
1.2 方法
1.2.1 Anti-CD30-IgG 的轻链和重链可变区序列设计 Anti-CD30-IgG 抗体的重链可变区(VH)和轻链可变区(VL)序列来自 anti-CD30 抗体 AC10 的 VH 和 VL 序列(美国专利 Pub. No. US2008/0267976 A1),分别在其 5' 端加入 Kozak 序列(GCCACC)和信号肽序列(轻链信号肽ATGGAGACAGACACACTCCTGCTATGGGTACTGCTGCTCTGGGTTCCAGGTTCCACTGGTGAC;重链信号肽ATGGGTTGGTCTTGTATTATCCTGT TCCTGGTCGCTACCGCCACTGGGGTCCACTCA),以增强基因的翻译效率和蛋白的分泌表达。此外,VL 基因两端加入I 和WI 酶切位点,VH 基因两端加入I 和I 酶切位点。上述基因序列由南京金斯瑞生物科技有限公司合成。
1.2.2 表达载体的构建 将 VL 基因序列经
I 和W I 双酶切后,用1.5% 琼脂糖凝胶电泳进行酶切产物分离,切下 250 ~ 500 bp 之间区域的目的 DNA 片段,并用 DNA 胶回收试剂盒纯化线性目的片段。使用 T4 DNA 连接酶连接 VL 基因片段和经I 和W I 双酶切后的真核表达载体 pIZDHL,将获得的重组质粒转化 DH5α 感受态细胞,挑选克隆进行质粒提取并酶切验证 VL 基因是否成功连接,正确的质粒命名为 pIZDHL-VL。将质粒 pIZDHL-VL 和 VH 基因分别以I 和I 双酶切,使用 T4 DNA 连接酶连接双酶切后的基因片段,将获得的重组质粒转化 DH5α 感受态细胞,挑选单克隆进行质粒提取并酶切验证 VL 和 VH 基因是否分别连接上,并测序验证序列的正确性。将测序正确的单克隆进行质粒提取,将重组质粒命名为 pIZDHL-CD30-IgG。
1.2.3 表达载体转染 CHO/dhFr-细胞 将质粒 pIZDHL-CD30-IgG 经I 酶切线性化后回收,采用 Lipofectamine 3000 试剂盒稳定转染 CHO/dhFr-细胞,然后加入博来霉素进行筛选,同时培养基中去除次黄嘌呤和胸腺嘧啶。由于转染质粒上有博来霉素抗性基因和二氢叶酸还原酶基因,只有质粒转染成功并整合到基因组上的细胞才能生存。经 2 ~ 3 周的筛选,存活的细胞团即为阳性细胞,挑选表达量较高的阳性细胞运用博来霉素和有限稀释法进行单克隆筛选。
1.2.4 ELISA 法筛选高表达细胞株 运用双抗体夹心 ELISA 测定细胞培养上清中的抗体浓度。96 孔板包被羊抗人 IgG(γ 链特异性)抗体并用 2% BSA 封闭。标准品为人源化抗体尼妥珠单抗,将待测细胞培养上清和不同浓度的标准品加入包被的 96 孔板,37 ℃孵育 1 h,PBST 洗 3 次,加入碱性磷酸酶标记的山羊抗人 IgG(Fc 特异性)二抗,37 ℃孵育 1 h,PBST 洗 3 次,加入显色底物 p-NPP 试剂,室温孵育 5 ~ 10 min,于酶标仪检测 405 nm 处的吸光度值。从中筛选出抗体表达量最高的一株细胞命名为 CHO-CD30-IgG,进行扩大培养,其表达的抗体命名为 anti-CD30-IgG。
1.2.5 Anti-CD30-IgG 的纯化和鉴定 将细胞株 CHO-CD30-IgG 扩大培养,待其在 T75 细胞培养瓶中贴壁培养密度达到 90% 以上,1:2 的比例转入新的 T75 培养瓶中贴壁培养 24 h,将培养液换成无血清培养基(CD OptiCHOTM培养液 +2 mmol/L L-谷氨酰胺),于细胞培养箱中持续培养 10 d 后收集细胞培养液,通过 Protein G 亲和层析柱分离纯化蛋白。将纯化后的抗体通过 SDS-PAGE 凝胶电泳和 HPLC 法检测抗体的纯度,并用 BCA 试剂盒(标准品为牛血清免疫球蛋白 BGG)测定抗体的浓度。
1.2.6 ELISA 法检测 anti-CD30-IgG 与重组人 CD30 抗原的亲和活性 96 孔板包被重组人 CD30 抗原,浓度分别为 0.2、0.4 和 0.8 μg/ml,并用 2% BSA 封闭。加入梯度稀释的 anti-CD30-IgG,37 ℃孵育 1 h。后续步骤同 1.2.4 所述。
1.2.7 Biacore 实验检测 anti-CD30-IgG 与重组人 CD30 抗原的亲和常数 将 CM5 芯片偶联山羊抗人 IgG,使其可以捕获抗体的 Fc 段,将抗体用 HEPES 缓冲液稀释到 1 μg/ml 并富集到芯片上。用 pH 4.5 的醋酸钠缓冲溶液倍比稀释 CD30 抗原,终浓度分别为 65、32.5、16.25、8.13、4.06 和 2.03 nmol/L。利用 Biacore 仪器将抗原浓度从高到低依次流过抗体表面使其结合,每个浓度完成后用 3 mol/L MgCl2溶液洗脱抗原和抗体,再重新富集抗体随后加入抗原与之结合、解离(流速为30 μl/min)。用 Biacore T200 计算软件处理实验结果,得出抗原-抗体相互作用的结合速率常数、解离速率常数以及亲和常数。
1.2.8 流式细胞术法检测 anti-CD30-IgG 与肿瘤细胞的亲和活性 将 200 μl细胞悬液(3 × 105个细胞)与梯度稀释的 anti-CD30-IgG 溶液 4 ℃共孵育 1 h,1500 r/min 离心 5 min,弃上清。PBS 洗涤两次后,加入FITC 标记的羊抗人 IgG 于 4 ℃避光孵育 1 h,1500 r/min 离心 5 min,弃上清。PBS 洗涤两次后用 500 μl PBS 重悬细胞,300 目尼龙滤网过滤后流式细胞仪检测荧光强度。
1.2.9 免疫荧光共聚焦实验检测 anti-CD30-IgG 与肿瘤细胞的结合及内吞活性 将处于对数生长期的 Karpas299、L540 和 Raji 细胞分别制成单细胞悬液,细胞计数并调整其浓度,按每孔 3 × 104个细胞分别接种于 96 孔板中,37 ℃培养 2 h 后加入 CD30-IgG-LDP,终浓度为 5 μg/ml,4℃孵育30 min 或 37 ℃孵育 24 h 检测其与细胞表面抗原的结合及内吞情况。收集细胞样品,PBS 洗 2 次,用细胞甩片机将细胞离心至载玻片上,4% 多聚甲醛固定 10 min,PBST 洗 3 次,0.2% TritonX-100 溶液(溶剂为 PBS)透化 10 min,PBST 洗 3 次,用 5% 的羊血清室温封闭 2 h。滴加 Alexa Fluor488标记的抗人荧光二抗于 37 ℃孵育 30 min,PBST 洗 3 次,DAPI 染细胞核 15 min,PBST 洗 3 次,滴加抗荧光淬灭剂,盖上盖玻片并用指甲油将盖玻片四周封闭,晾干后于免疫荧光共聚焦显微镜观察。
1.2.10 小动物活体成像技术检测 anti-CD30-IgG的体内肿瘤靶向能力 将霍奇金淋巴瘤细胞 L540 和间变性大细胞淋巴瘤细胞 Karpas299 计数调整至 2.5 × 107个/ml,接种至 NOD/SCID 鼠右侧腋下,每只接种 200 μl。当肿瘤体积至 200 ~ 400 mm3,将 DyLight 680 标记的 anti-CD30-IgG 抗体通过尾静脉注射入荷瘤小鼠体内(n = 2),注射剂量为 20 mg/kg。在给药后选择一系列时间点,利用 XENGOEN小动物活体成像仪进行观察并于不同时间点监测标记抗体在荷瘤裸鼠体内的分布情况。
2 结果
2.1 表达载体的鉴定
pIZDHL 和 pIZDHL-CD30-IgG 质粒示意图如图 1 所示。对构建的表达载体 pIZDHL-CD30-IgG 分别经I、WI 双酶切和I、I 双酶切鉴定,结果如图 2 所示。VL 和 VH 基因片段的理论长度分别为 414 bp 和 426 bp,pIZDHL-CD30-IgG 经双酶切后,VL 和 VH 片段的电泳条带在 400 bp 左右,与预期一致。
2.2 ELISA 筛选高表达单克隆细胞株
将成功转染并经 ELISA 鉴定成功表达目标抗体的细胞进行有限稀释,从有限稀释的 96 孔板中挑选形态较好的单克隆进行扩大培养。每种单克隆细胞计数后,取 2 × 105个细胞在 1 ml 培养基中培养 96 h,然后取其上清用 ELISA 方法检测目的抗体 anti-CD30-IgG 的表达量。如图 3 所示,101 株单克隆细胞都表达抗体 anti-CD30-IgG,表达量各有差异,其中 63 号单克隆细胞抗体表达量在 12 mg/L以上,明显高于其他单克隆细胞,将此细胞株命名为 CHO-CD30-IgG 并进行扩大培养。
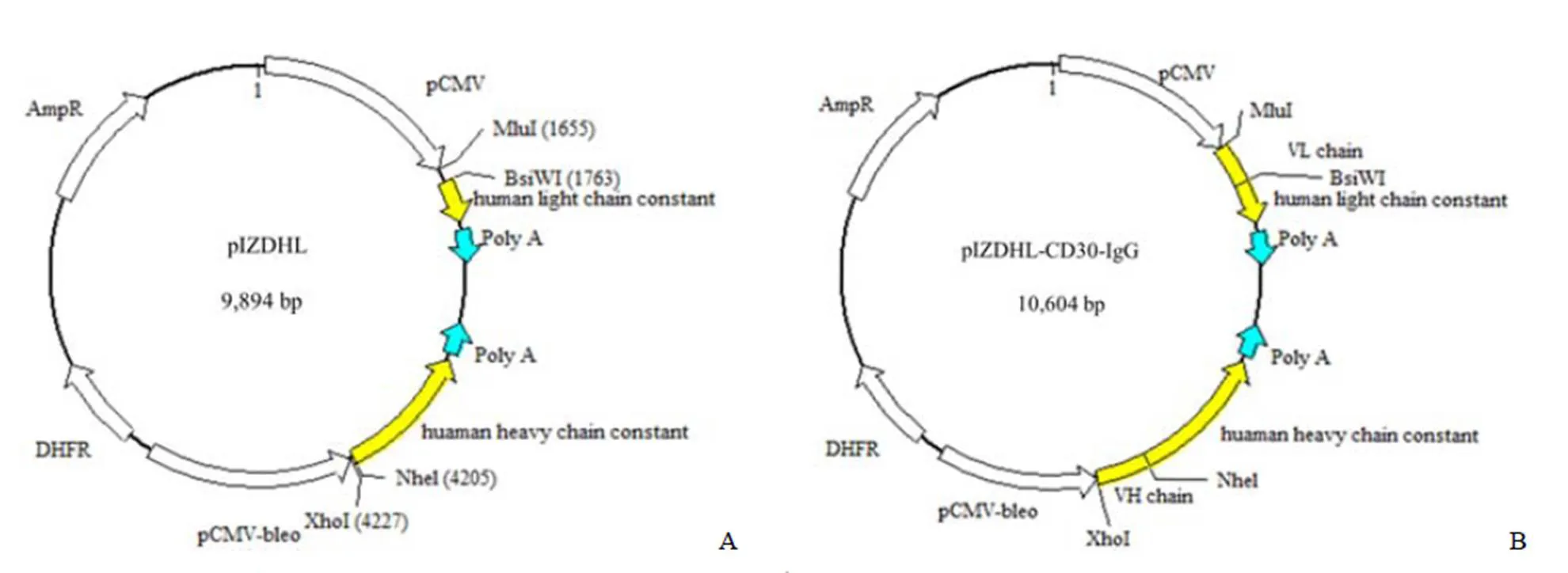
图 1 质粒结构示意图(A:pIZDHL;B:pIZDHL-CD30-IgG)
Figure 1 Schematic diagrams of plasmids (A: pIZDHL; B: pIZDHL-CD30-IgG)
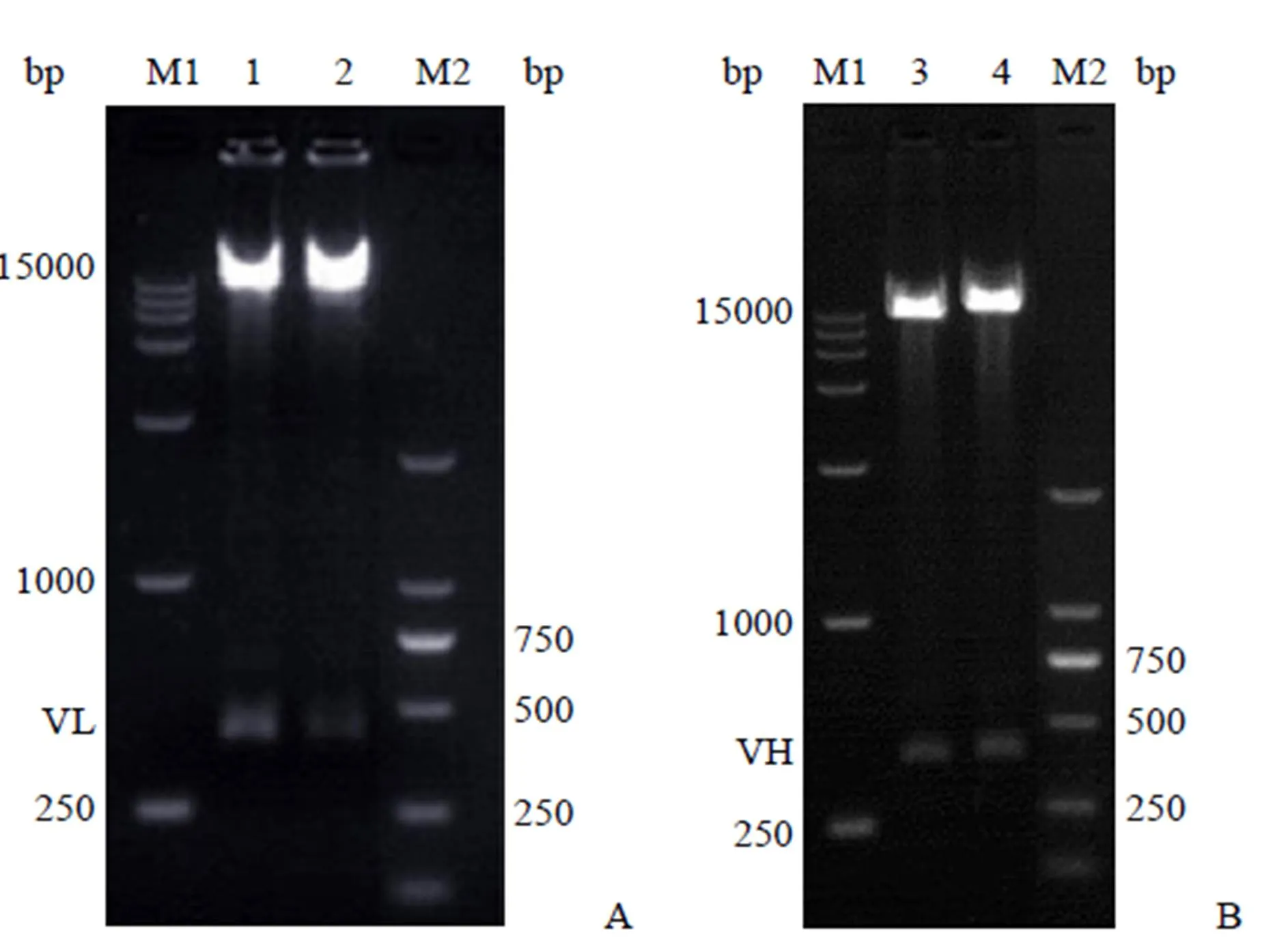
M1:DL15000 分子量标准;M2:DL2000 分子量标准;1~2:pIZDHL-CD30-IgG 经Mlu I、BsiWI 双酶切鉴定 VL 片段;3~4:pIZDHL-CD30-IgG 经Xho I、Nhe I 双酶切鉴定 VH 片段
Figure 2 Determination of plasmid pIZDHL-CD30-IgG by agarose gel electrophoresis (A: Analysis of pIZDHL-CD30-IgG after being digested withI andWI; B: Analysis of pIZDHL-CD30-IgG after being digested withI andI)
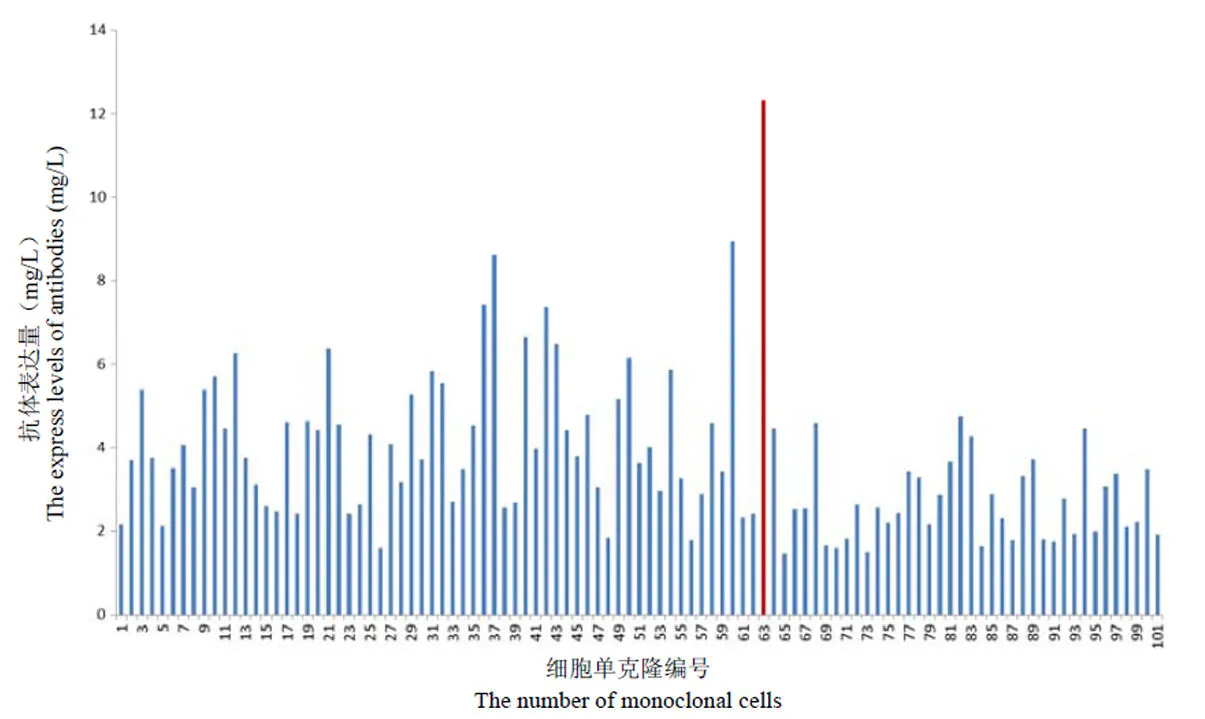
图 3 不同单克隆细胞中 anti-CD30-IgG 表达量的筛选结果
Figure 3 The expression levels of anti-CD30-IgG in single cell clones
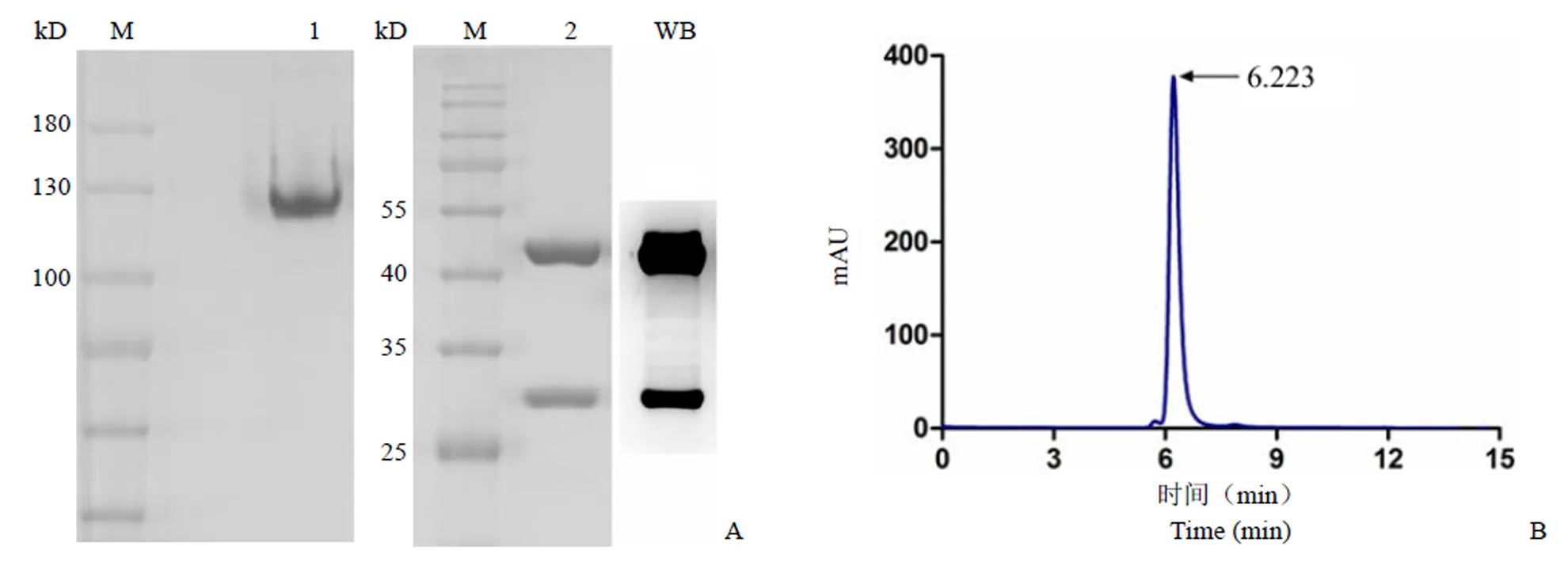
M:蛋白分子量标准;1:Anti-CD30-IgG 非还原电泳条带;2:Anti-CD30-IgG 还原电泳条带;WB:抗人 IgG 二抗探针检测抗体重链和轻链的结果
M: Protein marker; 1: Anti-CD30-IgG under non-reducing condition; 2: Anti-CD30-IgG under reducing condition; WB: Heavy chains and light chains detected by anti-human IgG
图 4 SDS-PAGE、Western blot(A)和 HPLC(B)分析 anti-CD30-IgG 的表达纯化结果
Figure 4 Analysis of purified anti-CD30-IgG by SDS-PAGE, Western blot (A) and HPLC (B)
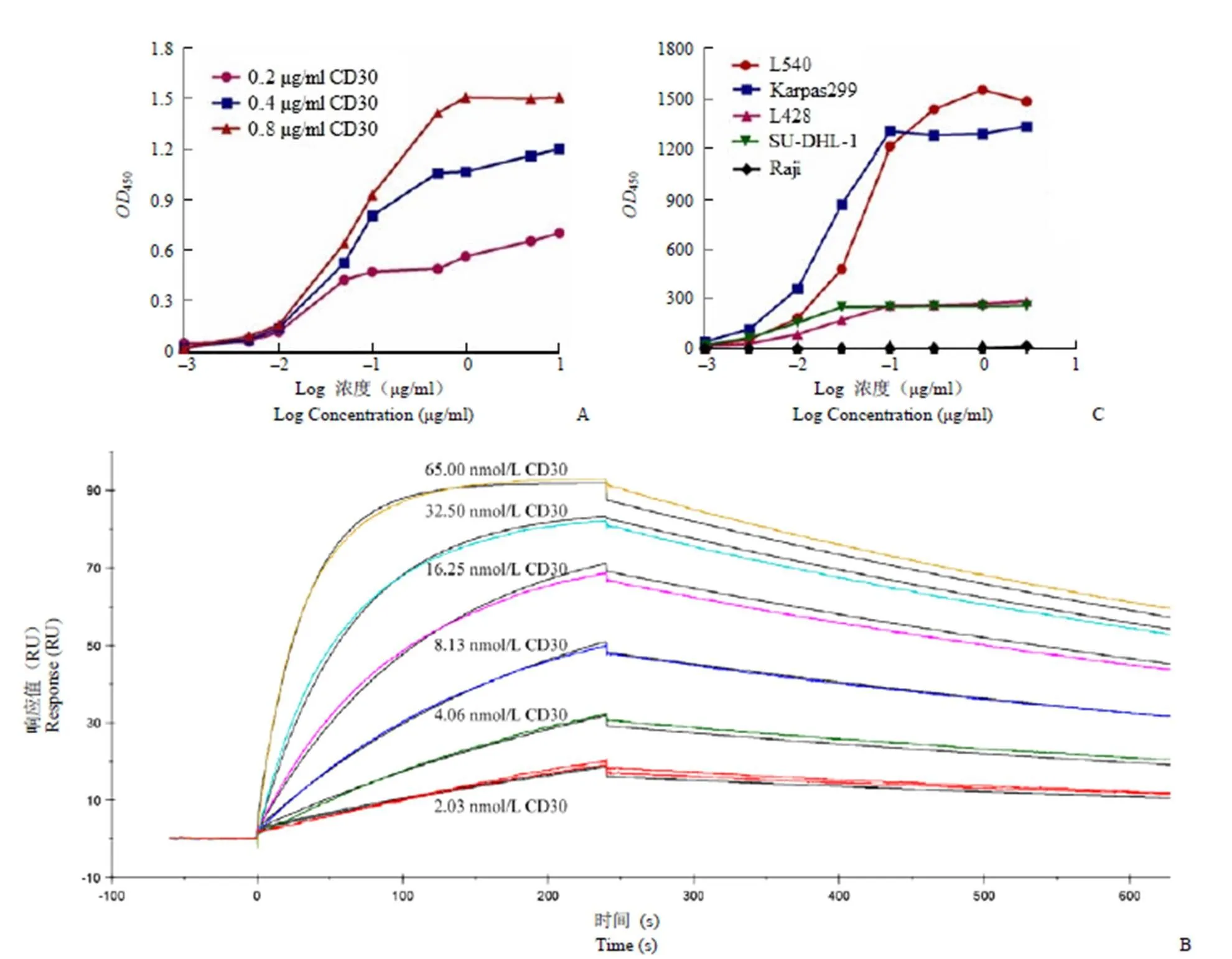
图 5 ELISA(A)、Biacore(B)和流式细胞术法(C)检测 anti-CD30-IgG 的亲和活性
Figure 5 Binding affinity analysis of anti-CD30-IgG by ELISA (A), Biacore (B) and flow cytometry (C)
2.3 Anti-CD30-IgG 的纯化和纯度分析
将对数生长期的 CHO-CD30-IgG 细胞培养基更换为无血清培养基,继续培养 10 d 后收集上清,上清中的抗体经 Protein G 亲和层析柱纯化,抗体产量约为 20 mg/L。利用 SDS-PAGE 凝胶电泳鉴定抗体的纯度和结构,如图 4A 所示,非还原状态下,抗体为单一的完整条带,分子量在 150 kD 左右;还原状态下,抗体链间二硫键断裂,表现为轻链和重链两条带,分子量在 25 kD 和 50 kD 左右,与理论大小相符。通过 HPLC 更加直观地检测抗体的纯度,在 280 nm 波长下显示为单一蛋白峰,其纯度在 98% 以上(图 4B)。
2.4 Anti-CD30-IgG 的亲和活性分析
2.4.1 Anti-CD30-IgG 与重组人 CD30 抗原的亲和活性 ELISA 实验检测anti-CD30-IgG 与重组人 CD30 抗原的结合活性。如图 5A 所示,不同浓度的 anti-CD30-IgG 分别与 0.2、0.4 和 0.8 μg/ml CD30 结合,均呈现典型的 S 型曲线,在抗原-抗体结合未饱和情况下,其相互结合具有抗体浓度依赖性和抗原浓度依赖性。进一步通过 Biacore 实验计算抗原-抗体的亲和常数,两者的结合、解离曲线如图 5B 所示,anti-CD30-IgG 与重组人 CD30 抗原的亲和速率常数(k)为 4.61 × 105L/(mol·s),解离速率常数(k)为 1.10 × 10-3/s,亲和常数(K=k/k)为 4.15 × 108L/mol。
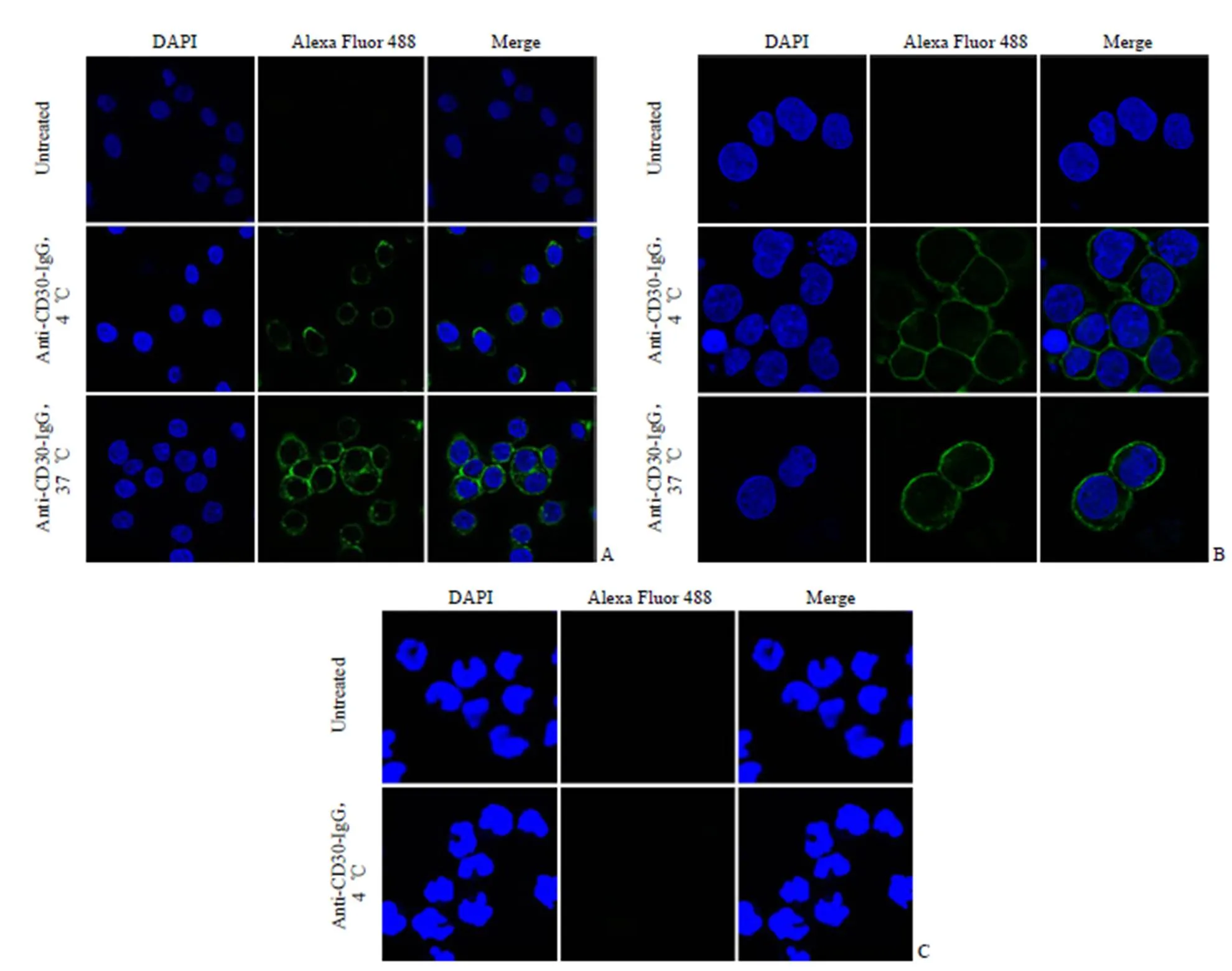
图 6 Anti-CD30-IgG 与 L540 细胞(A)、Karpas299(B)、Raji 细胞(C)的结合和内吞(× 630)(4 ℃ 下 Anti-CD30-IgG 与 CD30 阳性的 L540 细胞、Karpas299 细胞表面结合,37 ℃ 下被内吞进入细胞;与 CD30 阴性的 Raji 细胞无结合;绿色荧光 Alexa Fluor 488 标记 anti-CD30-IgG)
Figure 6 Binding and internalization of anti-CD30-IgG by L540 (A),Karpas299 (B) and Raji cells (C) (× 630) [Cell surface binding of anti-CD30-IgG was shown by incubating L540 and Karpas299 with Alexa Fluor 488-labeled anti-CD30-IgG (green) at 4 ℃ and internalization was allowed by incubating at 37 ℃; No binding of anti-CD30-IgG was detected when incubated with the CD30-negative Raji cells]
2.4.2 Anti-CD30-IgG 与肿瘤细胞的亲和活性 流式细胞术法检测不同浓度的anti-CD30-LDP(0.001 ~ 3 μg/ml)与 CD30 表达量不同的肿瘤细胞的亲和活性。本实验选取霍奇金淋巴瘤 L540 和 L428、间变性大细胞淋巴瘤 Karpas299 和 SU-DHL-1 及人 Burkitt 淋巴瘤细胞系 Raji,其中 L540 和 Karpas299 细胞 CD30 表达量较高,SU-DHL-1 和 L428 细胞 CD30 表达量较低,而 Raji 细胞不表达 CD30[13]。如图 5C 所示,anti-CD30-IgG 与 CD30 阳性细胞具有很好的结合能力,其结合能力的强弱与细胞表面抗原 CD30 的表达量有关。此外,anti-CD30-IgG 与 CD30 阴性细胞 Raji 不结合,表明其与抗原或细胞的识别具有特异性。
2.5 Anti-CD30-IgG 通过内吞进入肿瘤细胞
通过免疫荧光共聚焦实验观察 anti-CD30-IgG 在肿瘤细胞的定位。如图 6 所示,4 ℃共孵育条件下,anti-CD30-IgG 可与 L540 和 Karpas299 细胞表面结合,而与 Raji 细胞不结合,表明 anti-CD30-IgG 可特异性地与抗原 CD30 结合。而在 37 ℃共孵育条件下,L540 和 Karpas299 细胞内可观察到绿色荧光颗粒(Alexa Fluor 488 标记的 anti-CD30-IgG),表明抗体可通过细胞表面 CD30 受体介导的内吞进入细胞。
2.6 Anti-CD30-IgG 在小鼠体内的肿瘤靶向性
利用小动物活体荧光成像技术实时监测 anti-CD30-IgG 分别在 NOD/SCID 鼠 Karpas299 和 L540 移植瘤模型中的分布和富集情况。如图 7 所示,尾静脉注射后 6 h,DyLight 680 标记的 anti-CD30-IgG 在肿瘤部位开始富集。在 L540 小鼠移植瘤模型中,12 ~ 96 h 荧光信号富集程度较强,96 h 左右荧光开始减弱,肿瘤部位的荧光信号可持续 5 d 以上。而 Karpas299 小鼠移植瘤模型中,荧光信号的富集时间相对较短,48 h 后荧光开始减弱,但仍可持续 3 d 以上。以上结果表明,在小鼠移植瘤模型中,anti-CD30-IgG 可以选择性地富集并滞留在肿瘤部位,提示 anti-CD30-IgG 可作为化疗药物的靶向输送载体。
3 讨论
近十几年,肿瘤靶向性单克隆抗体的发展改变了恶性肿瘤治疗的模式。但是,大多数单抗药物单独使用抗肿瘤活性有限,而 ADCs 是将单克隆抗体与高效细胞毒药物通过化学接头连接在一起,由于具有高效、低毒的特点使其在肿瘤治疗领域越来越受到关注[10, 14]。在 ADCs 的研究中,选择合适的靶点和有效的抗体是首要环节。
作为靶点的抗原需是在肿瘤细胞过表达或特异性表达,具有细胞外表位,并且与特异性抗体结合后可被内吞进入胞内从而使得“弹头”药物在细胞内发挥细胞毒作用,这些都是 ADCs 发挥抗肿瘤活性和实现机体耐受性的重要条件[15-16]。CD30 抗原在 HL 和 ALCL 细胞的特异性表达使其成为 ADCs 的理想靶点,靶向 CD30 的 ADC 药物 BV 在临床应用中展现了良好的治疗效果和安全性[8-9]。本研究通过已知的可变区序列,构建并筛选得到重组抗 CD30 的嵌合抗体 anti-CD30-IgG,体外实验证明其与重组人 CD30 抗原和 CD30 阳性肿瘤细胞都具有很好的特异性和亲和性,并且可通过受体CD30 介导的内吞被转运至细胞内。此外,在小鼠移植瘤模型中,anti-CD30-IgG 具有很好的肿瘤靶向性。以上研究结果均表明 anti-CD30-IgG 可作为新型 ADCs 的有效载体。
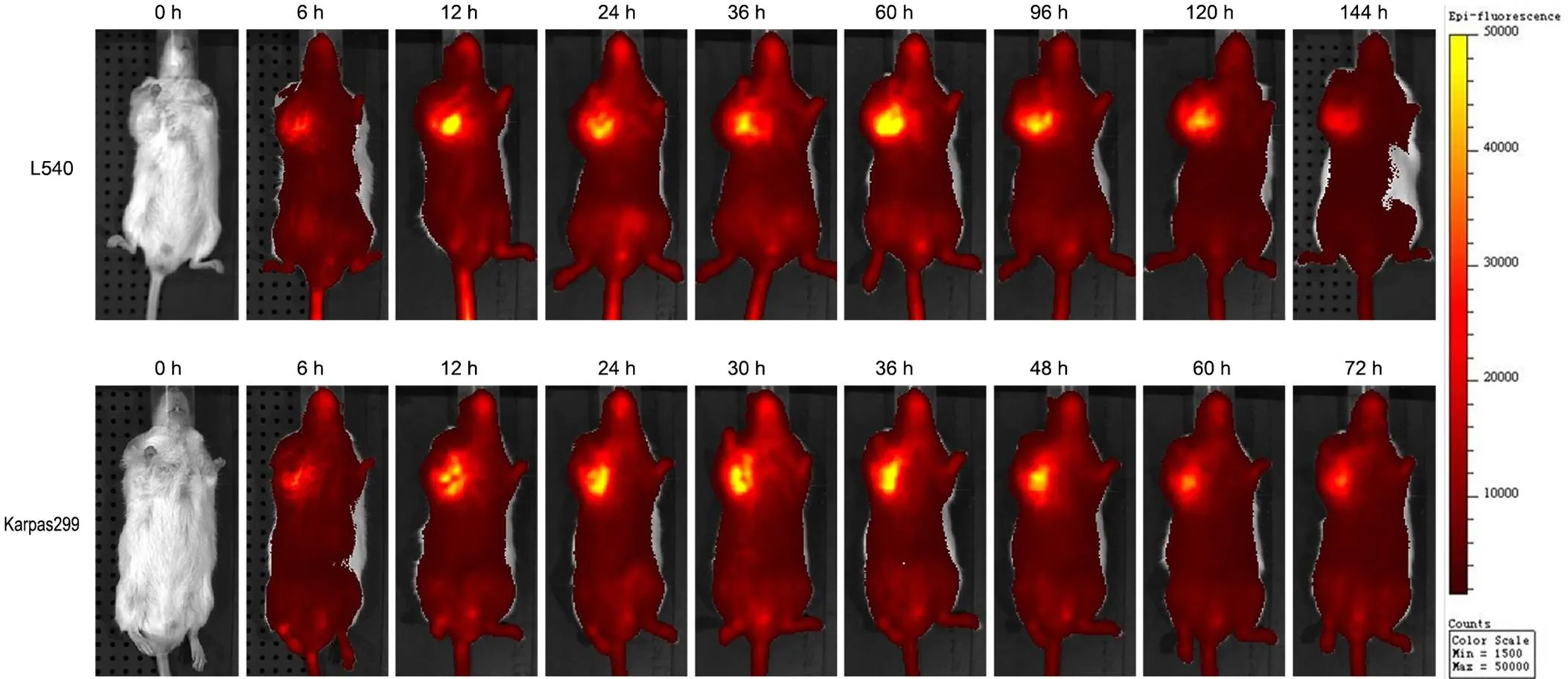
图 7 小动物活体成像分析 DyLight 680 标记的 anti-CD30-IgG 在荷瘤鼠体内的分布
Figure 7optical imaging of DyLight 680-labeled anti-CD30-IgG in L540 and Karpas299 xenografts
当前,研发高效、低毒的肿瘤靶向性药物已成为全球抗肿瘤药物的发展趋势,抗体药物或抗体偶联药物由于其特异性和靶向性备受研究者青睐,而选择具有较高肿瘤亲和性和特异性的单克隆抗体是 ADCs 发挥高效、低毒活性关键因素之一。本研究制备了抗 CD30 单克隆抗体 anti-CD30-IgG,并证实其高效亲和性、特异性、可被内吞进入肿瘤细胞内部和在小鼠体内肿瘤靶向性等特点符合作为 ADCs 药物高效运输载体的条件。在此基础上,我们下一步工作是将 anti-CD30-IgG 与高效“弹头”药物偶联或融合制备新型 ADC,为 HL 和 ALCL 等血液恶性肿瘤的治疗研发有发展前景的候选药物。
[1] Moskowitz AJ, Perales MA, Kewalramani T, et al. Outcomes for patients who fail high dose chemoradiotherapy and autologous stem cell rescue for relapsed and primary refractory Hodgkin lymphoma. Br J Haematol, 2009, 146(2):158-163.
[2] Vu K, Ai W. Update on the treatment of anaplastic large cell lymphoma. Curr Hematol Malig Rep, 2018, 13(2):135-141.
[3] Mcafee SL, Powell SN, Colby C, et al. Dose-escalated total body irradiation and autologous stem cell transplantation for refractory hematologic malignancy. Int J Radiat Oncol Biol Phys, 2002, 53(1): 151-156.
[4] Vaklavas C, Forero-Torres A. Safety and efficacy of brentuximab vedotin in patients with Hodgkin lymphoma or systemic anaplastic large cell lymphoma. Ther Adv Hematol, 2012, 3(4):209-225.
[5] Younes A. CD30-targeted antibody therapy. Curr Opin Oncol, 2011, 23(6):587-593.
[6] Oflazoglu E, Stone I, Gordon K, et al. Macrophages contribute to the antitumor activity of the anti-CD30 antibody SGN-30. Blood, 2007, 110(13):4370-4372.
[7] Chen R, Gopal AK, Smith SE, et al. Five-year survival and durability results of brentuximab vedotin in patients with relapsed or refractory Hodgkin lymphoma. Blood, 2016, 128(12):1562-1566.
[8] Pro B, Advani R, Brice P, et al. Brentuximab vedotin (SGN-35) in patients with relapsed or refractory systemic anaplastic large-cell lymphoma: results of a phase II study. J Clin Oncol, 2012, 30(18): 2190-2196.
[9] Younes A, Gopal AK, Smith SE, et al. Results of a pivotal phase II study of brentuximab vedotin for patients with relapsed or refractory Hodgkin's lymphoma. J Clin Oncol, 2012, 30(18):2183-2189.
[10] Gopal AK, Chen R, Smith SE, et al. Durable remissions in a pivotal phase 2 study of brentuximab vedotin in relapsed or refractory Hodgkin lymphoma. Blood, 2015, 125(8):1236-1243.
[11] Moskowitz CH, Nademanee A, Masszi T, et al. Brentuximab vedotin as consolidation therapy after autologous stem-cell transplantation in patients with Hodgkin's lymphoma at risk of relapse or progression (AETHERA): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet, 2015, 385(9980):1853-1862.
[12] Chen R, Hou J, Newman E, et al. CD30 downregulation, MMAE resistance, and MDR1 upregulation are all associated with resistance to brentuximab vedotin. Mol Cancer Ther, 2015, 14(6):1376-1384.
[13] Wang R, Li L, Zhang S, et al. A novel enediyne-integrated antibody-drug conjugate shows promising antitumor efficacy against CD30(+) lymphomas. Mol Oncol, 2018, 12(3):339-355.
[14] Doroshow DB, Lorusso PM. Trastuzumab emtansine: determining its role in management of HER2+ breast cancer. Future Oncol, 2018, 14(7):589-602.
[15] Teicher BA, Chari RV. Antibody conjugate therapeutics: challenges and potential. Clin Cancer Res, 2011, 17(20):6389-6397.
[16] Thomas A, Teicher BA, Hassan R. Antibody-drug conjugates for cancer therapy. Lancet Oncology, 2016, 17(6):e254-e262.
Preparation and activity study of an anti-CD30 monoclonal antibody
WANG Rong, LI Liang, ZHANG Sheng-hua, ZHEN Yong-su, MIAO Qing-fang
Author Affiliation: Department of Oncology, Institute of Medicinal Biotechnology, Chinese Academy of Medical Science & Peking Union Medical College, Beijing 100050, China
The aim of this study is to prepare an anti-CD30 monoclonal antibody and investigate its activity, by which we provide an evaluation for its use as a drug carrier in antibody-drug conjugates.
The eukaryotic expression vector of pIZDHL-CD30-IgG was constructed by genetic engineering, and transfected into CHO/dhFr-cells to obtain the single cell clones which stably expressed the antibody of anti-CD30-IgG. Anti-CD30-IgG was purified using affinity chromatography and its purity was detected by HPLC. The antigen-binding activity of anti-CD30-IgG was analyzed by ELISA, Biacore and flow cytometry and its internalization in tumor cells was observed by immunofluorescence confocal microscopy. Thetumor-targeting ability of anti-CD30-IgG was monitored by living images.
In this study, we constructed the expression vector of anti-CD30-IgG and selected the CHO single cell clone which successfully expressed high level of anti-CD30-IgG. After purification, we obtained the antibody of anti-CD30-IgG with purity of more than 98%. Anti-CD30-IgG showed specific and high affinity binding to recombinant CD30 with the affinity constant of 4.15 × 108L/mol. Besides, it could bind to CD30+cancer cells and be internalized into target cells through the antigen-mediated endocytosis. Anti-CD30-IgG also exhibited excellent tumor-targeting capability in L540 and Karpas299 xenograft models.
Anti-CD30-IgG shows attractive specificity and affinity to CD30 antigen and it can be internalized into CD30+tumor cells. Anti-CD30-IgG selectively targets tumor tissues in NOD/SCID mice xenograft models. Taken together, anti-CD30-IgG is an appropriate targeted vehicle for the delivery of cytotoxic payloads in antibody-drug conjugates.
Antigens, CD30; Antibodies, monoclonal; Hodgkin disease; Large-cell, anaplastic
MIAO Qing-fang, Email: miaoqf@sina.com
10.3969/j.issn.1673-713X.2018.05.002
“重大新药创制”国家科技重大专项(2014ZX09201042-003);中国医学科学院医学与健康科技创新工程(2016-I2M-3-013)
苗庆芳,Email:miaoqf@sina.com
2018-05-09

