正交设计优化低温应激诱导IEC-6细胞损伤条件的实验研究
熊 鸣,张达矜,乔媛媛,史成和
体温过低症是一种严重的临床综合征,中重度体温过低症的死亡率极高,病死率甚至高于心肌梗死和感染性休克,但其救治困难的机制尚不十分清楚[1]。低温是体温过低症最根本的致伤因素。多项动物和细胞实验证实低温可直接诱导组织损伤和细胞死亡。已有研究提示,肠上皮细胞功能、结构受损在低温脏器损害的发生发展中可能具有极其重要的作用[2]。本研究拟在前期工作基础上,通过正交设计优化低温应激诱导大鼠小肠隐窝上皮(intestinal epithelial crypt,IEC-6)细胞损伤条件,建立较为稳定的低温应激细胞损伤实验模型,为后续的低温应激损伤与继发性损伤机制以及救治研究奠定细胞学实验基础。
1 材料与方法
1.1 材料 大鼠IEC-6细胞株由中国医学科学院基础所细胞中心提供。高糖DMEM培养基和胎牛血清为美国Gibco公司产品;细胞增殖/毒性检测试剂(cell counting kit-8,CCK-8)为日本同仁化学研究所产品;细胞凋亡检测试剂AnnexinⅤ-PE/7-AAD Kit和线粒体膜电位检测试剂JC-1 Kit为美国BD公司产品。
1.2 方法
1.2.1 细胞培养 细胞接种于含10%胎牛血清、1×105U/L青霉素和100 mg/L链霉素的高糖DMEM培养基,置于37℃、5%CO2饱和湿度培养箱中培养。每2~3天传代1次。
1.2.2 细胞低温处理方法 将生长良好的IEC-6细胞置于密闭细胞培养小室(billups-rothenberg产品,MIC-101型),设定通气条件为95%空气+5%CO2预混合气体,以20 L/min流量持续通气8 min,置于设定温度条件有机箱中。
1.2.3 正交实验设计 根据预实验结果,在50%<细胞存活率<90%范围内采用正交实验设计进一步优化处理条件。以温度、处理时间和接种密度为正交优化的3个因素,每个因素设定3个水平,分别为处理温度(4℃,10℃,22℃),低温处理时间(2 h,4 h,6 h),接种密度(1×105/mL,2.5×105/mL,5×105/mL),根据三因素三水平设计正交实验表,得到9个实验组,每组设5个复孔。CCK-8法分析细胞毒性,在50%<细胞存活率<90%范围内获得最优组合条件。随后,实验组IEC-6细胞以最优组合条件进行处理,同时设置正常对照组,镜下观察细胞形态,流式细胞术检测细胞凋亡和线粒体膜电位。
1.2.4 CCK-8法分析细胞毒性 取对数生长期IEC-6细胞,调整细胞密度,接种于96孔板中(每孔100 μL),于37 ℃、5%CO2培养箱中孵育12 h后更换培养基。根据实验分组,实验组置于细胞培养小室(通气条件为95%空气+5%CO2),分别于设定低温(4℃,10℃,22℃)环境条件下培养设定处理时间(2 h,4 h,6 h)。正常对照组置于37℃、5%CO2培养箱正常培养,同时设置空白对照。处理结束后加入CCK-8试剂,37℃继续培养2 h,酶标仪测定450 nm吸光度(A)。按公式计算细胞存活率:细胞存活率(%)=[(A实验孔-A空白孔)/(A对照孔-A空白孔)]×100%。(1-细胞存活率)即代表细胞毒性。1.2.5 流式细胞术检测细胞凋亡和线粒体膜电位取对数生长期IEC-6细胞,按最优组合条件调整细胞密度,接种于10 cm2培养皿中(每皿3 mL),于37℃、5%CO2培养箱中孵育12 h后更换培养基。根据实验分组,实验组置于细胞培养小室(通气条件为95%空气+5%CO2),于设定温度环境条件下培养设定处理时间,正常对照组置于37℃、5%CO2培养箱正常培养。
收集各组细胞和培养上清,调整密度至5×105/mL,分别进行如下处理:①按照AnnexinⅤ-PE/7-AAD Kit说明书检测细胞凋亡。流程简述如下:取上述细胞悬液1 mL,400 g离心5 min,去上清液,4℃预冷的磷酸缓冲盐溶液洗涤2次,加入0.5 mL结合缓冲液重悬,加入5 μL AnnexinⅤ-PE抗体,轻轻混匀,室温避光孵育15 min后,加入5 μL7-AAD,轻轻混匀后上机检测。②按照JC-1 Kit说明书检测线粒体膜电位。流程简述如下:取上述细胞悬液1 mL,400 g离心5 min,去上清液,加入0.5 mL新鲜配置的JC-1工作液,轻轻混匀,37℃、5%CO2培养箱中孵育15 min,加入1×分析缓冲液洗涤2次,加入0.5 mL 1×分析缓冲液重悬,轻轻混匀后上机检测。当细胞线粒体膜电位正常时,JC-1主要以聚合体形式存在,FL-2通道上显示为高强度红色荧光信号;当膜电位发生去极化时,JC-1则主要以单体形式存在,FL-2通道上红色荧光信号减弱,细胞群发生偏移。通过CellQuest软件分析强弱红色荧光信号细胞比例,相对定量线粒体膜电位水平。实验重复3次,结果取平均值。
1.3 统计学处理 应用SPSS 16.0统计学软件和正交设计助手ⅡV3.1专业版软件,设计三因素三水平正交表,通过极差法确定主效应因素。应用CellQuest软件分析流式细胞结果,数据采用均数±标准差(±s)表示,组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 正交优化实验结果 通过正交实验设计优化低温应激诱导IEC-6细胞损伤的条件,按三因素三水平设计正交实验表进行实验(表1)。根据R值大小可知,在50%<细胞存活率<90%范围内,3个因素对细胞毒性的影响程度为:处理温度>低温处理时间>接种密度。通过K值分析上述范围内3个因素各水平对细胞毒性的影响程度为:处理温度:4℃>10℃>22 ℃,接种密度:5×105/mL>1×105/mL>2.5×105/mL,低温处理时间:4 h>6 h>2 h。 因此在50%<细胞存活率<90%范围内,低温应激诱导IEC-6细胞损伤的最优组合条件为:处理温度4℃,接种密度5×105/mL,低温处理时间4 h。
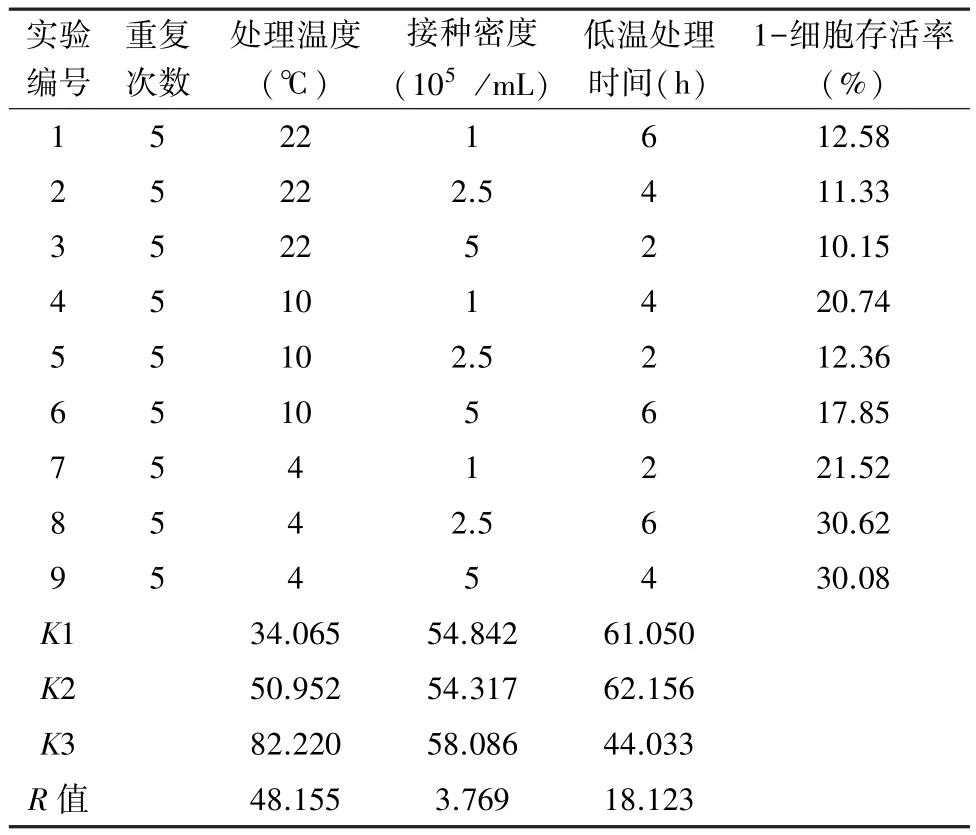
表1 三因素三水平设计正交实验表正交优化实验结果
2.2 最优组合条件下IEC-6细胞形态 对数生长期IEC-6细胞以5×105/mL密度接种于10 cm2培养皿中(每皿3 mL),正常培养条件下孵育12 h后更换培养基,实验组细胞置于4℃处理4 h,镜下观察细胞形态变化。结果如图1所示:正常IEC-6细胞为不规则多角形,边界清楚,细胞核较大,呈卵圆形,细胞间相互连接,呈铺路石镶嵌排列,互不重叠。而实验组细胞胞体收缩变小,边缘模糊呈扁平状,胞浆内可见黑色颗粒状物,折光性降低,细胞核大小不一,形态不规则。

图1 镜下细胞形态
2.3 最优组合条件下IEC-6细胞凋亡和线粒体膜电位 实验组细胞置于4℃处理4 h后,细胞凋亡情况如图2A所示:与对照组相比,实验组细胞凋亡明显加重。前者以早期凋亡为主,细胞凋亡率为(4.41±1.36)%,后者则以中晚期凋亡和坏死为主,细胞凋亡率为(23.70±2.94)%,2者比较差异有统计学意义(F=14.56,P<0.01)。
线粒体膜电位变化如图2B所示:与对照组相比,实验组细胞群发生明显偏移,表现为FL-2通道红色荧光信号减弱,低强度红色荧光细胞(R2)比例显著增高,(31.12±3.66)%vs(5.24±0.57)%(F=23.80,P<0.01)。说明线粒体膜电位去极化增强,与之伴随的细胞凋亡亦加重,结果与前者一致。

图2 细胞凋亡和线粒体膜电位
3 讨论
体温过低症是指各种原因引起的中心体温低于35℃时的状态[3]。研究表明,体温过低症能引起机体多个生理系统功能失调,包括微循环改变和组织氧供减少,最终导致以严重休克、水电解质紊乱和凝血障碍为突出表现的多器官功能障碍综合征(multiorgan dysfunction syndrome,MODS)[4-5]。随着社会的发展,潜水、航海、高寒地区作业及登山等活动相应增加,体温过低症发生率呈逐年上升趋势。然而,目前对于体温过低症病理过程中,导致组织和细胞损伤的机制尚不清楚,因此缺乏特殊有效的临床救治措施,这也是中重度体温过低症患者高死亡率的重要原因[6-7]。
低温是体温过低症最根本的致伤因素。多项动物和细胞实验证实低温可直接诱导组织损伤和细胞死亡。根据低温程度不同,细胞可激活凋亡信号或直接坏死。低温引起的冻结性损伤主要通过生物膜结构和形态异常、膜的生理功能紊乱等导致细胞膜破裂,细胞崩解坏死;而在非冻结性损伤时,主要通过激活细胞凋亡信号,诱导细胞凋亡[8-9]。在各种原因引起MODS的发生中,肠道既是受损的“靶”器官,又是损伤的“激发”器官[10-11]。近年来研究发现肠上皮细胞功能、结构受损在低温脏器损害的发生发展中具有极其重要的作用,是导致重度体温过低症MODS的重要原因[12-13]。然而,目前对于肠上皮细胞凋亡在体温过低症病理生理过程中的的具体作用,针对低温尤其低温引起的继发性损伤的机制尚不清楚[14-15]。本研究以大鼠IEC-6细胞为研究对象,采用正交实验设计优化低温应激诱导IEC-6细胞损伤的条件,建立较为稳定的肠上皮细胞低温应激损伤模型,为后续的机制研究奠定基础。
正交实验设计是利用正交表科学的安排与分析多因素实验的方法,是科研中当需要考虑多因素、多水平对实验结果的影响时优先选用的实验分析方法;具有高效、快速、灵活、均匀分散及整齐可比的特点;通过极差R值来反应各优化因素对结果影响的程度,极差R值越大,影响程度越大。为后续进一步干预处理,本研究将细胞损伤程度设定在50%<细胞存活率<90%范围内,通过正交实验设计获得该范围内低温应激诱导IEC-6细胞损伤的最优组合条件为:处理温度4℃,接种密度5×105/mL,低温处理时间4 h。进一步评价最优组合条件下IEC-6细胞损伤情况:光学显微镜显示细胞形态,细胞凋亡率和线粒体膜电位检测相结合显示细胞凋亡。结果表明:与对照组相比,最优组合条件下实验组细胞失去正常形态,同时线粒体膜电位去极化增强,细胞凋亡显著加重。符合低温应激诱导细胞损伤特点,为后续低温致伤机制研究奠定实验基础。

