下调Bcl- 2家族蛋白促进MTB感染的小鼠巨噬细胞系凋亡
卢 洋,王新敏,王小芳,杨 菩,王英姿,郑志红,章 乐*
(石河子大学 1.医学院;2.病理生理学教研室;3.第一附属医院 泌尿外科,4.新疆地方与民族高发病教育部 重点实验室,新疆 石河子 832002)
结核病是由结核分枝杆菌(Mycobacteriumtuberculosis,MTB)感染引起的严重危害人类健康的传染性疾病[1],深入了解结核病的发病机制是防治结核病非常重要的环节。MTB是典型的胞内致病菌,巨噬细胞是MTB入侵机体后机体免疫系统的第一道防线[2]。巨噬细胞被MTB感染后,通常会表现出两种结局:坏死和凋亡[3]。坏死可以导致感染的播散,而凋亡则可杀灭寄居于巨噬细胞内的MTB。本课题组前期体内研究结果表明[4- 7],当不同毒力的MTB感染小鼠腹腔巨噬细胞后会引起Bcl- 2家族成员髓细胞白血病- 1(myeloid cell leukaemia- 1,Mcl- 1)表达的升高,其在调控宿主巨噬细胞的凋亡中发挥重要作用,MTB感染后Mcl- 1表达的上调可能是其逃避宿主巨噬细胞免疫杀伤的机制。由于Bcl- 2家族蛋白是细胞凋亡信号传导途径中关键的凋亡调节因子[8],线粒体是其调控内源性凋亡途径的靶点,因此,本研究拟在体外水平深入探讨Bcl- 2家族蛋白在不同毒力的MTB感染后对宿主巨噬细胞凋亡的调控作用。
1 材料与方法
1.1 材料
1.1.1 菌株与细胞:结核分枝杆菌国际标准强毒株H37Rv、结核分枝杆菌国际标准无毒株H37Ra和卡介苗BCG(中国药物生物制品检定所);新疆地区流行的优势强毒结核分枝杆菌临床分离株(XJ-MTB)(由本实验室前期鉴定并保存)。小鼠Raw264.7巨噬细胞株(中国科学院典型培养物保藏委员会细胞库)。
1.1.2 主要试剂:Mcl- 1 shRNA质粒由本课题组构建[9],质粒的菌液(上海吉凯基因合成)。OPTI-MEM(Gibco公司);LipofectamineTM2000(Invitrogen公司);流式凋亡试剂盒(Annexin V-APC/7-AAD)(联科生物技术有限公司);细胞总RNA提取试剂盒(天根生物技术公司);Super RT cDNA kit、ECL化学发光试剂盒(Thermo Fisher公司);QuantiFast SYBR Green PCR Kit(Qiagen公司)。兔多克隆抗体Mcl- 1(Santa Cruz公司);兔单克隆抗体Bax(Cell Signaling Technology公司);β-actin单克隆抗体、辣根过氧化物酶标记的山羊抗鼠IgG抗体及山羊抗兔IgG(北京中衫金桥生物技术有限公司)。
1.2 方法
1.2.1 细胞的培养与感染模型的建立:用含10%胎牛血清的DMEM培养基于37 ℃、含5% CO2的培养箱中培养小鼠Raw264.7巨噬细胞系。在生物安全柜内,用灭菌接种环挑取罗氏固体培养基上培养2~3周、状态良好的结核杆菌菌落,置于灭菌磨菌器中,加少量0.05% Tween- 80的0.9%氯化钠溶液充分研磨,使其成均匀浑浊的菌悬液。用麦氏比浊法调细菌浓度约1×107CFU/mL。感染时按细菌∶细胞=10∶1的比例感染培养好的巨噬细胞。在菌感染后4 h用PBS清洗巨噬细胞3次并加入新鲜的完全培养基,此时计做感染的0 h。
1.2.2 Mcl- 1 shRNA质粒的转染:按本课题组前期实验方法[10],取对数增殖期的细胞待汇合到85%开始转染。转染时取10 μL LipofectamineTM2000稀释于250 μL OPTI-MEM培养基中,4 μg质粒DNA稀释于250 μL OPTI-MEM培养基,室温放置5 min后将两者混合,混合后室温孵育20 min,将500 μL Mcl- 1 shRNA-LipofectamineTM2000转染混合液缓慢加入培养板中培养。4~6 h后更换培养基。
1.2.3 流式细胞术检测巨噬细胞的凋亡率:收集各组巨噬细胞后根据试剂盒操作说明书操作。
1.2.4 Western blot检测凋亡相关蛋白Mcl- 1、Bax的表达:感染后12 h收集各组巨噬细胞,细胞裂解液裂解细胞提取总蛋白。SDS-PAGE电泳分离蛋白质,半干电转将蛋白转移到PVDF膜上(23 V,40 min),室温封闭2 h,一抗兔抗鼠Mcl- 1、Bax以1∶1 000的比例于4 ℃摇床孵育过夜,用辣根过氧化物酶标记的相应二抗室温孵育2 h,ECL显色压片曝光,β-actin为内参。凝胶成像仪分析系统对 Western blot 检测条带进行吸光度值扫描。
1.2.5 实时荧光定量PCR检测Bcl- 2家族与凋亡相关基因表达水平:细胞总RNA的提取按照试剂盒说明书操作,分光光度法测定总RNA含量及浓度。按照反转录试剂盒操作说明将各组细胞总RNA反转录成cDNA,参照QuantiFast SYBR Green PCR Kit试剂盒说明书进行实时荧光定量PCR,检测各组中Mcl- 1、Bcl- 2、caspase- 3、细胞色素C的mRNA表达情况。PCR引物(表1)由上海生物工程公司合成。扩增条件为:95 ℃ 2 min;95 ℃ 10 s,60 ℃ 30 s,共40个循环。应用2-ΔΔCt法对结果进行分析。
1.3 统计学分析
2 结果
2.1 不同毒力MTB对小鼠Raw264.7巨噬细胞凋亡的影响
不同毒力MTB感染组Raw264.7细胞的凋亡率均显著增高,且毒力株感染组凋亡率低于无毒株感染组;靶向下调Mcl- 1的表达后,毒力株感染组巨噬细胞凋亡率分别显著上调了37%(XJ-MTB)和34%(H37Rv)(图1,表2)。
2.2 不同毒力MTB感染小鼠Raw264.7巨噬细胞后Mcl- 1与Bax蛋白的表达
毒力株XJ-MTB感染组Mcl- 1的表达比对照组升高了0.29倍(P<0.05);用Mcl- 1 shRNA靶向下调Mcl- 1的表达后,H37Ra、H37Rv与XJ-MTB感染组Mcl- 1蛋白表达分别下降0.54倍、0.5倍和0.68倍(P<0.05)。BCG感染组Bax表达水平显著低于对照组(P<0.05),H37Ra与H37Rv感染组Bax水平均显著高于对照组(P<0.05);用Mcl- 1 shRNA下调Mcl- 1的表达后,各感染组Bax表达均显著升高(P<0.05),其中XJ-MTB感染组升高最为明显(图2)。
2.3 下调Mcl- 1对线粒体凋亡通路相关基因的影响
H37Rv与XJ-MTB感染组Mcl- 1 mRNA水平显著上调(P<0.05);靶向下调Mcl- 1的表达后H37Rv与XJ-MTB感染组Mcl- 1基因水平分别下降0.53倍与0.6倍(P<0.05)(图3A)。XJ-MTB与H37Rv感染Raw264.7细胞后,促凋亡基因细胞色素C、caspase- 3以及抑凋亡基因Bcl- 2的表达均显著高于对照组(P<0.05);下调宿主巨噬细胞Mcl- 1后,与感染组相比,BCG、H37Ra和H37Rv感染组中Bax水平升高显著;H37Rv与XJ-MTB感染组Bcl- 2基因水平被显著下调;XJ-MTB感染组细胞色素C表达显著升高;BCG与H37Rv感染组caspase- 3表达显著升高(P<0.05)(图3B)。
3 讨论
细胞凋亡是机体重要的自稳调节机制, MTB的命运受到宿主巨噬细胞凋亡的调控,且宿主巨噬细胞的凋亡水平与MTB菌株毒力密切相关。强毒株H37Rv和无毒株H37Ra感染人肺泡巨噬细胞,H37Ra感染组的凋亡率显著高于H37Rv感染组[11]。本实验结果同样发现强毒株感染后Raw264.7细胞的凋亡率显著低于无毒株感染组。靶向下调Mcl- 1的表达后强毒株感染组Raw264.7细胞的凋亡率被显著提高,而且促凋亡效果优于BCG与H37Ra感染组,提示Mcl- 1在强毒力的MTB逃逸宿主免疫防御反应中发挥重要作用,验证了前期体内实验关于MTB感染后宿主细胞内Mcl- 1表达的升高可能是MTB逃逸机体免疫防御反应的机制[7]的猜想。

表1 引物序列Table 1 Sequences of the primers
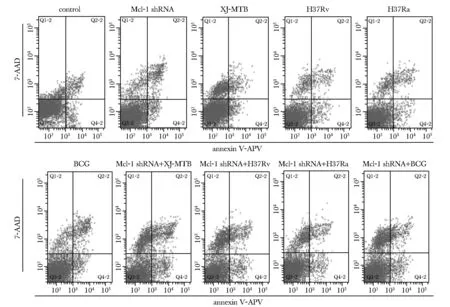
图1 流式细胞术检测小鼠Raw264.7巨噬细胞凋亡率

groupapoptosis rate control4.90±0.78Mcl-1 shRNA8.83±0.49*virulent strain8.40±0.61*#H37Rv9.07±0.81*#H37Ra11.83±0.72*BCG12.20±0.66*virulent strain+ Mcl-1 shRNA12.07±1.20H37Rv+ Mcl-1 shRNA11.33±2.23H37Ra+ Mcl-1 shRNA12.87±0.23BCG+ Mcl-1 shRNA13.30±0.56
*P<0.05 compared with control group;#P<0.05 compared with Mcl- 1 shRNA treated group.
Mcl- 1的主要作用是调控细胞凋亡、分化和细胞周期[12],并与其他Bcl- 2家族成员共同参与维持线粒体内膜的稳定[13]。线粒体通路是细胞凋亡中最经典的通路, 线粒体是Bcl- 2家族蛋白调控内在凋亡途径的靶点[14]。为了可以更详尽地探讨Mcl- 1对感染不同毒力MTB的小鼠Raw264.7巨噬细胞凋亡的影响,本研究在基因与蛋白水平检测了Bcl- 2家族成员的表达情况,结果显示H37Ra感染后线粒体通路的主要介导者Bax表达高于毒力株感染组;靶向下调Mcl- 1的表达后各感染组Bax水平均显著增高;同时,下调Mcl- 1的表达可以显著下调强毒株感染组Bcl- 2的表达,并使caspase- 3和细胞色素C表达升高。由此可以判断MTB感染后,Bcl- 2家族成员的表达受到菌株毒力的影响,强毒株感染可以显著诱导Bcl- 2家族成员的表达;并推测下调Mcl- 1的表达激活了宿主细胞的线粒体凋亡通路,此过程受到Bcl- 2家族蛋白的调控。

*P<0.05 compared with control group;#P<0.05 compared with untreated group图2 Western blot检测Mcl- 1与Bax蛋白的表达Fig 2 The protein expression of Mcl- 1 and Bax determined by Western n=3)

A.Mcl-1 mRNA expression; B.Mitochondrial apoptosis pathway associated genes expression;*P<0.05 compared with untreated group;#P<0.05 compared with Mcl- 1 shRNA treated group

综上,本研究不仅验证了前期体内实验对于Mcl- 1在调控宿主细胞凋亡作用的推断,并推测靶向下调MTB感染的宿主巨噬细胞中Mcl- 1的表达后,Bcl- 2与Bax等抑/促凋亡蛋白比例失衡导致线粒体内膜通透性改变,Bax从胞质移位至线粒体,引发线粒体内细胞色素C释放进入胞质,进一步激活线粒体通路下游的caspase- 3引起凋亡,从而杀灭寄居于巨噬细胞中的MTB,避免感染的播散。本研究为今后结核病的防治提供了理论基础。由于结核病发病机制的复杂性,是否有其他通路参与Mcl- 1对宿主细胞凋亡的调控仍需进一步探讨。

