α-突触核蛋白在小胶质细胞炎性反应和吞噬功能中的作用研究
宫晓丽 刘梦茹 王 乐 刘 玚 张 婷 孙 英 王晓民2,*
(1.首都医科大学基础医学院免疫学系,北京 100069;2. 首都医科大学基础医学院生理学与病理生理学系,北京 100069;3. 首都医科大学教育部神经变性病重点实验室,北京 100069;4. 首都医科大学基础医学院神经生物学系,北京 100069)
小胶质细胞是中枢神经系统中唯一的固有免疫细胞,当受到感染、毒物、致病蛋白等因素刺激后会发生炎性反应激活释放大量促炎因子。除了炎性作用之外,小胶质还有一种重要的功能:吞噬作用。小胶质细胞可以通过吞噬作用清理细胞碎片、清除异常蛋白。小胶质细胞的吞噬功能近年来被认定为是引起细胞死亡的一种方式[1],在中枢神经系统发育、突触修剪和突触重塑上扮演着至关重要的作用[2-3],并且研究[4-7]提示,小胶质细胞吞噬功能的异常与帕金森病、精神分裂症、阿尔兹海默病、孤独症、疼痛等许多神经系统性疾病存在着密切的关系。
α-突触核蛋白(α-synuclein,α-syn)是一种由140个氨基酸组成的可溶性蛋白质,主要表达在中枢神经系统突触前膜,该蛋白在脂质体转运[8]、神经递质释放、突触可塑性、多巴胺的合成与转运等方面都发挥着重要的功能[9]。α-syn被认定为路易小体和胶质细胞包涵体的主要组成成分,可溶性α-syn单体会发生异常积聚形成寡聚体,进而形成毒性的纤维体。并且α-syn的毒性作用不仅只作用于神经元,还可以作用于邻近的小胶质细胞等。
在中枢神经系统中,α-syn单体可激活小胶质细胞,增加细胞吞噬能力和炎性反应因子的释放,该蛋白的含量异常引起的小胶质细胞的病理激活可能是相关疾病发病的原因之一。目前已有离体研究[10]显示α-syn对于小胶质细胞炎性激活的作用,在小胶质细胞系过表达α-syn能够增加肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),白细胞介素-6(interleukin-6,IL-6) 以及一氧化氮(nitric oxide,NO)的释放。但α-syn单体对小胶质细胞吞噬功能的影响并没有得到足够的重视。本研究应用原代培养的小鼠小胶质细胞,观察α-syn单体对小胶质细胞吞噬功能以及溶酶体大小的影响,并进一步对比α-syn单体对小胶质细胞炎性反应因子表达的影响,试图揭示α-syn激活小胶质细胞的主要作用,希望揭示中枢神经系统中α-syn作用于小胶质细胞的主要途径和作用形式。
1 材料与方法
1.1 实验动物
C57BL/6J野生型出生24 h内乳鼠繁殖于首都医科大学动物部,由1只雄性和2只雌性成年小鼠合笼同居交配繁育得到,实验动物许可证号:SYXK(京)2018-0002。取P0乳鼠全脑(除小脑)的原代混合胶质细胞培养,或振摇获得原代小胶质细胞进行实验。本实验符合中华人民共和国动物保护法,并通过首都医科大学动物伦理委员会的批准。实验中按照替代、减少和优化的三项原则,尽量减少动物使用数量和降低动物的痛苦。
1.2 主要试剂
单体α-syn重组蛋白,购自美国rPeptide公司;细菌脂多糖 (lipopolysaccharides,LPS)购自美国Sigma公司;DMEM-F12培养基、胎牛血清(fetal bovine serum,FBS)购自美国Hyclone公司;分化抗原68(clusters of differentiation 68,CD68)抗体购自英国AbD Serotec公司;钙离子结合适配分子1(ionized calcium binding adapter molecule 1,Iba1)抗体购自日本Wako公司;实时定量PCR试剂盒购自美国New England Biolabs公司。
1.3 主要仪器
CO2恒温培养箱购自美国Thermo 公司;生物安全柜购自美国Thermo公司;共聚焦显微镜TCS SP8购自德国 Leica 公司;NanoDrop 2000微量分光光度计购自美国Thermo公司;QuantStudio 5 实时定量PCR仪购自美国ABI公司;Vortex-T 旋涡混合器购自美国Scientific industries公司;SpectraMax Paradigm多功能酶标仪(I3)购自美国Molecular Devices公司。
1.4 原代细胞的提取与培养
剥离出新生24 h内的乳鼠的全脑(除小脑),在体式显微镜下剥除脑膜和血管后,接种于6孔细胞培养板,得到混合培养的胶质细胞体系,培养7 d后可用于实验;将细胞悬液接种于多聚赖氨酸预包被的75 cm2培养瓶中,放置于 37 ℃、5%(体积分数)CO2的孵箱中培养,每2天进行半量换液,在培养第14天将细胞培养瓶固定于37 ℃ 恒温摇床,180 r/min恒温震荡2 h,获得原代小胶质细胞。
1.5 细胞模型制备及分组
取得的原代小胶质细胞按1×104的数量接种于细胞玻片上,按处理不同分为:对照组(control)、0.1、1、10 μmol/L α-syn和0.1 μg/mL LPS处理组,加入药物后作用24 h,并在培养基中加入带有红色和绿色的荧光示踪剂的超纯聚苯乙烯微球体用于荧光微球吞噬实验;分为对照组(control)、1 μmol/L α-syn和0.1 μg/mL LPS处理组,加入药物后作用24 h,用于CD68蛋白的表达检测实验。将混合培养的胶质细胞体系按照2 mL/孔,种于6孔培养板,分为对照组(control)、1 μmol/L α-syn和0.1 μg/mL LPS处理组,加入药物后作用24 h,提取细胞总RNA和细胞上清用于小胶质细胞炎性激活的检测。
1.6 免疫荧光和荧光微球吞噬实验
细胞爬片固定、打孔和封闭处理后加入一抗anti-Iba1(1∶500)和anti-CD68(1∶500),分别加入Alexa 594 羊抗兔IgG抗体和Alexa 488羊抗鼠IgG抗体二抗避光室温孵育1 h,Hoechst 33258染料室温孵育5 min染细胞核;荧光封片剂封片,共聚焦显微镜下观察。荧光微球吞噬实验是在加入处理药物孵育22 h后,每孔加入1 μm大小的荧光微球继续培养2 h。固定后Hoechst 33258染料室温孵育5 min染细胞核,荧光封片剂封片,共聚焦显微镜下明场微分干涉反差(differential interference contrast,DIC)确定单个细胞形态和轮廓,计数单个细胞内荧光微球的数量。
1.7 实时定量(reverse transcription-quantitative real-time polymerase chain reaction, RT-qPCR)检测TNF-α和IL-1β的转录
RNA提取:6孔培养板中细胞用RNA快速提取试剂(Trizol),室温裂解后将裂解液移入1.5 mL 无RNA酶的离心管中,加入三氯甲烷抽提出细胞总RNA,用异丙醇将RNA进行沉淀;漂洗后室温进行干燥后,用20 μL DEPC水在56 ℃ 溶解RNA,-80 ℃ 保存。按照试剂盒说明书步骤进行RT-qPCR反应,总体系为20 μL,置于QuantStudio 5 实时定量PCR仪中按反应条件扩增。
1.8 酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)法检测TNF-α蛋白
收集加药处理后的细胞上清液进行ELISA测定;先在预包被的孔板中加入 50 μL的稀释液,再分别加入50 μL的标准品或样本,室温反应2 h;用洗涤液洗板5次,拍干;在反应孔中加入100 μL鼠TNF-α/IL-1β 结合试剂,室温孵育2 h;用洗涤液洗板5次;反应孔中加入100 μL 工作液,室温避光反应30 min;反应孔中加入100 μL 终止液,测量450 nm的各孔吸光度值。
1.9 统计学方法
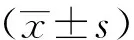
2 结果
2.1 α-syn激活小胶质细胞吞噬功能
为了检测α-syn对细胞的吞噬能力的影响,对各处理组细胞内的磁珠进行示踪定位和计数。结果显示,不同浓度α-syn均能增加小胶质细胞对1 μm荧光微球的吞噬数量,并且呈剂量依赖性。与对照组(6.900±0.690)相比,0.1 μmol/L α-syn处理组(13.250±1.115)增加了0.92倍(P=0.041 6); 1 μmol/L α-syn组(18.000±1.459)增加了1.6倍(P=0.000 2),10 μmol/L α-syn组(21.360±1.889)增加了2.1倍(P<0.000 1);阳性对照(41.000±4.546)LPS组增加了4.94倍(P<0.000 1),差异有统计学意义。α-syn能够刺激小胶质细胞吞噬功能增加且与LPS效果相近。详见图1。
2.2 α-syn增加CD68蛋白的表达
通过CD68染色标记小胶质细胞溶酶体,在α-syn或LPS刺激后,CD68表达强度分别显著增加了 (3.198 0±0.408 4)倍和 (2.930 0±0.673 1)倍,差异有统计学意义(P分别为0.025 0和0.041 8),代表吞噬功能的增强,详见图2。

图1 α-syn可以诱导小胶质细胞吞噬增加Fig.1 Phagocytosis of microglia increased after α-syn treatment
A: Representative image of a microglia that phagocytosed microspheres, blue indicates Hoechst staining and outer layers of microglia are outlined via the merged image with DIC;scalebar: 10 μm;B: The number of microspheres taken up per cell was counted, with 6-10 cells per groups. Microglia were treated with different concentrations of α-syn and LPS, and the number of microspheres that ingested in cells was counted. Data were analyzed by one-way ANOVA test.*P<0.05,***P<0.001vscontrol;α-syn: α-synuclein;LPS: lipopolysaccharides;DIC:differential interference contrast.
2.3 α-syn对于小胶质细胞炎性的激活
LPS刺激24 h后TNF-α蛋白的释放增加到(612.5±228.3) 倍,差异有统计学意义(P=0.005 8),而各浓度α-syn处理组虽然随剂量有增加趋势,但增加量远低于LPS组,10 μmol/L α-syn组增加了(10.15±3.882)倍;随后选取1 μmol/L α-syn和LPS刺激原代培养的混合胶质细胞24 h后,提取细胞总RNA用于检测炎性反应因子的转录水平。RT-qPCR结果显示,α-syn可以使TNF-α转录水平增加了(1.917±0.162 5) 倍(P=0.005 9),IL-1β转录水平增加(2.937±0.568 1)倍(P=0.034 4),然而LPS可以使TNF-α和IL-1β增加(33.80±5.883)倍(P=0.005 1)和(308.3±103.9)倍(P=0.041 7),差异均有统计学意义,详见图3。
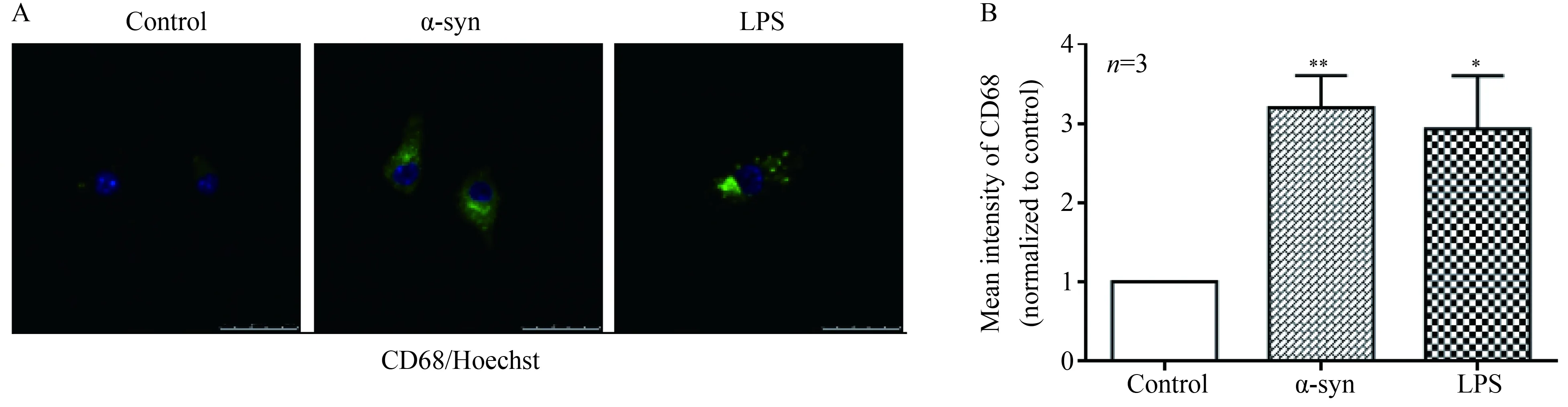
图2 α-syn可以增加CD68蛋白的表达Fig.2 Expression of CD68 was increased by α-syn
A: Immunofluorescence of CD68 protein (green) in primary microglia and blue indicates Hoechst staining;Scale bar:25 μm;B: Quantification of the mean fluorescence intensity of CD68 in microglia. 1 μmol/L α-syn or 0.1 μg/mL LPS was added in primary cultured microglia for 24 h. Data were analyzed by one-way ANOVA test.*P<0.05,**P<0.01vscontrol;α-syn: α-synuclein;LPS: lipopolysaccharides;CD68: clusters of differentiation 68.

图3 α-syn可以诱导小胶质细胞产生炎性激活Fig.3 Expression of pro-inflammatory factors increased by α-syn
Primary microglia-astrocyte mixed culture prepared from the P0 mice and treated with or without α-syn or LPS. The release of TNF-α (A) in mixed microglia supernatant were detected by ELISA. mRNA level of TNF-α(B) and IL-1β (C) were detected by RT-qPCR. Data were analyzed by one-way ANOVA test.*P<0.05,**P<0.01vscontrol;α-syn: α-synuclein;LPS: lipopolysaccharides;TNF-α: tumor necrosis factor-α;IL-1β: interleukin-1 beta;GAPDH:glyceraldehyde-3-phosphate dehydrogenase;ELISA:enzyme-linked immunosorbent assay;RT-qPCR:reverse transcription-quantitative real-time polymerase chain reaction.
3 讨论
小胶质细胞激活后会具有两种最主要的功能:吞噬和炎性反应,也是很多神经系统退变性疾病的两种重要危险因素。小胶质细胞的炎性反应激活存在于多种中枢神经系统疾病,并且对于疾病的病理发生和进程有着促进作用。被激活的小胶质细胞会分泌出大量的促炎因子,如TNF-α、IL-1β、IL-6、过氧化物、一氧化氮等[11],给予小胶质细胞LPS刺激便可以迅速诱导细胞TNF-α和IL-1β的生成增多[12-13],小胶质细胞表现出神经毒性。但吞噬在中枢神经系统中的作用是利是弊一直存在争议,小胶质细胞的吞噬作用在清除细胞残片和神经元的突触可塑性上发挥着十分重要的作用[14]。本研究中选择LPS作为阳性对照药物,LPS是一种常用于激活小胶质细胞的工具药物,其动物模型在中枢神经系统研究中被认为是小胶质细胞激活的经典模型。侧脑室注射或全身注射LPS可诱导中枢神经系统中小胶质细胞的激活,并伴有神经元丢失[15-17]。体外研究[18-19]同样证实,LPS同样能诱导小胶质细胞的迅速激活,释放炎性因子,启动下游MAPK等通路。给予原代小胶质细胞或BV2细胞系细胞LPS刺激后,检测到小胶质细胞吞噬功能的增加[20],包括对神经元的吞噬。因此笔者选择了LPS作为可以明确病理性激活小胶质细胞炎性和吞噬功能的阳性药物,对比观察α-syn蛋白在炎性和吞噬两种功能上对小胶质细胞的激活程度。
本研究对比观察了帕金森病关键致病蛋白α-syn对于小胶质细胞炎性反应和吞噬功能的影响,结果显示,0.1~10 μmol/L剂量的α-syn能够显著升高原代小胶质细胞对于荧光微球的吞噬数量,按照剂量分别升高了0.92、1.62和3.10倍,0.1 μg/mL 的LPS刺激组增加了4.94倍,Park 等[21]在小胶质细胞细胞系BV2和原代大鼠小胶质细胞分别加入1 μmol/L α-syn,作用12 h发现细胞对荧光微球吞噬数分别增加了2倍和1.7倍,Labuzek等[22]用1 μg/mL LPS刺激原代大鼠小胶质细胞24 h,细胞吞噬相对于对照组增加约4倍,结果均与本报道一致。溶酶体作为细胞的消化器官,参与吞噬的整个过程中,应用CD68分子来标记溶酶体,可以反映细胞吞噬功能的变化[23-24]。为了进一步验证α-syn小胶质细胞吞噬功能的影响,通过CD68染色标记小胶质细胞溶酶体,免疫荧光染色结果提示,1 μmol/L的α-syn能够使小胶质细胞的CD68蛋白平均荧光强度增加2.2倍,高于LPS组的1.9倍。在炎性激活方面,他们发现在0.1、1、10 μmol/L剂量的α-syn刺激后24 h,细胞上清中释放的TNF-α增加了0.34、1.1和9.15倍,远低于LPS处理组的增加倍数(约611.5倍)。Hee课题组[25]给予原代小胶质细胞1、5和10 μmol/L剂量的α-syn刺激24 h,TNF-α蛋白释放量分别增加约2、7和10倍,与本结果相一致。RT-qPCR结果显示,1 μmol/L的α-syn使TNF-α和IL-1β转录水平分别增加0.9和1.9倍,然而LPS可以使TNF-α和IL-1β分别增加33.8倍和308.3倍。
以上结果提示,α-syn对于小胶质细胞吞噬功能的激活作用要高于对于炎性反应的激活。Neher 等[26]的研究发现,原代培养混合细胞体系中小胶质细胞的吞噬作用会主动诱导健康的神经元死亡,也就是说吞噬作用可能是神经元死亡的原因而不是后果,并且炎性反应在这一过程中扮演着重要的角色。因此本研究提示,α-syn主要是通过激活小胶质细胞的吞噬然后引起神经元被吞噬死亡,来产生致病效果。

